Amiloride通过抑制缺氧诱导的NHE1表达而延缓calpain介导的ABCA1降解*
2015-09-14莫显刚张洛超
莫显刚, 张 莉, 张洛超, 王 龙, 向 凝, 杨 涓, 宋 翔
(贵州医科大学附属医院老年病科,贵州贵阳550004)
动脉粥样硬化斑块中缺氧普遍存在,缺氧参与动脉粥样斑块形成发展[1-2]。胆固醇逆转运在泡沫细胞及动脉粥样斑块形成中起重要作用,三磷酸腺苷结合盒转运体A1(adenosine triphosphate-binding cassette transporter A1,ABCA1)是细胞胆固醇外流重要门户[3]。研究表明缺氧导致ABCA1转录水平及蛋白水平下调[2,4]。但缺氧是否引起ABCA1降解加速而导致蛋白水平下调尚未见研究。ABCA1蛋白被钙蛋白酶(Ca2+-dependent cysteine proteinase,calpain)特异性结合而降解,抑制calpain依赖ABCA1蛋白降解可能是抗动脉粥样硬化治疗重要靶点[3]。我们既往研究发现缺氧导致内皮细胞钠氢交换体1(sodium-hydrogen exchanger 1,NHE1)表达及 calpain活性增加[5],由此推测缺氧导致 NHE1表达及 calpain活性改变,进而加速ABCA1降解。为此,我们以RAW264.7细胞为研究对象,探讨缺氧对ABCA1降解的影响。
材料和方法
1 实验干预及分组
RAW264.7细胞(中科院细胞所)培养于含10%胎牛血清的DMEM/F12(Hyclone)培养基中,置于37℃、5%CO2培养箱中培养,待细胞融合至80% ~90%时,0.25%胰酶消化离心细胞,常规传代。实验分为3部分:(1)缺氧处理:使用1%O2、5%CO2及94%N2饱和湿度下培养,按缺氧时间将RAW264.7细胞分为缺氧0 h(对照组)、12 h、24 h及48 h共4组,继而检测细胞活力、NHE1表达、细胞内钙离子浓度([Ca2+]i)及calpain活性;(2)检测ABCA1降解:将缺氧24 h的细胞按文献[6]使用放线菌酮(cycloheximide;终浓度100 mg/L;Sigma)抑制细胞蛋白表达,并给予或不给予NHE1抑制剂阿米洛利(amiloride;终浓度100 μmol/L;Sigma)干预,分为对照组、缺氧组及缺氧+amiloride组,免疫印迹检测3组在0 h、6 h及12 h ABCA1蛋白的相对含量;(3)为探讨NHE1参与ABCA1降解的机制是否与calpain相关,以常氧培养细胞为对照,给予calpain抑制剂ALLN(终浓度100 μmol/L;Sigma)及胞内钙离子螯合剂BAPTA-AM(终浓度100 μmol/L;Sigma)缺氧细胞干预12 h,共分为对照组、amiloride组、缺氧组、缺氧+amiloride组、缺氧 +ALLN组、缺氧+ALLN+amiloride组、缺氧+BAPTA组和缺氧+BAPTA+amiloride组共8个组,免疫印迹法检测ABCA1蛋白的相对含量及calpain活性。
2 实验方法
2.1 MTT法检测细胞存活率 取对数生长期的RAW264.7细胞,以每孔5×103密度接种于96孔板,待细胞贴壁之后,给予缺氧不同时间,随后每孔加入20 μL MTT(Sigma),在二氧化碳培养箱37℃孵育4 h后,弃去上清,每孔加人150 μL DMSO,振荡后使用酶标仪于492 nm处检测吸光度(A)值,正常缺氧0 h组作为对照组,仅加入150 μL DMSO的孔作为空白对照。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)。
2.2 实时荧光定量 PCR 缺氧不同时间的RAW264.7细胞,提取总RNA,提取过程严格按照总RNA提取试剂盒和逆转录试剂盒说明操作。Realtime PCR 25 μL反应体系包括 SYBR Green Real-Time PCR Master Mix 12.5 μL、cDNA 模板 1 μL、NHE-1或β-actin上下游引物各0.5 μL。PCR进行35个循环,所有样本的CT值均由荧光定量PCR扩增仪GeneAmp 7300(Applied Biosystems)读取,得到样本中NHE-1和β-actin的Ct值。结果分析以βactin作为内参照,NHE1相对表达量采用2-ΔΔCt法进行计算。
2.3 Western blot检测NHE1及ABCA1蛋白的表达按试剂盒提取不同处理RAW264.7细胞蛋白。将细胞消化离心收集细胞,同时收集细胞培养液中的细胞,加入含蛋白酶抑制剂的裂解液冰上裂解细胞10 min,4 ℃ 12 000 r/min离心10 min,取上清,振荡混匀,BCA法测蛋白浓度,将蛋白分装-80℃保存。20~60 μg蛋白与上样缓冲液混匀后煮沸10 min,SDS-PAGE电泳,电泳结束后将蛋白转移到PVDF膜上,5% 脱脂牛奶封闭2 h,孵育 I抗(NHE1,1∶500,Abcam;ABCA1,1∶1 000,Abcam),4 ℃ 孵育过夜,TBST洗3次,每次10 min,孵育II抗,37℃孵育1 h,TBST洗3次,显影、定影。使用ImageJ分析软件进行分析。
2.4 细胞内Ca2+浓度的测定[7]取对数生长期细胞按每孔2.5×105接种6孔板,取缺氧不同时间的RAW264.7细胞,PBS冲洗2遍,加入终浓度5 μmol/L Fluo-3/AM(碧云天生物工程)的PBS避光37℃下干预60 min,每10 min振荡细胞1次,用PBS冲洗细胞3次之后避光静置20 min以保证细胞内的Fluo-3/AM完全变成Fluo-3,仅加入PBS的细胞作为空白对照之后,使用倒置荧光显微镜拍照。细胞干预后使用胰蛋白酶消化加入Fluo-3/AM进行流式细胞仪检测。
2.5 Calpain活性的测定 按calpain活性检测试剂盒(Promega)操作步骤进行检测。经不同处理因素干预RAW264.7细胞中加入无钙裂解液,取50 μL蛋白上清液用来检测calpain活性。每个样品分别加入含钙或无钙的缓冲液,再加入特异性荧光底物Suc-LLVY-aminoluciferin,37℃反应4 h,在酶标仪上读数(激发和发射波长分别为355和460 nm),其活性用含钙样品的读数减无钙样品的读数计算。
3 统计学处理
采用SPSS 17.0统计软件进行统计分析,计量资料用均数±标准差(mean±SD)表示,单因素方差分析后,组间差异比较用SNK-q检验或Tamhane T2检验,以P<0.05为差异有统计学意义。
结 果
1 不同缺氧时间对RAW264.7缺氧细胞活力及细胞死亡比率的影响
相对于对照组,其余各组细胞存活率均降低,缺氧24 h较缺氧12 h组差异不显著,48 h较0 h、12 h及24 h组均明显降低(P<0.05)。台盼蓝拒染实验示检测缺氧增加死亡细胞比率(P<0.05),48 h较0 h、12 h及24 h 3组明显增加(P<0.05),24 h与12 h比较差异不显著,见图1。

Figure 1.The effects of hypoxia on cell viability and cell survival.A:the results of MTT assay;B:the results of Trypan blue staining assay.Mean±SD.n=9.*P<0.05 vs 0 h;#P<0.05 vs 12 h;△P<0.05 vs 24 h.图1 缺氧对细胞活力及细胞死亡的影响
2 不同时间缺氧NHE1表达结果
RAW264.7细胞缺氧后NHE1表达较非缺氧组上调,缺氧12 h mRNA升高较明显,随缺氧时间延长,mRNA升高幅度减小(P<0.05)。缺氧后的蛋白水平,12 h升高,随缺氧时间延长NHE1蛋白表达升高,但48 h与24 h比较差异不显著。结合细胞活力结果,以下实验选择缺氧24 h的细胞检测ABCA1降解,见图2。

Figure 2.The effect of hypoxia on the expression of NHE1 at mRNA and protein levels.A:the results of real-time PCR;B:the results of Western blot.Mean±SD.n=4.*P<0.05 vs 0 h;#P<0.05 vs 12 h;△P<0.05 vs 24 h.图2 缺氧对NHE1 mRNA及蛋白表达的影响
3 缺氧对[Ca2+]i及calpain活性影响结果
在缺氧不同时间给予钙离子敏感荧光染料,结果显示随缺氧时间延长,钙离子浓度升高;流式细胞术检测亦显示缺氧时间延长,钙离子浓度升高。随缺氧时间延长,calpain活性升高,见图3。
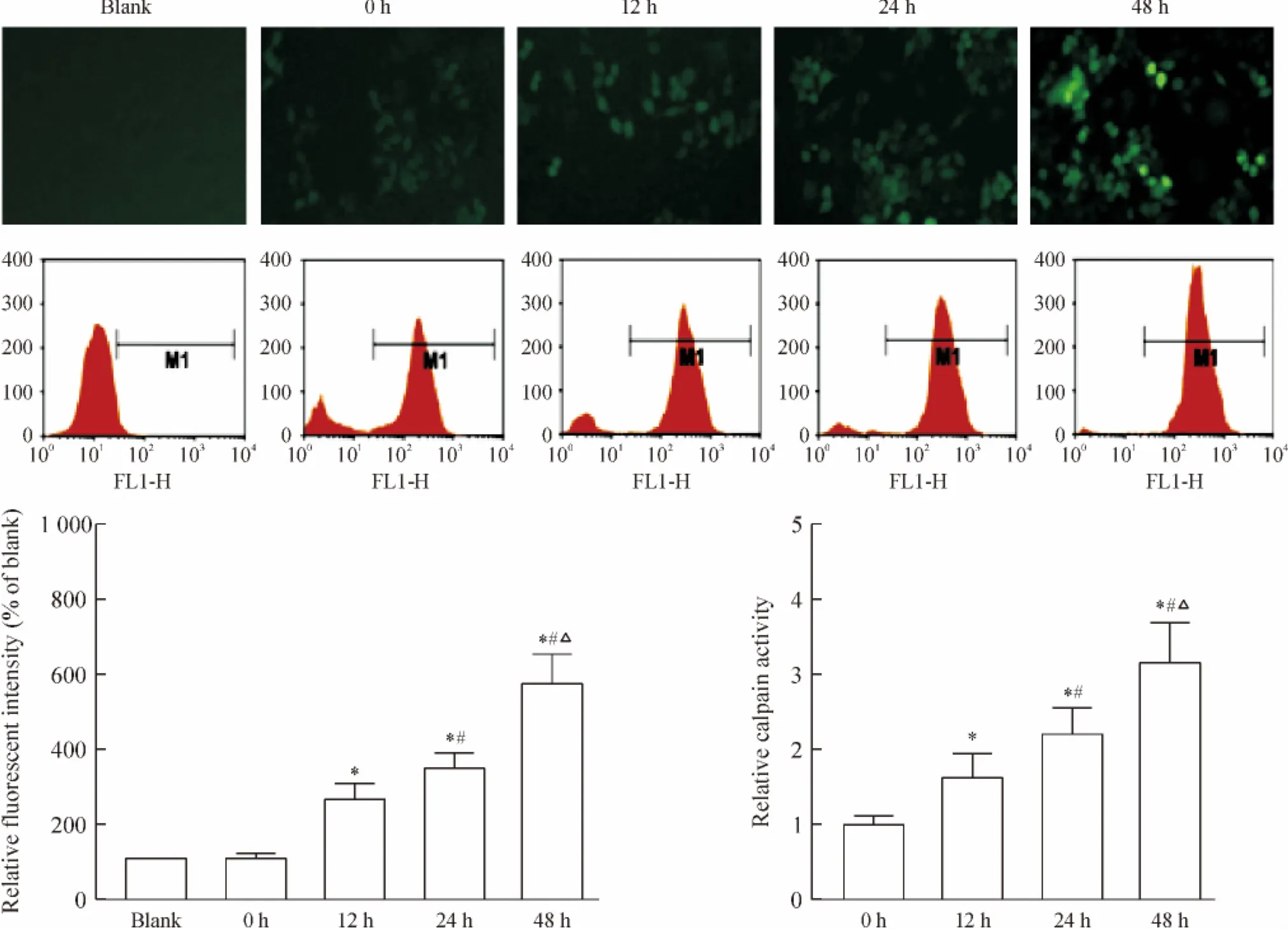
Figure 3.[Ca2+]iand calpain activity affected by hypoxia.Mean±SD.n=4.*P<0.05 vs 0 h;#P<0.05 vs 12 h;△P<0.05 vs 24 h.图3 缺氧对细胞内钙离子浓度及calpain活性的影响
4 Amiloride对缺氧24 h细胞ABCA1降解的影响
缺氧24 h细胞给予cycloheximide抑制蛋白合成6 h及12 h,同时给予或不给予amiloride干预,提取蛋白行Western blot检测ABCA1的蛋白水平。结果显示amiloride干预组的ABCA1量随时间进行性降低,下降幅度较未干预组及对照组缓慢,见图4。
5 ALLN及BAPTA对ABCA1降解的影响
为探讨amiloride延缓ABCA1降解机制是否与calpain相关,给予或不给予 ALLN及 BAPTA,检测ABCA1蛋白量。结果显示给予calpain抑制剂ALLN组ABCA1蛋白量高于无ALLN组(单纯缺氧组),而给予细胞内钙离子螯合剂BAPTA干预,结果类似于ALLN干预作用;在amiloride联合ALLN或 BAPTA干预可进一步升高ABCA1蛋白量,但与单纯amiloride干预的蛋白量相比较,差异无统计学意义。不论是单纯给予amiloride或ALLN或BAPTA干预缺氧24 h的细胞,还是amiloride联合ALLN或BAPTA处理,calpain的活性较缺氧组显著降低。结果还发现常氧条件下amiloride组与对照组比较,蛋白水平及calpain活性差异均无统计学意义,见图5。
讨 论
缺氧导致细胞ABCA1蛋白量降低及胆固醇外流异常[2,4]。本研究旨在探讨缺氧处理的 RAW264.7细胞在转录及翻译水平降低之外,是否存在ABCA1蛋白降解增加。本研究发现缺氧可增加NHE1表达、细胞内钙离子浓度及calpain活性;NHE1抑制剂延缓缺氧细胞 ABCA1蛋白降解,提示缺氧诱导NHE1可能通过增加细胞内钙离子浓度及calpain活性改变参与ABCA1蛋白降解。

Figure 4.The effect of amiloride on ABCA1 protein levels.Mean±SD.n=4.*P<0.05 vs control;#P<0.05 vs hypoxia;△P<0.05 vs 0h;▲P<0.05 vs 6 h.图4 Amiloride对ABCA1蛋白量的影响
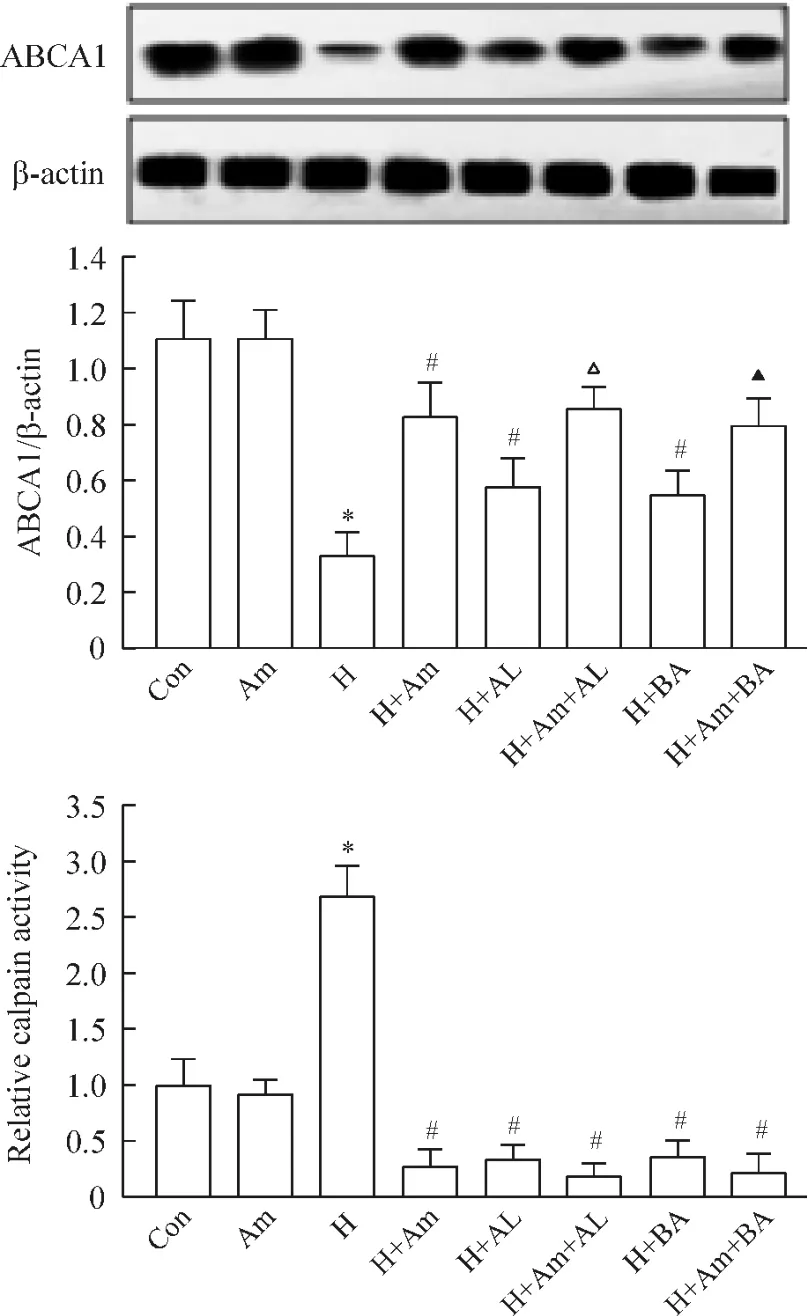
Figure 5.The effects of ALLN and BAPTA on ABCA1 degradation and calpain activity.Con:control;Am:amiloride;H:hypoxia;AL:ALLN;BA:BAPTA.Mean±SD.n=3.*P<0.05 vs Am;#P<0.05 vs H;△P<0.05 vs H+AL;▲P<0.05 vs H+BA.图5 ALLN及BAPTA对ABCA1蛋白降解及calpain活性的影响
细胞缺氧导致核因子HIF-1α积聚,后者启动下游靶基因激活转录。NHE1启动子中存在HIF-1α的缺氧反应元件,缺氧可以诱导NHE1表达升高。本研究也发现缺氧诱导RAW264.7细胞NHE1表达升高,这与我们以前的研究及其它研究一致[5,8-9],表明在心肌微血管内皮细胞、人脐静脉血管内皮细胞、肺动脉平滑肌细胞及巨噬细胞细胞系中均发现缺氧诱导上述细胞NHE1表达增加。本研究发现随缺氧时间增加,NHE1的mRNA表达有升高后再降低趋势,可能是随缺氧时间增加,缺氧细胞整体功能呈降低趋势。研究亦表明NHE1蛋白随缺氧时间逐渐升高,可能原因系NHE1蛋白降解半衰期长[10],提示缺氧诱导NHE1可能在细胞复氧时仍将细胞内产生过多的氢离子排除细胞外,对细胞生存极为重要。
NHE1在结构上包括细胞内起调节功能结构域及构成离子通道跨膜域,被认为是细胞膜上重要的支架蛋白。细胞内结构域与细胞内众多细胞信号通路相联系,调节或参与众多细胞功能如细胞增殖、分化、迁徙、凋亡、血管生成、代谢调节等[11]。本研究还发现缺氧后钙离子浓度增加及激活calpain活性。这与在内皮细胞及RAW264.7细胞中研究类似,其可能机制是NHE1激活,通过氢钠交换,细胞内钠离子浓度增加,激活钠钙交换,导致细胞内钙离子浓度增加[12-13]。Calpain是钙离子依赖的蛋白酶,细胞内钙离子浓度升高激活calpain。NHE1/calpain激活参与细胞生理及病理生理功能活动如细胞凋亡、运动等。
既往研究表明缺氧可降低ABCA1转录水平及蛋白水平表达[2,4],而本研究重点是探讨缺氧能否参与ABCA1降解。本研究预实验提示缺氧+NHE1抑制剂干预对细胞活力影响极大(结果未提供),鉴于NHE1蛋白降解半衰期长,采用缺氧后复氧细胞进行研究。研究中cycloheximide抑制蛋白合成翻译过程,排除新蛋白产生对研究的影响,对ABCA1蛋白降解研究方法比较可靠。常氧条件下amiloride干预未能显著改变蛋白水平及calpain活性,提示ABCA1蛋白水平及calpain活性改变可能与缺氧诱导NHE1密切相关。本研究的重要发现是相对于对照组,NHE1抑制剂可以延缓缺氧后RAW264.7细胞中ABCA1降解;calpain抑制剂ALLN及细胞内钙离子螯合剂 BAPTA亦可升高 ABCA1蛋白水平,但是amiloride基础上ALLN或BAPTA干预,ABCA1蛋白水平并未高于单纯给予amiloride组蛋白水平;给予amiloride、ALLN或BAPTA都显著降低calpain活性。ABCA1降解存在calpain依赖或非依赖2种降解方式[6]。本研究结果还提示缺氧诱导NHE1及calpain活性增加,至少部分参与ABCA1降解加速过程,导致缺氧后ABCA1蛋白水平下降。除此之外,缺氧诱导ABCA1降解可能存在calpain非依赖降解方式,具体机制有待进一步明确。
除缺氧外,血管紧张素系统[14]、高糖[15]及脂多糖等致动脉粥样硬化的因子也可激活或诱导NHE1,或许能增加calpain活性及促进ABCA1降解,对于进一步探讨动脉粥样硬化形成机制提供新的思路。另外ABCA1与HDL关系极其密切,呼吸暂停低氧血症综合征患者发生冠心病几率增加,并有血脂代谢紊乱,其中重要改变是HDL水平降低[16-17]。本研究发现缺氧导致ABCA1降解加速,在一定程度上可部分解释上述HDL水平降低的发病机制。
本研究仍存在一些不足。缺氧时间仅选择12 h、24 h及48 h,尚未完全阐明缺氧对NHE1时空表达,如短暂缺氧对非转录水平的影响。本研究尚需对NHE1活性做进一步研究。NHE1抑制剂药物浓度选择需更为细化。
总之,本研究缺氧诱导NHE1表达,上调细胞内钙离子浓度及calpain活性,进而加速ABCA1降解。表明缺氧诱导NHE1表达可能是ABCA1降解的重要机制。本研究为进一步探讨缺氧导致细胞脂质代谢异常以及NHE1参与动脉粥样硬化斑块形成机制有重要意义。
[1] Mateo J,Izquierdo-Garcia D,Badimon JJ,et al.Noninvasive assessment of hypoxia in rabbit advanced atherosclerosis using18F-fluoromisonidazole positron emission tomographic imaging[J].Circ Cardiovasc Imaging,2014,7(2):312-320.
[2] Parathath S,Mick SL,Feig JE,et al.Hypoxia is present in murine atherosclerotic plaques and has multiple adverse effects on macrophage lipid metabolism[J].Circ Res,2011,109(10):1141-1152.
[3] Wang N,Chen W,Linsel-Nitschke P,et al.A PEST sequence in ABCA1 regulates degradation by calpain protease and stabilization of ABCA1 by apoA-I[J].J Clin Invest,2003,111(1):99-107.
[4] 汪煜华,刘运美,郭紫芬,等.缺氧对 RAW264.7细胞ABCA1的表达及胆固醇流出的影响[J].中国动脉硬化杂志,2011,19(4):315-318.
[5] Mo XG,Chen QW,Li XS,et al.Suppression of NHE1 by small interfering RNA inhibits HIF-1α-induced angiogenesis in vitro via modulation of calpain activity[J].Microvasc Res,2011,81(2):160-168.
[6] Mujawar Z,Tamehiro N,Grant A,et al.Mutation of the ATP cassette binding transporter A1(ABCA1)C-terminus disrupts HIV-1 Nef binding but does not block the Nef enhancement of ABCA1 protein degradation[J].Biochemistry,2010,49(38):8338-8349.
[7] Li R,Zhang L,Shi W,et al.NFAT2 mediates high glucose-induced glomerular podocyte apoptosis through increased Bax expression[J].Exp Cell Res,2013,319(7):992-1000.
[8] 莫显刚,陈庆伟,王 丽,等.缺氧-复氧对大鼠心肌微血管内皮细胞中钠氢交换体-1的表达及活性影响[J].第三军医大学学报,2011,33(5):489-492.
[9] Rios EJ,Fallon M,Wang J,et al.Chronic hypoxia elevates intracellular pH and activates Na+/H+exchange in pulmonary arterial smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2005,289(5):L867-L874.
[10] Cavet ME,Akhter S,Murtazina R,et al.Half-lives of plasma membrane Na+/H+exchangers NHE1-3:plasma membrane NHE2 has a rapid rate of degradation[J].Am J Physiol Cell Physiol,2001,281(6):C2039-C2048.
[11] Baumgartner M,Patel H,Barber DL.Na+/H+exchanger NHE1 as plasma membrane scaffold in the assembly of signaling complexes[J].Am J Physiol Cell Physiol,2004,287(4):C844-C850.
[12] Cui GM,Zhao YX,Zhang NN,et al.Amiloride attenuates lipopolysaccharide-accelerated atherosclerosis via inhibition of NHE1-dependent endothelial cell apoptosis[J].Acta Pharmacol Sin,2013,34(2):231-238.
[13] Li JF,Chen S,Feng JD,et al.Probucol via inhibition of NHE1 attenuates LPS-accelerated atherosclerosis and promotes plaque stability in vivo[J].Exp Mol Pathol,2014,96(2):250-256.
[14] Eguti DM,Thieme K,Leung GP,et al.Regulation of Na+/H+exchanger isoform 1(NHE1)by calmodulinbinding sites:role of angiotensin II[J].Cell Physiol Biochem,2010,26(4-5):541-552.
[15] Koliakos G,Zolota Z,Paletas K,et al.High glucose concentrations stimulate human monocyte sodium/hydrogen exchanger activity and modulate atherosclerosis-related functions[J].Pflugers Arch,2004,449(3):298-306.
[16] 梁 伟,胡家安,何 清,等.老年人阻塞性睡眠呼吸暂停综合征与冠心病关系的探讨[J].中华老年心脑血管病杂志,2005,7(2):88-90.
[17] 周燕斌,谢灿茂,肖海鹏,等.肥胖症伴阻塞性睡眠呼吸暂停与胰岛素抵抗及高胰岛素血症的关系[J].中华内分泌代谢杂志,2002,18(3):181-183.
