多孔钽棒植入治疗早中期股骨头坏死的生存率分析和预后因素评估*
2015-09-13汪亮刘耀升刘蜀彬王磊曹云岑苏秀云周诗国
汪亮 刘耀升** 刘蜀彬 王磊 曹云岑 苏秀云 周诗国
(1.解放军第307医院骨科,北京100071;2.首都医科大学附属北京友谊医院统计室,北京100050)
股骨头坏死(avascular necrosis of femoral head,ANFH)是一种多致病因素引起的致残性疾病,导致股骨头软骨下骨血供中断或受损,既而引起骨细胞死亡、骨小梁断裂和关节面塌陷[1]。ANFH也是一种难治性疾病,发病年龄以50岁左右为主,好发于30~50岁,多数累及双侧髋关节,晚期ANFH患者需行全髋关节置换术(total hip arthroplasty,THA)。
既往ANFH保存关节手术包括髓芯减压术和以此为基础的不带血管蒂松质骨或皮质骨移植术、带肌蒂髂骨移植术、人工骨植入术、带血管蒂游离腓骨移植术、多枚小钽钉植入术,以及经股骨转子间旋转截骨术[2-7],其中较常用的为髓芯减压结合人工骨植入术。相对于游离腓骨移植术,多孔钽棒植入被认为是一种合适的选择性替代。目前文献中虽有关于多孔钽棒植入治疗ANFH的研究报道[9-11],但上述文献报道随访时间较短,多孔钽棒植入治疗ANFH的临床疗效、术后负重时间及作用机制仍有较大争议[9,12]。
本研究的目的是分析多孔钽棒植入治疗ANFH的中期生存数据,并与既往打压植入复合人工骨材料患者组比较,同时确定转归至THA的独立预后因素。
1 资料与方法
1.1 临床资料
诊断标准:①MRI诊断标准:短Tau反转回复程序像形成环形或带状低信号区,外侧包绕区为高信号;T1加权像股骨头内出现环状或带状低信号带包绕一高信号区。②X线诊断标准:股骨头内出现囊性变的坏死骨、包绕囊性变的硬化带。
纳入与排除标准:①纳入标准:年龄在19~65岁之间;体重指数<40;不愿意接受带血管蒂游离腓骨移植SteinbergⅠ、Ⅱ期ANFH患者;术后随访时间≥3年;所有患者同意手术并签署知情同意书。②排除标准:SteinbergⅢ、Ⅳ期ANFH患者;先前同侧髋关节接受过手术、物理疗法以及药物治疗的ANFH患者。
检索解放军第307医院病案室数据库,选择2009年4月至2011年7月进行的前瞻性、连续性接受钽棒植入治疗的SteinbergⅠ、Ⅱ期ANFH患者42例(52髋)作为多孔钽棒组;选择2007年4月至2009年3月进行的回顾性、连续性髓芯减压打压植入人工骨填充颗粒的SteinbergⅠ、Ⅱ期ANFH患者36例(49髋)为复合人工骨材料组[13]。记录术前人口统计学资料:年龄、性别、病因、单双侧发病、皮质激素使用、相关慢性系统性疾病、Steinberg分期、伴有股骨头骨髓水肿和骨坏死病灶大小等。
1.2 手术方法
患者取平卧位,麻醉成功后常规消毒铺巾,在C型臂X线机透视引导下由患髋外侧股骨大转子下3.0 cm处插入1枚2.5 mm直径的克氏针作为导针,克氏针的尖端距软骨下骨5.0 mm。纵行切开皮肤、皮下筋膜约2.0 cm,将8.0 mm、9.0 mm、10.0 mm等不同外径的空心钻沿导针逐级缓慢钻透股骨头坏死区硬化带,直至距股骨头软骨下骨5.0 mm处。依次拔出空心钻和导针,运用可控式铰刀逐级分象限旋转扩大,对骨坏死区充分减压,利用刮匙在股骨头坏死区进一步刮除坏死骨或脂髓。多孔钽棒组测深并攻丝后将多孔钽棒(Trabecular Metal,Zimmer,Co.USA)的远端放置于距软骨下骨板5 mm处;复合人工骨材料组经骨隧道由深至浅打压植入颗粒状多孔型医用纳米羟基磷灰石/聚酰胺66复合骨填充材料(四川国纳科技有限公司提供),用顶棒各方向填充压实人工骨颗粒[14],植骨厚度达5.0~8.0 mm。两组切口放置负压引流管后缝合切口。两组患者的手术均由同一组医师完成。
1.3 术中、术后处理及康复锻炼
术中记录失血量和输血情况,术后记录住院时间。两组患者术前30 min及术后1 d常规静脉给予抗生素预防切口感染,术后1~2 d拔除引流管,术后14 d切口拆线。术后3个月内患髋完全限制负重,3个月后持双拐部分负重,6个月后完全负重,12个月后可从事重体力劳动及体育活动。
1.4 随访计划及疗效评估
术后1年内每3个月、术后1年后每半年随访一次。随访内容包括:①Harris髋关节功能评分(≥90分为优,80~90分为良,70~80分为尚可,≤69分为差);②双髋关节前后位和蛙式侧位X线片检查,评估股骨头内坏死病灶的大小、股骨头形态的完整性、软骨下骨骨折和髋关节发生的退行性改变;③患髋关节MRI,评估股骨头坏死病灶大小的改变,股骨头颈内骨髓水肿和髋关节积液的情况。股骨头内坏死区面积≥30%被定义为股骨头大面积坏死[8];股骨头颈、股骨转子间区T1加权像出现边缘不清的低信号区,相应区域T2加权像或反转恢复程序像的高信号区被定义为骨髓水肿[15-18]。
1.5 统计学处理
应用SPSS 13.0软件进行统计学分析。计量资料用x±s表示,计数资料用例数(构成比)表示。对人口统计学及基线特征分析,采用独立两样本t检验处理计量资料,采用χ2检验或Fisher精确检验(资料不满足χ2检验的前提条件时)处理计数资料。两组术前和术后Harris评分的变化,采用线性混合模型分析。以THA作为观察终点,行Kaplan-Meier生存曲线分析,采用log-rank检验(Mantel-Cox)考察分层因素的效应。这些分层因素包括:手术时年龄(<50岁/≥50岁)、双侧发病(是/否)、皮质激素使用(是/否)、相关慢性系统性疾病(是/否)、Harris评分(>80分/<80分)、Steinberg分期(Ⅰ/Ⅱ)、伴有股骨头骨髓水肿(是/否)、骨坏死区大小(>30%/<30%)、治疗方法(多孔钽棒/复合人工骨填充材料)。采用Cox比例风险模型确定转归至THA的预后因素。所有检验均为双侧检验,P<0.05时为差异有统计学意义。
2 结果
2.1 两组患者术前人口统计学及基线特征
两组患者年龄介于19~65岁,且以男性居多。两组患者的年龄、性别、患侧(单、双侧)、病因、是否伴有相关慢性系统性疾病、术前Steinberg分期、术前Harris评分、骨髓水肿、骨坏死病灶大小、术前症状持续时间比较均无统计学差异(P>0.05,表1)。
2.2 术中失血量及术后住院时间
多孔钽棒组的术中失血量为(80±21)ml(45~170 ml),明显低于复合人工骨材料组的(110±36)ml(70~180 ml)(P<0.05)。多孔钽棒组住院时间为(8±3)d(5~14 d),明显低于复合人工骨材料组的(13±2)d(12~14 d)(P<0.05)。

表1 多孔钽棒组和复合人工骨材料组人口统计学及基线特征
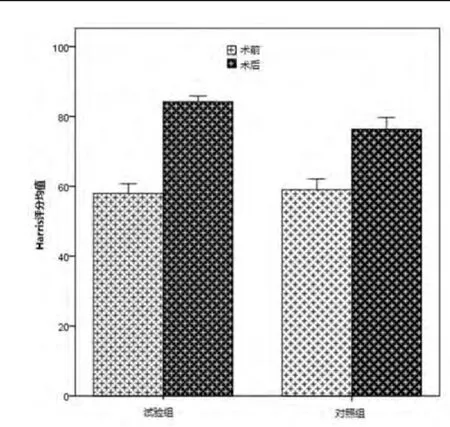
图1 末次随访多孔钽棒组与复合人工骨材料组髋关节Harris评分
2.3 术后Haarrrriiss评分变化
两组患者均获得随访。多孔钽棒组平均随访时间为(48.2±4.5)个月(38~62个月),复合人工骨材料组平均随访时间为(71.6±5.1)个月(67~85个月)。末次随访时,多孔钽棒组Harris评分为(84.18±2.35)分,复合人工骨材料组Harris评分为(76.34±2.67)分,两组患者髋关节Harris评分较术前均有显著提高,差异有统计学意义(P<0.0001)。多孔钽棒组髋关节Harris评分提高(26.2±2.5)分,复合人工骨材料组提高(17.3±3.6)分,与复合人工骨材料组相比,多孔钽棒组髋关节Harris评分提高幅度较大,差异有统计学意义(F=4.22,P=0.0426,图1)。
2.4 转归至THA的生存率分析和预后因素评估
多孔钽棒组52髋中仅8髋(15.4%)转归至THA,而复合人工骨材料组49髋中有18髋(36.7%)转归至THA(RR=0.4712,95%CI:0.2217~1.0011,u=-1.7793,P=0.0752)。Kaplan-Meier生存曲线比较显示,随访62个月时,多孔钽棒组髋关节累计生存率明显高于复合人工骨材料组髋关节累计生存率(74.1%±9.5%vs49.9%±10.8%,χ2=3.912,P=0.048,图2)。
2.4.1 是否伴有股骨头骨髓水肿
伴有股骨头骨髓水肿的髋关节,57髋中有21髋(36.8%)转归至THA;未伴有股骨头骨髓水肿的髋关节,44髋中仅3髋(6.8%)转归至THA(RR=5.4035,95%CI:1.37213~16.9631,u=3.0692,P=0.0021)。Kaplan-Meier生存曲线比较显示,随访62个月时,伴有股骨头骨髓水肿的髋关节累计生存率明显低于未伴有股骨头骨髓水肿的髋关节累计生存率(39.3%±11.3%vs87.5%±7.5%,χ2=14.134,P=0.000,图3)。
2.4.2 是否使用皮质激素
皮质激素使用的髋关节,34髋中有14髋(41.2%)转归至THA;未使用皮质激素的髋关节,64髋中仅10髋(15.6%)转归至THA(RR=2.4216,95%CI:1.1985~4.8929,u=2.2064,P=0.0274)。Kaplan-Meier生存曲线比较显示,随访62个月时,皮质激素使用的髋关节累计生存率明显低于未使用皮质激素的髋关节累计生存率(47.5%±11.8%vs71.6%±9.6%,χ2=5.33,P=0.021,图4)。
2.4.3 是否伴有相关慢性系统性疾病
伴有相关慢性系统性疾病的髋关节,24髋中有10髋(41.7%)转归至THA;未伴有相关慢性系统性疾病的髋关节,77髋中仅14髋(18.2%)转归至THA(RR=2.2619,95%CI:1.1583~4.4171,u=2.0265,P=0.0427)。Kaplan-Meier生存曲线比较显示,随访62个月时,伴有相关慢性系统性疾病的髋关节累计生存率明显低于未伴有相关慢性系统性疾病的髋关节累计生存率(44.6%±13.1%vs69.2%±8.5%,χ2=4.197,P=0.04,图5)。
根据当前所研究的数据显示,当通过Steinberg分期(χ2=0.038,P=0.846)、骨坏死病灶>30%(χ2=0.501,P=0.479)、双侧发病(χ2=2.229,P=0.632)、Harris评分>80分(χ2=2.623,P=0.105)、年龄<50岁(χ2=2.966,P=0.085)分层研究时,术后生存曲线间差异无统计学意义。48个月和62个月人口统计学变量和影像学参数见表2。
Cox比例风险模型显示,多孔钽棒植入(RR=0.036,P=0.012)、股骨头骨髓水肿(RR=7.090,P=0.003)、皮质激素使用(RR=3.599,P=0.007)、年龄<50岁(RR=0.319,P=0.014)为转归至THA的独立预后因素。对于相关慢性系统性疾病、双侧发病、Steinberg分期、Harris评分>80分、骨坏死病灶>30%等因素与转归至THA无统计学相关性(表3)。
3 讨论
随着各种治疗方法的出现和技术的进步,ANFH各种保头方法也在不断出现,治疗效果也在不断提高,但有些保头治疗方法存在患者难以忍受的并发症以及医师需要丰富的手术经验。很多学者都认为髓芯减压结合多孔钽棒植入是治疗早中期股骨头坏死最主要的方法之一,股骨头坏死区越小,钽棒治疗效果越佳[19,20,21]。
股骨头髓芯减压能改变股骨头内封闭状态,降低髓内压,疏通静脉瘀滞,增加血流量,改善血液循环。通过对股骨头内钻孔而清除硬化骨和坏死骨,利于血管再生和新生骨生长,启动创伤修复和骨愈合过程,从而促进坏死区的爬行替代。多孔钽棒植入可提供有效的结构性支撑,从而防止因髓芯减压而导致的继发性股骨颈骨折及股骨头塌陷等并发症;此外,多孔钽棒又具有增强坏死区再血管化、优异的生物相容性、迅速的骨长入以及无应力遮挡等优势。有研究表明,髓芯减压结合多孔钽棒植入能明显改善髋关节功能,提高髋关节生存期,延缓或阻止股骨头塌陷[22]。
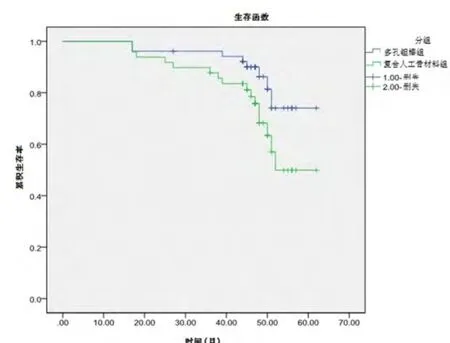
图2 术后随访62个月时多孔钽棒组和复合人工骨材料组髋关节累计生存率比较
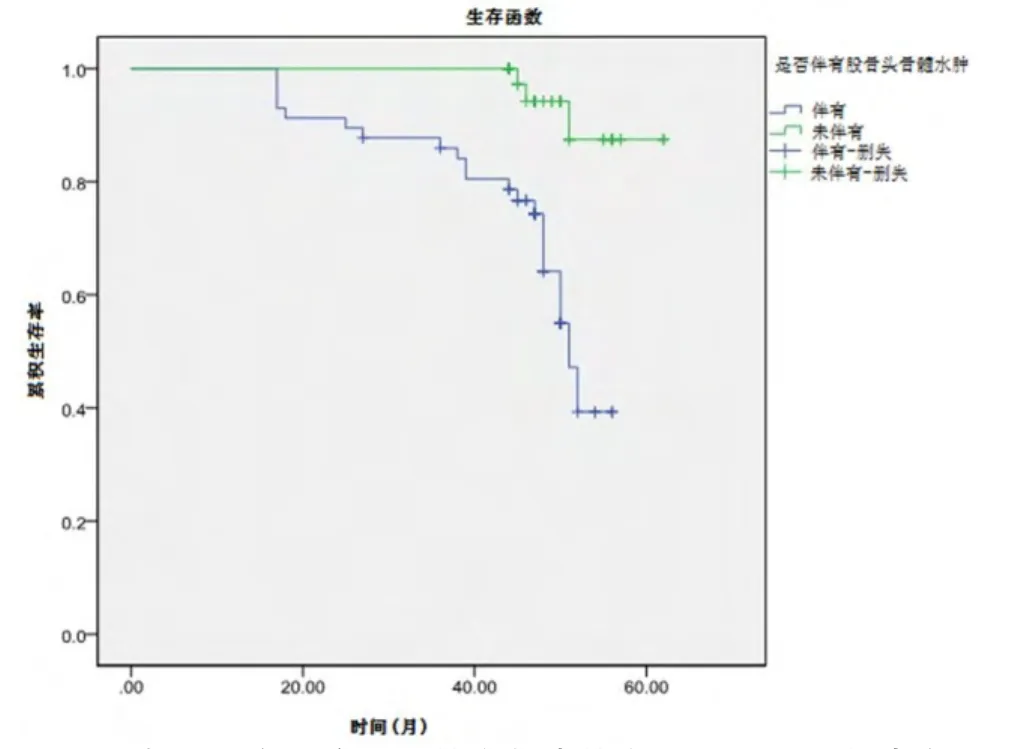
图3 术后随访62个月时伴有与未伴有股骨头骨髓水肿的髋关节累计生存率比较

图4 术后随访62个月时使用与未使用皮质激素的髋关节累计生存率比较
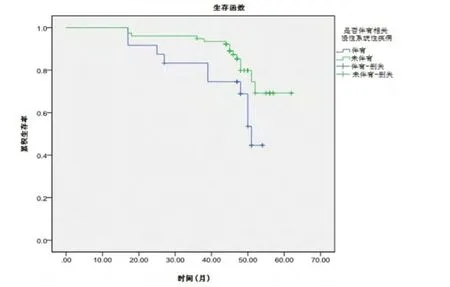
图5 术后随访62个月时伴有与未伴有相关慢性系统性疾病髋关节累计生存率比较
Veillette等[23]研究54例(60髋)多孔钽棒治疗Ⅰ~Ⅲ期ANFH,9髋转归至THA。术后1年髋关节总体生存率为91.8%,2年的生存率为81.7%,4年的生存率为68.1%。Shuler等[24]研究多孔钽棒治疗早期ANFH得出髋关节生存率为86%。Varitimidis等[9]对Ⅱ~Ⅳ期股骨头坏死患者行多孔钽棒植入后平均随访38个月,髋关节生存率为70%。Malizos等[7]使用多个小钽钉治疗早期股骨头坏死21例(26髋),平均随访46个月(18~67个月),平均生存期为60个月。Zhao等[25]研究多孔钽棒结合带血管蒂髂骨移植治疗42例(56髋)Ⅱ~Ⅳ期ANFH,平均随访60个月的髋关节生存率为87.5%。叶福生等[26]使用多孔钽棒治疗早中期ANFH近期疗效分析25例(39髋),平均随访37.4个月(6~47个月),术后6个月的髋关节生存率为97.4%,1年的生存率为94.7%,2年的生存率为88.6%,3年的生存率为72.5%。Zhao等[27]对21例(31髋)Ⅲc期和Ⅳ期ANFH患者行自体骨髓干细胞结合多孔钽棒植入和带血管蒂髂骨移植治疗,平均随访64个月,仅1髋转归至THA,Ⅲc期和Ⅳ期关节保存率分别为89.5%和75%。Liu等[28]研究44例(57髋)Ⅰ~Ⅳ期ANFH,术后60个月髋关节总体生存率为72.5%。以上数据表明多孔钽棒治疗早中期ANFH的中期生存率较高,能延迟或阻止髋关节转归至THA。本研究结果显示术后3个月内完全限制负重,多孔钽棒植入组平均随访48.2个月(38~62个月),52髋中仅有8髋转归至THA。术后24个月髋关节累计生存率为96.2%,36个月累计生存率为91.3%,48个月累计生存率为86.3%以及62个月累计生存率为74.1%。与以上研究相比,本研究早中期随访结果支持并且超过一些学者研究的结果,可能是本研究中可控式铰刀多象限减压时充分清除了坏死骨,并且术后推迟了负重时间。
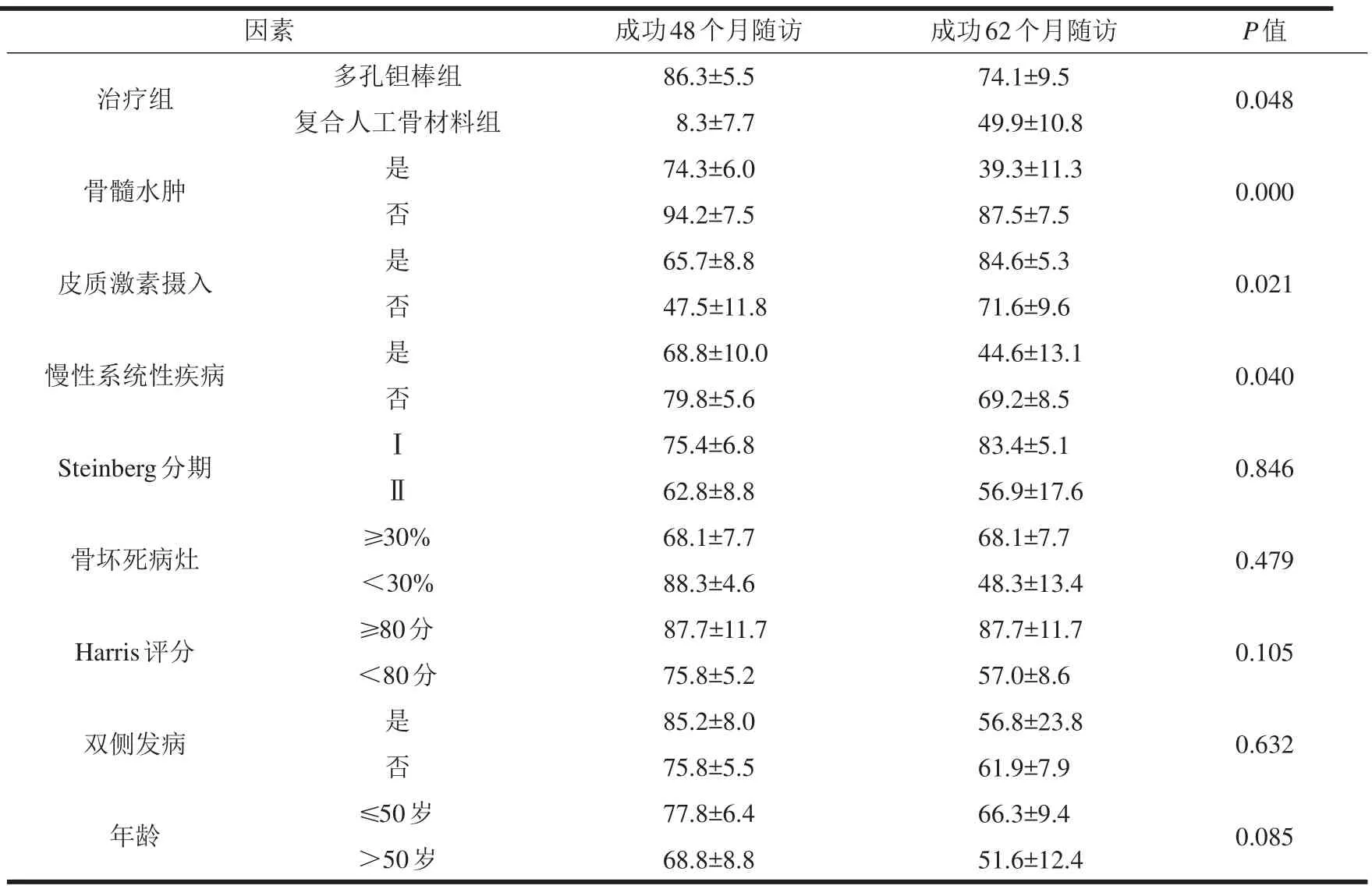
表2 多孔钽棒组和复合人工骨材料组随访48个月和62个月累计生存率(%%)
He等[29]研究认为AVFH伴随股骨头骨髓水肿与疼痛和股骨头坏死分期有较大相关性,也是股骨头预后不良的标志。早期AVFH未出现水肿,而出现水肿则已说明坏死已经进入晚期,并且影像学分期最终已发生进展[16,17]。本研究也同样与此,亦可证实股骨头骨髓水肿为钽棒植入后转归至THA最重要的独立预后因素。虽然本研究中伴有股骨头骨髓水肿的髋关节数量有限,但结果表明伴有股骨头骨髓水肿(62个月39.3%)的髋关节生存率显著低于未伴有股骨头骨髓水肿的(62个月87.5%)髋关节生存率。伴有股骨头骨髓水肿的髋关节转归至THA的相对危险度是未伴有股骨头骨髓水肿髋关节的5.4倍。

表3 转归至THA风险增高的变量
皮质激素的使用是股骨头坏死的重要因素之一。据研究显示,皮质激素相关性骨坏死的疗效较差。有学者认为皮质激素的使用是骨坏死进展的独立预后因素,与分期无关。Bozic等[30]证实在多孔钽棒治疗股骨头坏死的髋关节生存分析中得出,皮质激素的使用和髋关节生存率之间存在独立预后关系。本研究也同样与此,亦可证实皮质激素使用为钽棒植入后转归至THA最重要的独立预后因素。本研究结果显示,皮质激素使用(62个月84.6%)的髋关节生存率显著低于未使用皮质激素(62个月71.6%)的髋关节生存率。皮质激素使用的髋关节转归至THA的相对危险度是未使用皮质激素髋关节的2.42倍。
Simank等[31]使用Cox回归分析认为手术年龄小于40岁的患者再次手术的风险增高。此外,据Veillette等[23]单变量或多变量分析研究显示,髋关节转归至THA与年龄大于50岁之间差异无统计学意义。虽然本研究证实年龄小于50岁为髋关节转归至THA的独立预后因素,但不能证实在髋关节总体生存率间差异有统计学意义。
综上所述,髓芯减压结合多孔钽棒植入治疗SteinbergⅠ、Ⅱ期ANFH可显著缓解髋关节疼痛、改善髋关节功能以及提高髋关节生存率。对于未使用皮质激素,尤其是未伴有股骨头骨髓水肿的早中期ANFH,髓芯减压结合多孔钽棒植入可使髋关节获得更高的生存率,并能延迟或阻止THA的转归。
[1]Kaushik AP,Das A,Cui Q.Osteonecrosis of the femoral head:An update in year 2012.World J Orthop,2012,3(5):49-57.
[2]Wei BF,Ge XH.Treatment of osteonecrosis of the femoral head with core decompression and bone grafting.Hip Int,2011,21(2):206-210.
[3]Baksi DP,Pal AK,Baksi DD.Long-term results of decompression and muscle-pedicle bone grafting for osteonecrosis of the femoral head.Int Orthop,2009,33(1):41-47.
[4]Ito H,Tanino H,Yamanaka Y,et al.Long-term results of conventional varus half-wedge proximal femoral osteotomy for the treatment of osteonecrosis of the femoral head.J Bone Joint Surg Br,2012,94(3):308-314.
[5]李宇,肖琳,第五文科,等.髓芯减压结合复合人工骨治疗早期股骨头坏死的疗效分析.中国骨与关节损伤杂志,2013,28(4):342-343.
[6]Watters TS,Browne JA,Orlando LA,et al.Cost-effectiveness analysis of free vascularized fibular grafting for osteonecrosis of the femoral head.J Surg Orthop Adv,2011,20(3):158-167.
[7]Malizos KN,Papasoulis E,Dailiana ZH,et al.Early results of a novel technique using multiple small tantalum pegs for the treatment of osteonecrosis of the femoral head:a case series involving 26 hips.J Bone Joint Surg Br,2012,94(2):173-178.
[8]Pedersen DR,Brown TD,Poggie RA.Finite element characterization of a porous tantalum material for treatment of avascular necrosis.Trans Orthop Res Soc,1997,22:598.
[9]Varitimidis SE,Dimitroulias AP,Karachalios TS,et al.Outcome after tantalum rod implantation for treatment of femoral head osteonecrosis:26 hips followed for an average of 3 years.Acta Orthop,2009,80(1):20-25.
[10]Floerkemeier T,Lutz A,Nackenhorst U,et al.Core decompression and osteonecrosis intervention rod in osteonecrosis of the femoral head:clinical outcome and finite element analysis.Int Orthop,2011,35(10):1461-1466.
[11]Floerkemeier T,Thorey F,Daentzer D,et al.Clinical and radiological outcome of the treatment of osteonecrosis of the femoral head using the osteonecrosis intervention implant.Int Orthop,2011,35(4):489-495.
[12]Nadeau M,Séguin C,Theodoropoulos JS,et al.Short term clinical outcome of a porous tantalum implant for the treatment of advanced osteonecrosis of the femoral head.Mcgill J Med,2007,10(1):4-10.
[13]Liu Y,Liu S,Su X.Core decompression and implantation of bone marrow mononuclear cells with porous hydroxylapatite composite filler for the treatment of osteonecrosis of the femoral head.Arch Orthop Trauma Surg,2013,133(1):125-133.
[14]刘耀升,刘蜀彬,苏秀云,等.髓芯减压结合浓集自体BMMCs移植羟基磷灰石复合人工骨植入治疗股骨头坏死.中华医学杂志,2013,93(27):145-150.
[15]Steinberg ME,Hayken GD,Steinberg DR.A quantitative system for staging avascular necrosis.Bone Joint Surg Br,1995,77(1):34-41.
[16]Huang GS,Chan WP,Chang YC,et al.MR imaging of bone marrow edema and joint effusion in patients with osteonecrosis of the femoral head:relationship to pain.AJR Am J RoentgenolAug,2003,181(2):545-549.
[17]Iida S,Harada Y,Shimizu K,et al.Correlation between bone marrow edema and collapse of the femoral head in steroid-induced osteonecrosis.AJR Am J Roentgenol,2000,174(3):735-743.
[18]Ito H,Matsuno T,Minami A.Relationship between bone marrow edema and development of symptoms in patients with osteonecrosis of the femoral head.AJR Am J Roentgenol,2006,186(6):1761-1770.
[19]Liu G,Wang J,Yang S,et al.Effect of a porous tantalum rod on early and intermediate stages of necrosis of the femoral head.Biomed Mater,2010,5(6):065003.
[20]Biomechanical supporting effect of tantalum rods for the femoral head with various sized lesions:a finite-element analysis.Chin Med J(Engl),2012,(125):4061-4065.
[21]Liu ZH,Guo WS,Li ZR,et al.Porous tantalum rods for treating osteonecrosis of the femoral head.Genet Mol Res,2014,13(4):8342-8352.
[22]Porous tantalum rod implant is an effective and safe choice for early-stage femoral head necrosis:a meta-analysis of clinical trials.Eur J Orthop Surg traumatol,2013,23(2):211-217.
[23]Veillette CJ,Mehdian H,Schemitsch EH,et al.Survivorship analysis and radiographic outcome following tantalum rod insertion for osteonecrosis of the femoral head.J Bone Joint SurgAm,2006,88:48-55.
[24]Shuler MS,Rooks MD,Roberson JR.Porous tantalum implant in early osteonecrosis of the hip:preliminary report on operative,survival,and outcomes results.J Arthroplasty,2007,22(1):26-31.
[25]Zhao D,Zhang Y,Wang W,et al.Tantalum rod implantation and vascularized iliac grafting for osteonecrosis of the femoral head.Orthopedics,2013,36(6):789-795.
[26]叶福生,倪哲吉,储小兵,等.钽棒置入治疗早期股骨头坏死近期疗效分析.中国骨伤,2013,26(8):646-650.
[27]Zhao D,Liu B,Wang B,et al.Autologous bone marrow mesenchymal stem cells associated with tantalum rod implantation and vascularized iliac grafting for the treatment of end-stage osteonecrosis of the femoral head.Biomed Res Int,2015:240506.
[28]Liu Y,Su X,Zhou S,et al.A modified porous tantalum implant technique for osteonecrosis of the femoral head:survivorship analysis and prognostic factors for radiographic progression and conversion to total hip arthroplasty.Int J Clin Exp Med,2015,8(2):1918-1930.
[29]He W,Zeng Q,Zhang Q,et al.Study on correlation between pain grading,stage of necrosis and bone marrow-edema in non traumatic osteonecrosis of femoral head.Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2008,22(3):299-302.
[30]Bozic KJ,Zurakowski D,Thornhill TS.Survivorship analysis of hips treated with core decompression for nontraumatic osteonecrosis of the femoral head.J Bone Joint Surg Am,1999,81(2):200-209.
[31]Simank HG,Brocai DR,Brill C,et al.Comparison of results of core decompression and intertrochanteric osteotomy for nontraumaticosteonecrosis of the femoral head using Cox regression and survivorship analysis.J Arthroplasty,2001,16(6):790-794.
