原发性骨质疏松症的治疗与预防
2015-09-13陶天遵邱贵兴朱汉民李梅林守清林华赵宇胡侦明荣杰生秦岭夏维波徐苓翁习生陶树清黄公怡章振林0蒋青廖二元
陶天遵 邱贵兴 朱汉民 李梅 林守清 林华 赵宇 胡侦明 荣杰生△ 秦岭夏维波 徐苓 翁习生 陶树清△ 黄公怡 章振林0△ 蒋青 廖二元△
(1.哈尔滨医科大学附属第二医院骨科,哈尔滨150086;2.中国医学科学院北京协和医学院北京协和医院骨科,北京100730;3.复旦大学附属华东医院骨质疏松科,上海200040;4.中国医学科学院北京协和医学院北京协和医院内分泌科,北京100730;5.中国医学科学院北京协和医学院北京协和医院生殖内分泌科,北京100730;6.南京鼓楼医院骨科,南京210008;7.重庆医科大学附属第一医院骨科,重庆400016;8.香港中文大学医学院骨科,香港;9.卫生部北京医院骨科,北京100730;10.上海市第六人民医院骨质疏松科,上海200235;11.中南大学湘雅二医院内分泌科,长沙410011)
骨质疏松症是一种可预防性疾病,且骨质疏松症和骨质疏松性骨折的预防比治疗更重要。骨质疏松症的初级预防是针对尚无骨质疏松但具有骨质疏松症危险因素者,防治的目的是防止或延缓其发展为骨质疏松症,并避免发生第一次骨折;骨质疏松症的二级预防是针对已有骨质疏松症,T≤-2.5或已发生过脆性骨折者,其预防和治疗的最终目的是避免发生骨折或再次骨折。
预防应始于婴幼儿,并贯穿一生。青少年、孕产妇、围绝经期和绝经期女性、老年人、骨质疏松人群是预防的重点人群。应把预防措施落实到基层,从健康教育做起。
1 基础措施
1.1 生活方式的改变
坚持健康的生活方式;多饮用牛奶,少饮用咖啡和碳酸饮料;多晒太阳,适当户外运动;富钙、低盐饮食;戒烟、限酒。
1.2 适量的体育锻炼
运动是预防骨质疏松最有效的方法之一。适量的运动能改善骨骼的血液循环,促进骨转换平衡,维护和提高骨密度,延缓骨量丢失。同时,运动还可提高肌肉的力量、增加活动的协调性,减少跌倒风险。运动有利于肠内钙的吸收和增加骨形成。运动要遵循循序渐进的原则,不宜过劳。老年人及骨质疏松人群应避免过度剧烈的运动,以避免发生骨折或引发其他疾病。可选用八段锦、五禽戏或太极拳等中国传统的运动方式[1,2]。
骨质疏松症患者在进行强度较大的体育锻炼(如举重、跑步)前应进行相应的风险评估,体育锻炼应该避免仰卧起坐、过度弯腰、扭身运动、爆发性负重或高
1.3 钙和维生素 DD的补充
1.3.1 钙剂
钙摄入可减缓骨量丢失,改善骨矿化。骨折围手术期以及骨折后的长期治疗策略中,钙剂的应用都是必需的。
绝经后妇女和老年人每日元素钙的摄入量应为1000~1200 mg,国人每日饮食中元素钙摄入量约为400 mg,故每日额外补充的元素钙量应为500~600 mg[3-6]。骨折围手术期摄入的钙量可略增加。老年人容易合并维生素D缺乏或不足,补充钙剂的同时应给予普通维生素D,先纠正维生素D缺乏状态或使患者的血清25(OH)D达正常水平。
心血管事件及肾结石风险是对钙剂安全性的主要顾虑,有研究提出大剂量的钙摄入可能增加肾结石、心血管疾病及卒中的风险。大样本量及多中心研究结果显示,额外补充钙剂会增大动脉粥样斑块的面积与体积[7-10]。但目前循证医学的证据尚不足以证明补充钙剂会增加心血管事件和肾结石风险。相反,相关研究表明补充钙剂具有改善血脂和降压的作用,有利于降低心血管疾病的风险;较高剂量的钙摄入还能降低肾结石风险[11-15]。
高钙血症时应避免使用钙剂。钙剂应与维生素D和其他抗骨质疏松药物联合使用。
1.3.2 维生素D
老年人和骨质疏松人群是维生素D缺乏的高危人群,尤其是髋部骨折患者。对于50岁以上的较高风险人群,维生素D的推荐剂量为800~1000 IU/d;对于一些高危患者如髋部骨折患者,可补充1000~2000 IU/d剂量的维生素D,至少将血清25(OH)D水平提高到20 ng/ml或以上。对于一般老年人群,维生素D安全冲撞的动作(如跳跃)等。骨折术后患者应在医师指导下,根据个体情况进行循序渐进的活动和锻炼。运动方式、时间、频度、强度应个体化。补充剂量上限为4000 IU/d。
治疗严重维生素D缺乏者可以使用50000 IU维生素D3或者D2,每周1次(或7000 IU日剂量),持续8~12周,使25(OH)D水平达到30 ng/ml左右。然后转为维持治疗剂量,但在治疗过程中要严密监测血钙磷、24 h尿钙磷以及血清25(OH)D水平。
骨化三醇或阿法骨化醇主要用于老年人或肾功能异常者,使用时需定期监测血钙与尿钙。
维生素D可应用于骨折围手术期及骨折后的长期治疗。应与钙剂及其他抗骨质疏松药物联合使用。
1.4 蛋白质的补充
蛋白质是骨骼和肌肉的重要营养成分,蛋白摄入不足影响骨量的维持。此外,充分的蛋白摄入还可以增加肌肉量。低蛋白摄入的老年人更容易发生肌力下降和肌少症(sarcopenia,与衰弱、多种慢性病及年龄相关的肌肉容量和功能下降的一种肌肉疾病)。蛋白的来源主要有奶制品、豆类、鱼类和肉类。推荐成人每日的蛋白摄入量为0.8 g/kg,而每日摄入蛋白1.0~1.2 g/kg可能对老年人的骨骼和肌肉健康更为有利7年,欧洲骨质疏松和骨关节炎临床经济学会(ESCEO)发布的维持骨骼健康的膳食蛋白和维生素D专家共识推荐:每日摄入膳食蛋白1.0~1.2 g/kg,且每次正餐保证20~25 g高质量蛋白(奶制品)的摄入[16]。
老年髋部骨折患者常伴有营养素和蛋白质缺乏。低蛋白摄入可导致髋部骨折风险升高。临床研究显示,蛋白补充可以降低髋部骨折患者的死亡率和住院时间,有利于恢复独立生活。因此,老年人在补充维生素D和钙的同时,增加蛋白质的补充可有更多获益。
2 抗骨质疏松药物治疗
2.1 抗骨质疏松药物
目前在中国上市的治疗骨质疏松的药物见表1。
2.1.1 双膦酸盐类药物
双膦酸盐是治疗骨质疏松症最常用的药物。双膦酸盐可以选择性地吸附在骨矿物质表面,然后被破骨细胞摄取,抑制破骨细胞功能、促进破骨细胞凋亡,降低骨转换率,抑制骨吸收,减少骨量丢失,增加骨量。不含氮的双膦酸盐(如氯屈膦酸盐、依替膦酸盐)抑制破骨细胞依赖性ATP酶;而含氮的双膦酸盐(如帕米膦酸盐、阿仑膦酸盐、利塞膦酸盐、伊班膦酸盐、唑来膦酸盐)抑制破骨细胞甲羟戊酸通路中的一个关键酶——法尼基焦磷酸合成酶,从而干扰破骨细胞活动中一些关键分子的合成,最终使破骨细胞失去活性。
2.1.1.1 阿仑膦酸钠:在骨骼中的半衰期长达10年,疗程不宜超过3~5年,药物休假期为2~3年。目前在国内应用的阿仑膦酸钠剂型主要有:10 mg/d阿仑膦酸钠,每周70 mg阿仑膦酸钠的片剂以及70 mg阿仑膦酸钠加上2800 IU或5600 IU的维生素D3每周1次的复合制剂。阿仑膦酸钠治疗3年后可使骨质疏松症患者(既往有椎体骨折史或股骨颈骨密度T值≤-2.5)椎体骨折发生率降低48%,非椎体骨折风险降低20%,不良事件的发生与安慰剂组相比无统计学差异。使用注意事项:阿仑膦酸钠可能对上消化道黏膜产生局部刺激,所以应在空腹时服药,需用200~300 ml白开水送服,服药后30 min内不要平卧,应保持直立体位(站立或坐立)。另外,在此期间也应该避免进食牛奶、果汁等饮料及任何食品和药品[6,17-22]。
2.1.1.2 利塞膦酸钠:目前在中国上市的剂型包括口服片剂5 mg每日1次和口服片剂35 mg每周1次两种。利塞膦酸钠抗骨折干预疗效的临床研究长达7年。研究显示经利塞膦酸钠治疗3年后,骨质疏松患者(既往有椎体骨折史)椎体骨折风险下降41%~49%,非椎体骨折风险下降36%,不良事件的发生与安慰剂组相比无统计学差异。使用注意事项同阿仑膦酸钠。
2.1.1.3 唑来膦酸注射液:唑来膦酸用药期限一般为3~5年,药物休假期为2~3年。用于防治骨质疏松症的唑来膦酸剂型为静脉注射剂5 mg,每年注射1次。唑来膦酸抗骨折干预疗效的临床研究长达9年,研究显示经唑来膦酸治疗3年后,骨质疏松患者(既往有椎体骨折史或股骨颈骨密度T值≤-2.5)的椎体骨折风险下降70%,非椎体骨折风险下降25%,髋部骨折风险下降41%。临床研究显示以下不良反应发生率高于对照组,具有显著统计学差异:血肌酐升高、房颤、发热、肌痛、流感样症状、头痛、关节痛。使用注意事项:缓慢静脉滴注时间应不短于15 min,给药前后需充分水化,对于肾功能受损的患者,静脉滴注时间需延长,但禁用于肌酐清除率小于35 ml/min的患者。约三分之一的患者首次给药后会出现急性期反应(关节痛,头痛,肌肉疼痛,发热)。有研究提示:首次输注前予以非甾体类消炎镇痛药物处理可减少急性期反应的发生,但并不推荐作为常规预防性使用[6,17,18,23-27]。
2.1.1.4 双膦酸盐药物安全性:少数患者口服双膦酸盐可能发生轻度胃肠道反应,包括轻度上腹疼痛、反酸等症状。有活动性胃及十二指肠溃疡、返流性食管炎者应慎用。
所有双膦酸盐都主要经肾脏排泄,因此禁用于肌酐清除率低于35 ml/min的患者。使用前需评估肾脏功能以排除高风险的患者。静脉输注时间不短于15 min[6,17,18]。

表1 抗骨质疏松药物
颌骨坏死(osteonecrosis of the jaw,ONJ):颌骨坏死的发生与使用的双膦酸盐剂量和频率相关。国外报道在肿瘤患者中用药剂量大,间隔时间短,颌骨坏死的发生率高(1%~15%)。在骨质疏松患者中,国外报道的ONJ发生率在0.001%~0.01%,仅略高于普通人群。
非典型性股骨骨折(atypical femur fractures,AFFs):在接受双膦酸盐治疗的少数患者中,曾经报告了股骨转子下及股骨干近端低能量非典型骨折。
长期使用双膦酸盐的患者中,非典型性股骨骨折风险增加,多发生于连续用药3年以上的患者;停用双膦酸盐以后,风险随之下降。具有类似临床特征的应力性骨折也发生于未接受双膦酸盐治疗的患者中。
在发生骨折之前,可有单侧或双侧的大腿或腹股沟部位的疼痛。怀疑有非典型股骨骨折时,应进行双侧股骨X线片检查。如无阳性发现,但又高度怀疑时,可进一步采用MRI或核素骨扫描检查,并停用双膦酸盐。手术固定、自体骨移植等外科治疗的同时,使用PTH1-34制剂治疗可能有益。
2.1.2 降钙素
降钙素能够抑制破骨细胞的生物活性和减少破骨细胞的数量,从而减少骨量丢失并增加骨量[6,17,18,28,29]。
剂型及用法:临床上有鲑鱼和鳗鱼两种降钙素。鲑鱼降钙素有鼻喷和注射两种剂型,鼻喷剂型为200 IU/d,注射剂型为每次50 IU,皮下或肌内注射,根据病情,每周2~7次;鳗鱼降钙素为注射剂型,每周20 U,肌内注射。
不良反应:鼻喷剂主要不良反应包括鼻炎、鼻黏膜刺激、鼻出血及过敏反应。注射剂主要不良反应包括恶心、呕吐、面部潮红、发热、眩晕等。
欧洲人用药物委员会(CHMP)指出:以下三种情况降钙素仅可使用注射剂型,并且应该以最短时间及最小有效剂量应用:①Paget病,仅用于对于其他可选择的治疗无反应或不合适其他治疗的患者;②急性制动导致的急性骨丢失,推荐疗程为2周,最长不超过4周;③肿瘤引起的高钙血症[30]。
2013年中国专家讨论认为:①鲑鱼降钙素能有效抑制急性骨丢失(骨质疏松性骨折引起的制动),快速缓解骨痛,在骨质疏松领域仍有其优势地位;②建议短期(不超过3个月)应用,必要时可采用间歇性重复给药;③CHMP报告关于鼻喷剂长期应用于骨质疏松的获益与风险方面的意见值得参考与重视;④有必要在中国人群中开展安全性调查研究;⑤在处理Paget病和肿瘤引起的高钙血症中,短期应用鲑鱼降钙素的获益大于风险;⑥欧美主要学术社团发布的新版骨质疏松症诊疗指南(2010至2013年)对鲑鱼降钙素治疗骨质疏松症的意见值得参考,不适合其他抗骨质疏松药物的患者仍可选用鲑鱼降钙素[31]。
2.1.3 雌激素类
雌激素类药物只能用于女性患者,其能抑制骨转换、减少骨丢失。临床研究已充分证明雌激素或雌孕激素补充疗法(estrogen/hormone therapy,ET/HT)能降低发生骨质疏松性骨折的风险,是防治绝经后骨质疏松的有效措施。妇女健康促进计划(WHI)研究发现,5年的雌激素补充治疗可降低临床椎体骨折34%以及其他非椎体骨折23%[32]。
ET/HT有很多种口服制剂,包括单独的雌激素、单独的孕激素以及雌孕激素复合制剂。ET/HT的使用有周期性、序贯性和连续性几种方法。如果治疗一旦停止,骨量可能会再丢失,因此需要使用其他抗骨质疏松药物来维持骨密度(bone mineral density,BMD)。
最新的研究以及2013年发表的绝经激素治疗全球共识[33]指出:激素治疗的安全性取决于开始启用这种治疗的年龄,小于60岁或在绝经后10年内使用,则心血管疾病风险不增加,甚至还有一定的保护作用。基于对激素补充治疗利与弊的全面评估,建议激素补充治疗适于有绝经期症状(潮热、出汗等)及(或)骨质疏松症,及(或)存在骨质疏松危险因素的妇女,尤其提倡绝经早期开始应用,收益更大,风险更小。
激素治疗的方案、剂量、制剂选择及治疗期限等应根据患者情况个体化并应用最低有效剂量,用药时间不宜超过4年。坚持定期随访和安全性监测(尤其是乳腺和子宫)[6,17,18]。
2.1.4 选择性雌激素受体调节剂类(SERMs)
SERMs的作用机制是选择性地作用于雌激素的靶器官,在不同组织引起雌激素受体空间构象发生不同改变,从而发挥不同作用,它不是激素类药物。代表药物有雷诺昔芬。鉴于雷诺昔芬没有明确的降低非椎体骨折的风险证据,推荐用于髋部骨折风险不高的较年轻绝经后骨质疏松症妇女的治疗。随着患者年龄的增加,当患者髋部骨折风险增高时,应该换用更有效的药物[6,17,18]。
用药推荐:60mg/d,口服。
2.1.5 甲状旁腺激素类似物rhPTH(1-34)
甲状旁腺激素(PTH)是钙磷调节的主要激素,PTH增加血液中的钙浓度,动员骨钙入血。因此,长期PTH升高,将消耗骨储存;而间断PTH刺激将激活成骨细胞,促进骨形成,增加骨量。rhPTH1-34对高转换型与低转换型骨质疏松患者,都有促进骨形成的作用。
多次脆性骨折的高龄患者,骨质疏松症伴至少一次骨折的重度骨疏松患者,对双膦酸盐不耐受,或已使用了双膦酸盐,而骨密度不提升,并持续下降,或仍旧发生骨折者,如无禁忌可考虑使用rhPTH1-34。
rhPTH1-34特立帕肽用于有骨折高发风险的绝经后妇女骨质疏松症的治疗,平均18个月,可显著降低绝经后妇女椎体骨折风险65%以及非椎体骨折风险53%。但对降低髋骨骨折风险的效果尚未证实。
术后应用特立帕肽可促进骨痂形成,增加骨痂组织的体积、矿化及细胞数量,增加生物力学强度(包括扭力和压力)[34-36]。
注意事项/安全性:特立帕肽的副作用包括肌肉痛性痉挛、恶心、眩晕等。由于可增加大鼠骨肉瘤的发生率(对啮齿类动物长时间、大剂量使用),故特立帕肽不能用于基线骨肉瘤高风险(例如:佩吉特病、未明原因的碱性磷酸酶升高、骨骺未闭、骨骼接受过放射治疗)、骨转移瘤、高钙血症、或有骨骼系统恶性肿瘤病史的患者。
推荐治疗时间18~24个月。不应超过此时间。一旦停止用药,就会加快骨丢失。因此,停药后,建议使用抗骨吸收药物(双膦酸盐)来维持或进一步增加骨密度。
禁止用于严重肾功能不全患者,慎用于中度肾功能不全患者。肝功能不全患者,应在医生指导下慎用。
使用方法:20 μg/d,皮下注射。
2.1.6 活性维生素D
活性维生素D是维生素D的羟化代谢物,包括1,25(OH)2D3(骨化三醇)和1α(OH)D3(α-骨化醇)。可增加肠道钙吸收和尿钙重吸收。1,25(OH)2D3不需经肝、肾羟化就具有生物活性效应,而1α(OH)D3需经25羟化酶羟化为1,25(OH)2D3才具有生物活性效应。活性维生素D具有多重作用机制,作用于多靶点组织器官,发挥多种生理效应,能促进肠钙吸收,促进肾小管对钙的重吸收,降低血中PTH水平,增强成骨细胞活性,促进骨的矿化,改善肌力,增加神经-肌肉反射的协调性,降低跌倒风险和骨折发生率。
骨痂局部的1,25(OH)2D3可能有利于骨痂生成,改造与矿化,可能对骨折愈合有益。
活性维生素D及其类似物更适合老年人或肾功能不全及1α羟化酶活性降低的患者[6,17,18,37-40]。
剂量:骨化三醇口服,0.25~0.5 μg/d。α-骨化醇口服,0.25~1.0 μg/d。
安全性:治疗骨质疏松症时应用推荐剂量的活性维生素D总体是安全的。长期应用应定期监测血钙和尿钙水平,在治疗骨质疏松症时可与其他抗骨质疏松药物联合使用。
2.1.7 维生素K2
维生素K2是γ-谷氨酸羧化酶的辅酶,同时又是类固醇及异质物受体(RXR/SXR)的配体,上调细胞外基质相关基因的转录,增加Ⅰ型胶原的聚集和酶性交联,促进骨基质的形成,增加骨组织中骨钙素含量,改善骨质量。动物试验和临床试验显示维生素K2可以促进骨形成,并有一定的抑制骨吸收作用。维生素K2可提高骨密度,改善骨质量,提高骨强度,降低椎体和非脊椎骨折风险,并可缓解疼痛。维生素K2与双膦酸盐等药物联合使用时,疗效增加。血清羧化不全骨钙素(ucOC)水平是反映维生素K营养水平的灵敏标志物,可用于监测维生素K2的临床疗效[41-47]。
2.2 药物干预的疗效监测和用药期限
药物干预的疗效监测包括严密的随访、定期风险再评估及相关的临床检查。随访内容应包括治疗依从性、营养补充、生活方式调整及跌倒预防措施等。推荐每年评估风险因子(新发骨折、跌倒、慢性疾病、BMD、生化指标)和治疗方案,确定是否需要继续治疗。椎体压缩骨折患者再发椎体骨折的风险升高,开始治疗后应该严密随访和评估,要警惕复发或新发的腰背痛、身高降低或驼背。应定期脊柱X线摄影,每年检测BMD(中轴骨DXA/QCT)。外周双能X线骨密度测量(PDXA)和定量骨超声(QUS)检测法不能反映脊柱及髋部骨质对药物治疗的反应,不适于监测药物疗效。抑制骨吸收治疗3~6个月或者促骨形成治疗1~3个月后检测骨转换生化指标。
由于影响骨转换生化标志物测量结果的并非单一因素,不同测量方法结果也有差异,故应尽可能采用相同的采血时间和相同的测量方法,并结合骨密度测量结果做综合分折评价。骨转换生化标志物包括骨吸收标志物与骨形成标志物(表2)。
国际骨质疏松基金会(IOF)推荐首选Ⅰ型原胶原N端前肽(PⅠNP)和血清Ⅰ型胶原交联C-未端肽(β-CTX)这两个骨转换生化标志物[6,17,18]。
英国骨质疏松工作组(NOGG)对双膦酸盐长期治疗的监测流程如图1[50],可供其他药物疗效监测参考。
关于用药期限即疗程,由年龄、治疗反应、停药后疗效的维持、安全性等因素共同决定。非双膦酸
推荐剂量:四烯甲萘醌45 mg/d,分3次饭后口服。
2.1.8 中药
补肾中药方剂中含淫羊藿、续断、补骨脂等中药成分,其中淫羊藿是主要成分。研究证明淫羊藿含植物雌激素家族的异黄酮类生物活性成分,淫羊藿黄酮类化合物能抑制破骨细胞功能,促进成骨细胞增殖,抑制骨吸收,减少骨丢失。目前已有40余种含淫羊藿的中药复方制剂用于治疗绝经后骨质疏松症,有减轻疼痛,改善症状的效果。对提高骨量及促进骨折愈合的影响也有报告,但尚缺乏系统的符合国际规范和循证医学标准的基础和临床研究。我国学者与国际学者合作提出的《骨质疏松症药效研究方法与技术》,《中药防治骨质疏松症及其骨折的临床前和临床评价指导原则》为防治骨质疏松中药新药研发的国际化提供了可供借鉴的原则、标准、技术与方法。目前已有按美国FDA标准进行认证,并得到FDA认可的中药产品[48,49]。盐药物的疗效会随停药而消退,而双膦酸盐在停药后其抗骨折疗效仍然会维持数年。推荐双膦酸盐治疗3~5年(唑来膦酸3年)后重新评估,评估内容包括:临床因素(年龄,身高,新发骨折,其他新的风险因子),BMD,X线脊柱摄影椎体形态(身高缩减情况)等。重新评估并不意味着需要终止治疗,治疗是否延续(使用同一药物或其他药物)取决于初始风险和重新评估的结果。符合以下全部评估条件的患者,可以考虑暂停治疗:无新发骨折,无新增的风险因子,BMD没有显著下降,有严重脆性骨折史的患者还需要股骨颈骨密度T值>-2.5;停止治疗1~2年,再评估,依评估结果判断是否重新开始治疗。
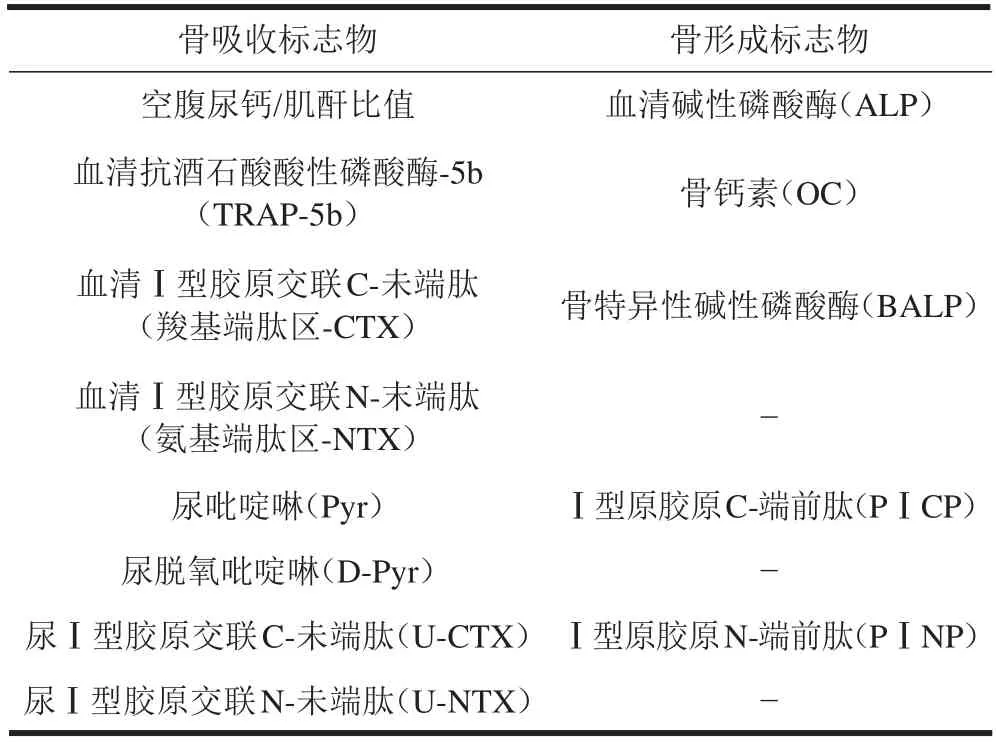
表2 骨转换生化标志物
2.3 药物干预的适应证
具备以下情况之一者,需考虑药物治疗:①确诊骨质疏松症患者(骨密度:T值≤-2.5),无论是否有过骨折;②骨量低下患者(骨密度:-2.5<T值≤-1.0)并存在一项以上骨质疏松危险因素,无论是否有过骨折;③无骨密度测定条件时,具备以下情况之一者,也需考虑药物治疗:已发生过脆性骨折;OSTA筛查为“高风险”;FRAX工具计算出髋部骨折概率≥3%或任何重要的骨质疏松性骨折概率≥20%(暂借用国外的治疗阈值,目前还没有中国人的治疗阈值)。
2.4 抗骨质疏松药物的用药原则
①应结合患者个体情况以及该药物临床疗效和安全性的证据水平选择药物;②对多数患者而言,一线或优选药物有双膦酸盐(如口服阿仑膦酸盐、利塞膦酸盐,或静脉给药唑来膦酸等),也可选择选择性雌激素受体调节剂(雷洛昔芬);③对骨量低下年龄较轻的绝经后妇女,如绝经症状(血管舒缩症状)不明显,可选用选择性雌激素受体调节剂(雷洛昔芬);

图1 双膦酸盐长期治疗检测流程[50]
有明显绝经期血管舒缩症状的妇女可选用雌/孕激素,但不推荐对60岁以上的绝经后妇女开始启用雌激素治疗;④不能接受一线药物者可酌情选用二线或次选药物:如降钙素、维生素K2(四烯甲萘醌)等;⑤降钙素对缓解围骨折期骨量流失、骨痛以及改善生活质量有一定优势,提倡短期应用,原则上一个疗程不超过3个月;⑥对严重的骨质疏松症或一线药物疗效不好者可选择甲状旁腺激素制剂(特立帕肽);⑦对于低转换型骨质疏松者,慎选使用骨吸收抑制剂。
2.5.5 联合治疗
联合使用抗骨质疏松治疗药物时,不仅应评价药物潜在的不良反应和治疗获益,还应充分考虑药物经济学的影响。联合用药方案有两种形式:序贯联合、同时联合。根据药物作用机制和各种药物特点,对联合用药暂提出以下建议:
2.5.1 序贯联合方案
尚无明确的证据指出各种抗骨质疏松药物序贯应用的禁忌。可根据个体情况酌情选择。
有研究表明序贯应用促骨形成药物和抗骨吸收药物,能较好维持疗效,临床上是可行的。
2.5.2 同时联合方案
钙剂、维生素D是骨质疏松症的基础治疗药物,可与促骨形成药物和抗骨吸收药物联合使用。
有研究显示,同时应用双膦酸盐及rhPTH1-34会产生相互影响,如唑来膦酸联合rhPTH1-34以及阿仑膦酸钠联合rhPTH1-34的作用不叠加。
通常不建议相同作用机制的药物同时用于治疗骨质疏松症。
3 跌倒的预防
1987年Kellogg国际老年人跌倒预防工作组将跌倒定义为:无意图地摔倒在地上或一些更低的平面上,但不包括暴力、意识丧失、偏瘫或癫痫发作所致的跌倒。跌倒已成为美国社会导致老年人死亡的第6位原因[51]。
跌倒是髋部和桡骨远端脆性骨折的主要危险因素,90%的髋部骨折继发于跌倒。预防跌倒可降低85%以上的脆性骨折风险,是降低脆性骨折的重要措施。跌倒的主要风险因子见表3[50,52]。
跌倒的预防要致力于改善起居环境,矫正心理、生理与病理因素,主要从改善肌力,步态及平衡训练三方面入手,具体措施应包括:①补充维生素D并保持充足的维生素D水平;②适当的体力活动;③个体跌倒风险评估;④太极拳和其他锻炼项目;⑤家庭环境安全评估和改善:改善光照、地面防滑、减少障碍物、增加扶手等;⑥矫正视力和治疗神经系统疾病;⑦髋部保护支架的使用;⑧平衡训练。

表3 跌倒的主要风险因子
4 次级骨折预防医疗模式--骨折联络服务
骨质疏松的评估应由骨科医师在骨折处理后及早进行,需要告知患者骨折后再次骨折的风险升高,且可以通过治疗来预防和减少二次骨折的发生。高质量的骨折医疗需要系统的、充分协调的多学科团队的合作。多方合作应包括骨科医师、内科医师、跌倒服务医师以及社区医师。
2011年,国际骨质疏松基金会(IOF)骨折工作小组发表了有关采用协调员系统的立场文件,该系统用于预防脆性骨折患者的继发性骨折。采用协调员的骨折后医疗模式(Fracture Liaison Service,FLS)已成功缩小了全球众多国家的继发性骨折预防医疗差距。
[1]秦岭,陈启明.太极拳的社区推广与肌骨健康维护//秦岭.骨内科学.北京:人民卫生出版社,2013:768-778.
[2]梁仲君,莫海桦,张颖恺,等.社区服务和脆性骨折综合预防与康复-香港模式//秦岭.骨内科学.北京:人民卫生出版社,2013:728-760.
[3]Khan A,Dubois S,Khan AA,et al.A randomized,doubleblind,placebo-controlled study to evaluate the effects of alendronate on bone mineral density and bone remodelling in perimenopausal women with low bone mineral density.J Obstet Gynaecol Can,2014,36(11):976-982.
[4]Roberts KC,Brox WT,Jevsevar DS,et al.Management of hip fractures in the elderly.J Am Acad Orthop Surg,2015,23(2):131-137.
[5]Clinician's Guide to Prevention and Treatment of Osteoporosis.Cosman F,de Beur SJ,LeBoff MS,et al.Osteoporos Int,2014,25(10):2359-2381.
[6]中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南(2011年).中华骨质疏松和骨矿盐疾病杂志,2011,4:2-17.
[7]Bolland MJ,Barber PA,Doughty RN,et al.Vascular events in healthy older women receiving calcium supplementation:randomisedcontrolledtrial.BMJ,2008,336(7638):262-266.
[8]Li K,Kaaks R,Linseisen J,et al.Associations of dietary calcium intake and calcium supplementation with myocardial infarction and stroke risk and overall cardiovascular mortality in the Heidelberg cohort of the European Prospective Investigation into Cancer and Nutrition study.Heart,2012,98(12):920-925.
[9]Bolland MJ,Avenell A,Baron JA,et al.Effect of calcium supplements on risk of myocardial infarction and cardiovascular events:meta-analysis.BMJ,2010,341:c3691.
[10]Michaëlsson K,Melhus H,Warensjö Lemming E,et al.Long term calcium intake and rates of all cause and cardiovascular mortality:community based prospective longitudinal cohort study.BMJ,2013,346:f228.
[11]Bischoff-Ferrari HA,Kiel DP,Dawson-Hughes B,et al.Dietary calcium and serum 25-hydroxyvitamin D status in relation to BMD among U.S.adults.J Bone Miner Res,2009,24(5):935-942.
[12]Reid IR.Cardiovascular effects of calcium supplements.Nutrients,2013,5(7):2522-2529.
[13]Bostick RM,Kushi LH,Wu Y,et al.Relation of calcium,vitamin D,and dairy food intake to ischemic heart disease mortality among postmenopausal women.Am J Epidemiol,1999,149(2):151-161.
[14]Iso H,Stampfer MJ,Manson JE,et al.Prospective study of calcium,potassium,and magnesium intake and risk of stroke in women.Stroke,1999,30(9):1772-1779.
[15]Lewis JR,Calver J,Zhu K,et al.Calcium supplementation and the risks of atherosclerotic vascular disease in older women:results of a 5-year RCT and a 4.5-year follow up.J Bone Min Res,2011,26(1):35-41.
[16]Rizzoli R,Stevenson JC,Bauer JM,et al.The role of dietary protein and vitamin D in maintaining musculoskeletal health in postmenopausal women:a consensus statement from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis(ESCEO).Maturitas,2014,79(1):122-132.
[17]中华医学会骨科分会.骨质疏松骨折治疗指南.中华骨科杂志,2008,28(10):875-878.
[18]中国健康促进基金会骨质疏松防治中国白皮书编委会.骨质疏松中国白皮书.中华健康管理学杂志,2009,3(3):148-154.
[19]BlackDM,SchwartzAV,EnsrudKE,etal.Effectsofcontinuing or stopping alendronate after 5 years of treatment:the Fracture Intervention Trial Long-term Extension(FLEX):a randomizedtrial.JAMA,2006,296(24):2927-2938.
[20]Bone HG,Hosking D,Devogelaer JP,et al.Ten years'experience with alendronate for osteoporosis in postmenopausal women.N Engl J Med,2004,350(12):1189-1199.
[21]Zhang ZL,Liao EY,Xia WB,et al.Alendronate sodium/vitamin D3 combination tablet versus calcitriol for osteoporosis in Chinese postmenopausal women:a 6-month,randomized,open-label,active-comparator-controlled study with a 6-month extension.Osteoporos Int,2015,26(9):2365-2374.
[22]Black DM,Thompson DE,Bauer DC,et al.Fracture risk reduction with alendronate in women with osteoporosis:the Fracture Intervention Trial.FIT Research Group.J Clin Endocrinol Metab,2000,85(11):4118-4124.
[23]Black DM,Delmas PD,Eastell R,et al.Once-yearly zole-dronic acid for treatment of postmenopausal osteoporosis.N Engl J Med,2007,356(18):1809-1822.
[24]Black DM,Reid IR,Boonen S,et al.The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis:a randomized extension to the HORIZON-Pivotal Fracture Trial(PFT).J Bone Miner Res,2012,27(2):243-254.
[25]DM Black,IR Reid et al.The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis:a randomized second extension to the HORIZON-Pivotal Fracture Trial(PFT).J Bone Miner Res,2015,30(5):934-944.
[26]Lyles KW,Colón-Emeric CS,Magaziner JS,et al.Zoledronic acid and clinical fractures and mortality after hip fracture.N Engl J Med,2007,357(18):1799-1809.
[27]Colón-Emeric C,Nordsletten L,Olson S,et al.Association between timing of zoledronic acid infusion and hip fracture healing.Osteoporos Int,2011,22(8):2329-2336.
[28]Lyritis GP,Paspati I,Karachalios T,et al.Pain relief from nasal salmon calcitonin in osteoporotic vertebral crush fractures.A double blind,placebo-controlled clinical study.Acta Orthop Scand Suppl,1997,275:112-114.
[29]Tsakalakos N,Magiasis B,Tsekoura M,et al.The effect of short-term calcitonin administration on biochemical bone markers in patients with acute immobilization following hip fracture.Osteoporos Int,1993,3(6):337-340.
[30]Miller PD.Anti-resorptives in the management of osteoporosis.Best Pract Res Clin Endocrinol Metab,2008,22(5):849-868.
[31]朱汉民,廖二元.鲑鱼降钙素专家讨论会纪实.中华骨质疏松和骨矿盐疾病杂志,2013,12(6):370-372.
[32]Rossouw JE,Anderson GL,Prentice RL,et al.Risks and benefits of estrogen plus progestin in healthy postmenopausal women:principal results From the Women's Health Initiative randomized controlled trial.JAMA,2002,288(3):321-333.
[33]Wunder D,Pache TD.[The global consensus statement 2013 on menopausal hormone therapy].Rev Med Suisse,2013,9(403):1950,1952-1953.
[34]Neer RM,Arnaud CD,Zanchetta JR,et al.Effect of parathyroid hormone(1-34)on fractures and bone mineral density in postmenopausal women with osteoporosis.N Engl J Med,2001,344(19):1434-1441.
[35]Fahrleitner-Pammer A,Langdahl BL,Marin F,et al.Fracture rate and back pain during and after discontinuation of teriparatide:36-month data from the European Forsteo Observational Study(EFOS).Osteoporos Int,2011,22(10):2709-2719.
[36]Chen JF,Yang KH,Zhang ZL,et al.A systematic review on the use of daily subcutaneous administration of teriparatide for treatment of patients with osteoporosis at high risk for fracture inAsia.Osteoporos Int,2015,26(1):11-28.
[37]Larsen ER,Mosekilde L,Foldspang A.Vitamin D and calcium supplementation prevents osteoporotic fractures in elderly community dwelling residents:a pragmatic population-based 3-year intervention study.J Bone Miner Res,2004,19(3):370-378.
[38]Moyer VA.Vitamin D and calcium supplementation to prevent fractures in adults:U.S.Preventive Services Task Force recommendation statement.Ann Intern Med,2013,158(9):691-696.
[39]Avenell A,Mak JC,O'Connell D.Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men.Cochrane Database Syst Rev,2014,4:D227.
[40]Papadimitropoulos E,Wells G,Shea B,et al.Meta-analyses of therapies for postmenopausal osteoporosis.VIII:Metaanalysis of the efficacy of vitamin D treatment in preventing osteoporosis in postmenopausal women.Endocr Rev,2002,23(4):560-569.
[41]Iwamoto J,Seki A,Sato Y,et al.Vitamin K2 promotes bone healinginaratfemoralosteotomymodelwithorwithoutglucocorticoidtreatment.CalcifTissueInt,2010,86(3):234-241.
[42]Cockayne S,Adamson J,Lanham-New S,et al.Vitamin K and the prevention of fractures:systematic review and metaanalysis of randomized controlled trials.Arch Intern Med,2006,166(12):1256-1261.
[43]Huang ZB,Wan SL,Lu YJ,et al.Does vitamin K2 play a role in the prevention and treatment of osteoporosis for postmenopausal women:a meta-analysis of randomized controlled trials.Osteoporos Int,2015,26(3):1175-1186.
[44]Tabb MM,Sun A,Zhou C,et al.Vitamin K2 regulation of bone homeostasis is mediated by the steroid and xenobiotic receptor SXR.J Biol Chem,2003,278(45):43919-43927.
[45]Ichikawa T,Horie-Inoue K,Ikeda K,et al.Steroid and xenobiotic receptor SXR mediates vitamin K2-activated transcription of extracellular matrix-related genes and collagen accumulation in osteoblastic cells.J Biol Chem,2006,281(25):16927-16934.
[46]Shiraki M,Shiraki Y,Aoki C,et al.Vitamin K2(menatetrenone)effectively prevents fractures and sustains lumbar bone mineral density in osteoporosis.J Bone Miner Res,2000,15(3):515-521.
[47]Knapen MH,Schurgers LJ,Vermeer C.Vitamin K2 supplementation improves hip bone geometry and bone strength indices in postmenopausal women.Osteoporos Int,2007,18(7):963-972.
[48]QinL,ZhangG,HungWY,et al.Phytoestrogen-richherb formula“XLGB”prevents OVX-induced deterioration of musculoskeletaltissuesatthehipinoldrats.JBoneMinerMetab,2005,23Suppl:55-61.
[49]韩娜,王天兵,姜保国,等.人工虎骨粉干预大鼠成骨细胞增殖和Ⅰ型胶原的表达.中国组织工程研究,2012,16(2):201-205.
[50]Compston J,Bowring C,CooperA,et al.Diagnosis and managementofosteoporosisinpostmenopausalwomenandolder men in the UK:National Osteoporosis Guideline Group(NOGG)update2013.Maturitas,2013,75(4):392-396.
[51]The prevention of falls in later life.A report of the Kellogg International Work Group on the Prevention of Falls by the Elderly.Dan Med Bull,1987,34 Suppl 4:1-24.
[52]Todd C,Skelton D.What are the main risk factors for falls among older people and what are the most effective interventions to prevent these falls?Copenhagen,WHO Regional Office for Europe(2004-04-05).http://www.euro.who.int/document/E82552.pdf.
