内源性途径调控芬太尼与5-氟尿嘧啶联合诱导的MCF-7乳腺癌细胞凋亡
2015-09-12王志学张晓侠李汝泓刘新伟贾瑞林承德医学院附属医院麻醉科河北承德067000
王志学 张晓侠 雷 燕 李汝泓 刘新伟 贾瑞林 (承德医学院附属医院麻醉科,河北 承德 067000)
前期研究证实〔1~4〕,一定浓度的吗啡、5-氟尿嘧啶(5-FU)及联合应用48 h对MCF-7乳腺癌细胞有促进凋亡作用,并显著下调Bcl-2表达和上调Bax表达,两药联合应用启动内源性凋亡途径具有协同作用。同为强效阿片受体激动剂的芬太尼,曾主要应用于围术期镇痛镇静、创伤痛。由于其镇痛强度高,起效迅速,以及新的剂型和工艺的不断出现,近年来在癌痛治疗领域应用亦越来越广泛。有报道显示〔5~7〕,芬太尼也能剂量依赖性地诱导MCF-7人乳腺癌细胞凋亡、抑制增殖,并能使肿瘤细胞所致的组织破坏显著减少。然而,芬太尼与5-FU联合应用对乳腺癌细胞凋亡的影响是否也有吗啡类似的效应以及内源性凋亡途径的依赖性尚有待阐明。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 碘化丙啶(PI),美国Sigma公司;RPMI1640培养基,GIBCO BRL公司;胎牛血清,天津血液学研究所;胰蛋白酶,中国医学科学院血研所科技公司;鼠抗人Bcl-2及Bax Western印迹单克隆抗体,福州迈新生物技术有限公司;β-actin一抗、山羊抗鼠Western印迹二抗,美国Santa Cruz公司。YT-CJ-1N超净工作台,北京亚泰科隆实验科技开发中心;FACS Calibur流式细胞仪,美国B&D公司;CO2电热恒温培养箱,日本SANYO公司;LD5-IA低速离心机,北京雷勃尔离心机有限公司;QL-901振荡器,中国其林贝尔;荧光倒置显微镜,日本尼康;光学显微镜、倒置显微镜,日本OLYMPUS。
1.1.2 实验药物 芬太尼注射液,宜昌人福药业;5-FU注射液,上海旭东海普药业。
1.1.3 实验细胞 MCF-7人乳腺癌细胞,南京凯基生物科技发展有限公司。
1.2 方法
1.2.1 细胞培养 细胞复苏成功后,调整浓度为1×106/ml接种于培养瓶,静置于37℃、5%CO2、100%湿度的培养箱内,用RPMI1640完全培养液进行培养,隔日换液。待贴壁70% ~80%时,用0.25%胰蛋白酶消化传代。
1.2.2 实验分组 共分为八组:U组(未处理组)即对照组,LF组为0.1 μmol/L芬太尼处理组,MF组为1 μmol/L芬太尼处理组,HF组为10 μmol/L芬太尼处理组,FU 组为500 μmol/L 5-FU处理组,LF+FU 组为0.1 μmol/L芬太尼与500 μmol/L 5-FU联合处理组,MF+FU组为1 μmol/L芬太尼与500 μmol/L 5-FU联合处理组,HF+FU组为 10 μmol/L芬太尼与500 μmol/L 5-FU联合处理组。
1.2.3 流式细胞法(FCM)检测亚二倍体峰细胞凋亡情况 取对数生长期的细胞,调整细胞浓度约5×105/ml接种于25 ml细胞培养瓶,其贴壁后更换为含不同药物的培养液(见1.2.2)5 ml,每组5瓶,孵育48 h。届时吸弃上清,消化、磷酸盐缓冲液(PBS)洗涤,收集细胞(约106/ml以上)于离心管;每管加75%酒精 4 ml,-20℃固定 24 h;4℃低速离心(1500 r/min、5 min)彻底去除酒精,加入 PBS/柠檬酸盐缓冲液50 μl,室温放置30 min,间歇振荡混匀;低速离心,PBS洗涤,振荡,PI染色,室温避光放置30 min,流式细胞仪上机检测。
1.2.4 Western印迹检测Bcl-2、Bax表达 另取对数生长期细胞,以5×105/ml接种于25 ml培养瓶内,其贴壁后更换含不同药物的培养液(见1.2.2),每组5瓶,孵育48 h。充分裂解,4℃高速离心,取上清-80℃保存。二喹啉甲酸(BCA)法行蛋白质浓度测定;煮沸变性、冰浴;蛋白电泳,转膜,封闭。分别加入Bcl-2及 Bax一抗、β-actin一抗,4℃孵育过夜。洗膜,加入二抗,室温2 h。曝光、定影、扫描,软件分析目的条带的灰度值及相应β-actin条带的灰度值,以两者比值表示目的蛋白的相对表达量。
1.3 统计学分析 采用SPSS11.5软件行单因素方差分析与析因设计方差分析,两两比较用LSD-t检验。
2 结果
2.1 凋亡率变化情况 与未处理组相比,单独应用芬太尼处理时1 μmol/L及10 μmol/L组均引起凋亡率增加(P<0.01),单独应用500 μmol/L 5-FU后凋亡率亦明显增加(P<0.01);芬太尼与5-FU联合应用,各组较单独应用5-FU或该浓度芬太尼单独应用相比,凋亡率均明显增加,且均具有协同作用(P<0.01)。见表1。
2.2 Bcl-2、Bax表达情况 与未处理组相比,单独应用芬太尼处理1 μmol/L及10 μmol/L组Bcl-2条带明显减浅,相对灰度值减小,均引起Bcl-2表达减弱(P<0.01);500 μmol/L 5-FU单独应用后Bcl-2条带仍明显减浅,相对灰度值减小,引起Bcl-2表达减弱(P<0.01);芬太尼与5-FU联合应用,各组较单独应用5-FU或该浓度芬太尼单独应用相比,Bcl-2条带亦明显减浅,相对灰度值减小,且均具有协同作用(P<0.05,P<0.01)。未处理组Bax条带最浅,相对灰度值最小。与未处理组相比,单独应用芬太尼处理1 μmol/L及10 μmol/L组Bax条带明显加深,相对灰度值增大,均引起 Bax表达增强(P<0.05,P<0.01);500 μmol/L 5-FU单独应用后Bax条带仍明显加深,相对灰度值增加,Bax表达增强(P<0.01);芬太尼与5-FU联合应用,各组较单独应用5-FU或该浓度芬太尼单独应用相比,Bax条带亦明显加深,相对灰度值增加,且均具有协同作用(P<0.05,P<0.01)。见表1。
表1 处理48 h各组细胞凋亡率及Bcl-2、Bax蛋白表达情况(±s,n=5)
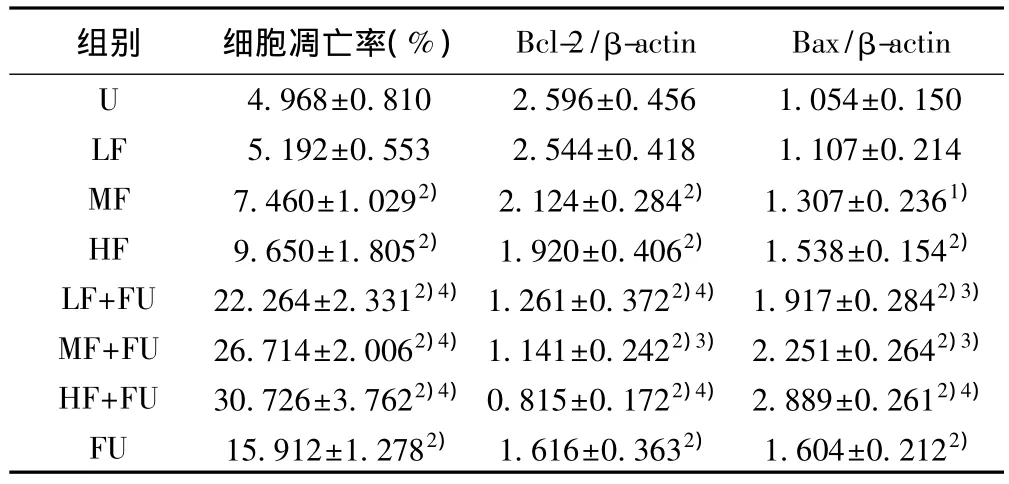
表1 处理48 h各组细胞凋亡率及Bcl-2、Bax蛋白表达情况(±s,n=5)
与U组比较:1)P<0.05,2)P<0.01;与相同浓度单用芬太尼组比较:3)P<0.05,4)P<0.01
组别 细胞凋亡率(%) Bcl-2/β-actin Bax/β-actin U 4.968±0.8102.596±0.4561.054±0.150 LF 5.192±0.5532.544±0.4181.107±0.214 MF 7.460±1.0292) 2.124±0.2842) 1.307±0.2361)HF 9.650±1.8052) 1.920±0.4062) 1.538±0.1542)LF+FU 22.264±2.3312)4)1.261±0.3722)4)1.917±0.2842)3)MF+FU 26.714±2.0062)4)1.141±0.2422)3)2.251±0.2642)3)HF+FU 30.726±3.7622)4)0.815±0.1722)4)2.889±0.2612)4)FU 15.912±1.2782) 1.616±0.3632) 1.604±0.2122)
3 讨论
有丝分裂与凋亡之间的平衡对维持体内细胞数量至关重要,肿瘤形成一方面便是基于凋亡的停滞或抑制因而残留了“未死”细胞群落〔8〕。一般认为,细胞凋亡的抑制比过度增殖在恶性肿瘤的发生发展过程中所起的作用更为重要〔9,10〕。很多抗肿瘤药物通过诱导凋亡使细胞凋亡/增殖比值提高来进行干预性调节,芬太尼对抗乳腺癌效应的可能机制之一即是诱导肿瘤细胞凋亡。本研究结果显示,一定浓度的芬太尼单独和5-FU单独应用能显著诱导MCF-7乳腺癌细胞凋亡,两药联合应用更显示出协同作用。
人类主要有两种凋亡途径,即外源性途径和内源性途径。外源性途径是由细胞膜表面的死亡受体触发,而内源性途径包括Bcl-2家族蛋白调节线粒体膜完整性方面的改变,以及对细胞损害或应激信号做出的潜在的反应。Bcl-2家族主宰着一个细胞继续存活还是通过线粒体途径凋亡〔11〕。Bcl-2过量表达有助于肿瘤进展,有助于对标准抗癌疗法所诱导凋亡的抵抗。
Bcl-2蛋白水平可被细胞内抗Bcl-2单链抗体抑制,这在MCF-7乳腺癌细胞及其他癌细胞中体现出药物诱发的细胞毒性增加。在本研究中,一定浓度的芬太尼单独和5-FU单独应用均可显著下调MCF-7乳腺癌细胞Bcl-2表达,两药联合应用更显示出协同作用。有研究也证实,凋亡的发生与否还有赖于Bcl-2/Bax这对抗凋亡/促凋亡蛋白之间的平衡〔12〕。Bcl-2可稳定线粒体膜,防止细胞色素C进入胞质;而Bax恰恰相反,其渗透到线粒体膜外,容许细胞色素c释放至胞浆,由此触发半胖氨酸蛋白酶(Caspases)级联反应引起细胞凋亡〔13〕。本研究提示两药联合应用可能是依赖线粒体途径发挥协同作用促进细胞凋亡。
1 王志学,孙立新,宋有鑫,等.不同浓度吗啡与5-氟尿嘧啶联合应用对MCF-7乳腺癌细胞增殖凋亡的影响〔J〕.广东医学,2012;33(19):2881-4.
2 王志学,孙立新,李汝泓,等.不同浓度的吗啡与5-氟尿嘧啶联合应用MCF-7乳腺癌细胞凋亡与细胞周期的影响〔J〕.中国老年学杂志,2012;32(15):3223-6.
3 郝振军,王志学,孙立新,等.不同浓度吗啡对5-氟尿嘧啶诱导的MCF-7乳腺癌细胞凋亡时Bcl-2、Bax表达的影响〔J〕.中国老年学杂志,2012;32(23):5164-6.
4 王志学,孙立新,李汝泓,等.不同浓度吗啡与5-氟尿嘧啶联合应用对MCF-7乳腺癌细胞Bcl-2、Bax表达的影响〔J〕.实用医学杂志,2012;28(20):3441-3.
5 张咸伟,丁汉琳,张传汉,等.芬太尼对MCF-7细胞增殖和细胞周期影响研究〔J〕.中国医师杂志,2005;7(1):23-5.
6 丁汉琳,张咸伟,张传汉.芬太尼影响MCF-7细胞凋亡的实验研究〔J〕.实用医学杂志,2004;20(12):1351-3.
7 El Mouedden M,Meert TF.The impact of the opioids fentanyl and morphine on nociception and bone destruction in a murine model of bone cancer pain〔J〕.Pharmacol Biochem Behav,2007;87(1):30-40.
8 Pettigrew CA,Cotter TG.Deregulation of cell death(apoptosis):implications for tumor development〔J〕.Discov Med,2009;8(41):61-3.
9 Wu M,Perroud TD,Sivastava N,et al.Microfluidically-unified cell culture,sample preparation,imaging and flow cytometry for measurement of cell signaling pathways with single cell resolution〔J〕.Lap Chip,2012;12(16):2823-31.
10 Clark MJ,Robien K,Slavin JL.Effect of prebiotics on biomarkers of colorectal cancer in humans:a systematic review〔J〕.Nutr Rev,2012;70(8):436-43.
11 Azmi AS,Wang Z,Philip PA,et al.Emerging Bcl-2 inhibitors for the treatment of cancer.Expert Opin Emerg Drugs〔J〕.2011;16(1):59-70.
12 Adams JM,Cory S.The Bcl-2 apoptotic switch in cancer development and therapy〔J〕.Oncogene,2007;26(9):1324-37.
13 Rajendran RR,Kao GD.“No Turning Bax”in the combined battle against prostate cancer〔J〕.Clin Cancer Res,2007;13(12):3435-8.
