经皮冠脉栓塞法建立猪急性心肌梗死模型及血清缺血修饰白蛋白的变化
2015-09-12王丽平王绍欣段娜娜程建新汪砚雨刘相勇魏利娟孟雅丽
王丽平 王绍欣 段娜娜 程建新 汪砚雨 王 可 刘相勇 魏利娟 孟雅丽
(河南科技大学第一附属医院心内科,河南 洛阳 471003)
心肌标志物的检测在诊断急性心肌梗死(AMI)方面发挥着主要作用,2012年欧洲心脏病学会(ESC)在心肌梗死的定义中也强调了心肌标志物的地位。AMI患者由于就诊时间不确定,早期检测血清心肌标志物可能出现较大偏倚,而动物实验可准确控制心肌梗死的时间点,真实反映心肌标志物的变化规律。近年研究表明血清缺血修饰白蛋白(IMA)是一个早期敏感的心肌缺血诊断指标,其敏感性显著高于传统的生化标志物〔1〕。本实验通过经皮明胶海绵栓塞冠状动脉法建立猪AMI模型并观察IMA动态演变,为AMI的早期诊断提供临床数据。
1 材料与方法
1.1 动物及主要仪器 中国动物试验用中华小型猪16只,由江苏泰州泰和生物科技有限公司提供。体重10~20 kg,同种同窝,雌雄不限。试验过程中对动物的处理符合动物伦理学标准。介入材料(Guiding导管、微导管、6F动脉鞘管)、心电监护仪、除颤仪、麻醉药品、抢救药品、试剂盒、酶标仪等。
1.2 试验方法术前禁食禁水8 h,肌注安定10 mg,5 min后,经猪耳缘静脉用静脉套管针建立静脉通路,氯胺酮10 mg/kg缓慢静推麻醉后,将小型猪仰卧位固定至导管床,静推阿托品25 μg/kg抑制口腔分泌物,保持呼吸道通畅,呼吸机及除颤仪备用。连接心电监护电极及四肢导联,心率160~200次/min。在手术过程中根据猪肢体活动情况静脉轮流追加氯胺酮20 mg/次及地西泮(安定)5 mg/次,观察生命体征,避免呼吸抑制。手术方法:①达到麻醉理想状态后,常规消毒铺巾,用桡动脉穿刺针以seldinger法穿刺猪右侧股动脉,将6F桡动脉鞘植入猪股动脉,鞘内注射肝素10 000 U,以后每隔1 h追加2 000 U。②在X射线血管造影机下,采用左前斜45°,在J型导丝的引导下,送6F JR4.0Guiding导管至升主动脉根部测压力165/130 mmHg,再分别进入左右冠状动脉多体位造影,多体位投照,明确分析冠状动脉分布。③将一Runthrough NS导丝送入回旋支远端,送另一Runthrough NS导丝至OM支,沿此NS导丝送入微导管至钝缘支,沿微导管缓慢匀速注入明胶海绵混悬液约2 ml,造成钝缘支闭塞,行冠脉造影示钝缘支血流中断,成功建立心梗模型。④撤出NS导丝及微导管,在J型导丝引导下撤出指引导管,拔出桡动脉鞘,将锁骨下静脉管植入猪股动脉内,绷带加压包扎固定。⑤术后每天给予肝素3 000 U皮下注射,口服阿司匹林75 mg/d。
1.3 心肌标志物检测 分别于术前及术后10 min、30 min、1、2、3、4、6、8、10、12、24、48 h 抽取猪耳缘静脉血,在 30 min 内以3 000 r/min离心,分离出血清后放在-80℃的冰箱保存待用。用双抗体夹心酶联免疫吸附测定法(ELISA)检测IMA,试剂盒由艾莱萨生物科技(上海)有限公司提供。严格按照试剂盒的说明书操作,用美国伯腾酶标仪完成测定。
病理检查:分别于术后1、3、5、7、10 d将猪处死,取出心脏用0.9%生理盐水灌洗干净,置于40 g/L的甲醛液中固定7 d,于侧壁及左室后壁梗死区、缺血区和正常区中心切取0.3 cm×0.3 cm的组织,分别用70%、80%、90%、95%、100%的乙醇脱水2~4 h,二甲苯透明30 min,再浸蜡、包埋,制成4 μm厚的石蜡切片,进行苏木精-伊红染色,光学显微镜下观察。
1.4 统计学方法应用SPSS16.0软件行重复测量方差分析。
2 结果
2.1 模型建立结果在AMI模型制作过程中共有15头猪存活且达到AMI动物模型标准,其中1头在模型制作完成后24 h因烦躁呼吸窘迫死亡,解剖后证实死于肺栓塞。
2.2 冠脉堵闭情况 15只猪成功完成冠脉造影,明胶海绵混悬液均成功注入LCX第一钝缘支,见图1。
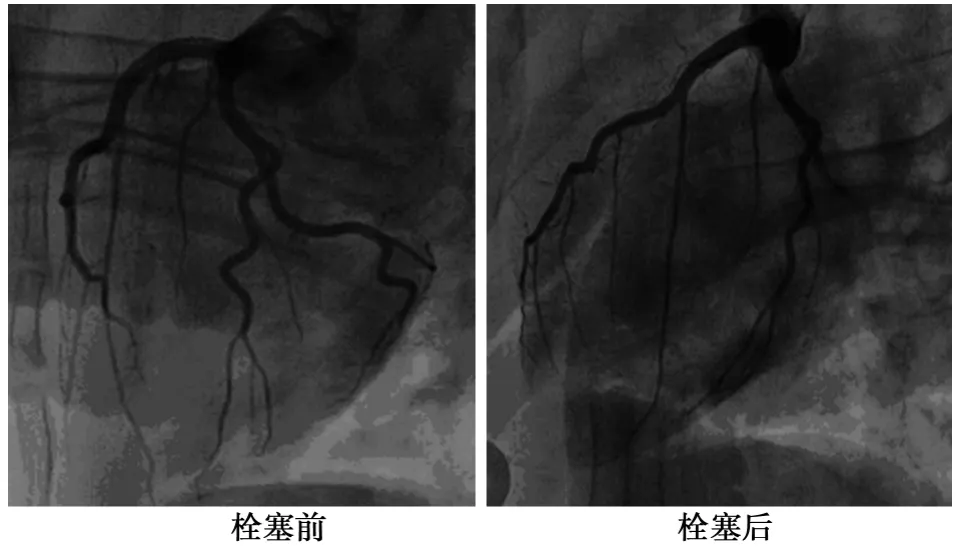
图1 冠状动脉造影图像
2.3 猪心电图(ECG)变化 明胶海绵混悬液堵塞猪第一钝缘支后ECG可见相关导联ST段抬高,见图2。
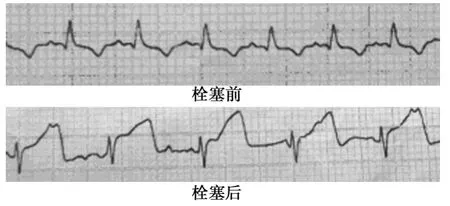
图2 心电图变化
2.4 IMA水平检测 术前血清IMA水平为(37.8±0.16)U/ml在猪心梗模型建立成功10 min后血清IMA〔(70.1±0.19)U/ml〕开始迅速升高,30 min、1 h、2 h、3 h、4 h IMA 水平分别为(91.3±0.42)、(105.7±0.15)、(116.0±0.33)、(126.9±0.30)、(133.5±0.55)U/ml,6 h 达 到 峰 值 〔(142.6±0.39)U/ml〕,之后开始下降,术后 8、10、12、24 h IMA 水平分别为(131.7±0.41)、(122.1±0.32)、(102.0±0.53)、(41.6±0.60)U/ml,48 h时 IMA 在血中的浓度〔(31.9±0.38)U/ml〕接近正常范围。
采用重复测量方差分析得出F值为1.019×104,各时间点IMA浓度与术前相比有统计学意义(P<0.01);48 h时间点与术前比较无统计学意义(P>0.05)。
2.5 病理检测结果新鲜心脏标本可见14只猪心肌坏死部位基本一致,位于左室的侧壁及后壁,梗死区室壁变薄颜色灰白,梗死随时间的延长质地变硬凹陷。
苏木素-伊红染色显示未梗死心肌细胞排列整齐、形态正常、分界清楚,细胞核位于中心,胞质染色均匀,心肌横纹可见。梗死区在左室的侧壁及后壁,光镜下梗死区心肌细胞变性、胞质深染,核固缩消失,胞质溶解,肌纤维断裂,纤维组织增生,横纹模糊,各种细胞排列紊乱,炎性细胞浸润。见图3。
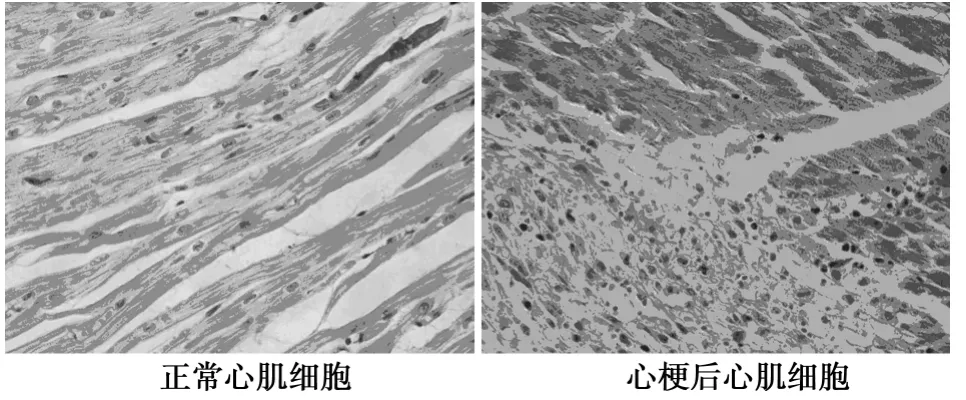
图3 AMI模型病理改变(HE,×400)
3 讨论
成功建立AMI动物模型可为心肌标志物的研究搭建一个良好的平台。目前国内外多通过开胸结扎鼠、兔等小型动物的不同部位的冠状动脉建立AMI动物模型,但开胸结扎手术复杂,创伤大,术后恢复慢、易感染、死亡率高,且小动物与人体的切合度偏低,不利于实验研究。随着介入治疗技术的成熟及普及,经皮腔内冠状动脉成形术建立AMI模型对动物创伤小、死亡率低、术后容易饲养、恢复较快。猪在生理特点、疾病发生和冠脉解剖结构方面与人类相近,血管内膜和心肌损伤的机制和恢复的时间也与人类相似〔2〕。本实验采用seldinger法穿刺猪股动脉来建立心肌梗死模型创伤小,简单易行,操作方便,可重复性强,国内外鲜有报道。
在AMI早期心肌缺血时,缺血心肌局部血流灌溉不足氧供减少,组织细胞反应性氧产物增多、酸中毒、自由基损害,细胞膜上的各种能量依赖性离子泵破坏等代谢变化,使血清白蛋白(HSA)的性质发生变化,氨基的N端的2~4个氨基酸残基被氧化修饰产生了结构的改变,而导致了与过渡金属结合能力下降,使HSA转化为IMA。在心肌缺血或坏死早期,心肌坏死标志物均为阴性时,IMA作为高敏的缺血指标就可在血液中检出,可以帮助AMI的早期诊断,以便在疾病的可逆期内进行危险分层及干预来改善患者的预后,减少病死率〔3〕。
IMA对心肌缺血有很高的灵敏度〔4,5〕。还可用于急性胸痛患者的排除诊断及AMI的危险分层〔6,7〕。既是心肌缺血开始时的敏感标志物,在AMI的排除诊断中发挥着重要的作用。
本实验通过建立猪AMI模型,完整地反映了从心肌缺血到梗死的病理演变,客观准确科学地反映了心肌酶的动态变化过程。本实验发现,IMA在心肌梗死后10 min后迅速升高,6 h达到峰值,之后开始逐渐下降,约48 h降至正常。传统的心肌标志物如cTnI、肌酸激酶同工酶(CK-MB)在诊断AMI方面都有较高的特异性,但多在心肌损伤后4~6 h后才会出现,在心肌缺血的可逆期内多检测不到〔8〕。IMA高度的敏感性能在可逆期尚未发生心肌梗死情况下迅速检测出心肌缺血及损伤,有助于急诊室胸痛患者的早期诊断及排除急性心脏疾病,避免因漏诊冠状动脉病变而造成严重的后果。
IMA可随血液循环于体内各个组织器官,在非心源性缺血的情况下如脑、肺、胃肠道和骨骼肌缺血时IMA也会增高,其特异性较低〔9〕。但其高度的敏感性适用于cTnI阴性且ECG正常的胸痛患者的心肌缺血或心肌梗死的排除诊断,所以在诊断AMI时应结合其他的心肌生化标志物、ECG及临床症状体征来综合分析,从而快速准确地诊断病情,让患者得到及时有效的治疗。现在主张AMI患者同时检测cTn和IMA,提高AMI的灵敏度且可使确诊的时间提前。
1 Dominguez-Rodrignez A,Abreu-Gonzalez P.Current role of ischemiamodified albumin in routine clinical practice〔J〕.Biomarkers,2010;15(8):655-62.
2 Suzuki Y,Yeung AC,Ikeno F.The representative porcine model for human cardiovascular disease〔J〕.J Biomed Biotechnol,2011;2011:195483.
3 Vasile VC,Jaffe AS.Emerging biomarkers for acute heart conditions.〔J〕.Curr Opin Cardiol,2014;29(4):312-8.
4 Dawie J,Chawla R,Worku Y,et al.Diagnosis of ischemic heart disease using CK-MB,troponin-I and ischemia modified albumin.〔J〕.Ethiop Med J,2011;49(1):25-33.
5 Patil SM,Banker MP,Padalkar RK,et al.The clinical assessment of ischaemia modified albumin and troponin I in the early diagnosis of the acute coronary syndrome〔J〕.Clin Diagn Res,2013;7(5):804-8.
6 Collinson PO,Gaze DC,Bainbridge K,et al.Utility of admission cardiac troponin and ischemia modified albumin'measurements for rapid evaluation and rule out of suspected acute myocardial infarction in the emergency department〔J〕.Emerg Med J,2006;23(4):256-61.
7 Pollack CV J r,Peacock WF,Summers RW,et al.Ischemia modified albumin(IMA)is useful in risk stratification of emergency department chest pain patients〔J〕.Acad Emerg Med,2003;10(5):555.
8 Maneewong K,Mekrungruangwong T,Luangaram S,et al.Combinatorial determination of ischemia modified albumin and protein carbonyl in the diagnosis of nonST-elevation myocardial infarction〔J〕.Indian J Clin Biochem,2011;26(4):389-95.
9 Shen XL,Lin CJ,Han LL,et al.Assessment of ischemia-modified albumin levels for emergency room diagnosis of acute coronary syndrome〔J〕.Int J Cardiol,2011;149(3):296-8.
