建立一种N-ras突变检测的“凸背”引物荧光PCR新技术
2015-09-10金霆费政芳
金霆 费政芳
建立一种N-ras突变检测的“凸背”引物荧光PCR新技术
金霆 费政芳★
目的 建立一种简便、省时、有效的N-ras突变检测的“凸背”引物荧光PCR新技术。
方法 对比 “凸背”引物荧光PCR新技术和Sanger测序法:通过对混有不同比例的N-ras基因热突变G13D(GGT>GAT)质粒的样本进行对照检测来比较两者的灵敏度;对97例急性髓细胞白血病(AML)患者的外周血的DNA进行N-ras的G13D突变检测,统计两者的符合率。 结果 “凸背”引物荧光PCR新技术能检测出混有5%突变质粒型的样本,其灵敏度达5%,高于Sanger测序法的10%~20%。在97例AML患者的外周血的DNA中,“凸背”引物荧光PCR新方法和Sanger测序法检测到N-ras基因G13D突变分别为19例和18例,符合率达94.7%。 结论 “凸背”引物荧光PCR新技术比测序法更为快速、简单,有更高的灵敏度,容易实现。
N-ras;“凸背”引物荧光PCR新技术;Sanger测序法
急 性 髓 细 胞 白 血 病 (acutemyelocytic leukemia,AML)是由多能干细胞或已轻度分化的前体细胞核型发生突变所形成的造血系统的克隆性恶性疾病[1-2],是一个具有高度异质性的疾病群。被克隆的白血病细胞,会产生凋亡遇阻、分化阻碍、增殖失控等问题,让细胞停滞在不同的发育阶段[3]。AML占成年人急性白血病的70%左右,是恶性肿瘤中死亡率较高的疾病之一。其年发生率约为4.6/10万人,男性略多于女性。越来越多研究表明,AML的发生与基因突变有关,其中与N-ras的基因突变[4-5]的关系最大。N-ras是ras基因家族中的一员,其突变导致Ras-GTP处于持续激活状态,引起细胞恶性增殖和转移。当Ras蛋白接受信号刺激或自身突变活化后,主要通过刺激两条途径 (Raf/Mek/Erk增殖和 PI3K/Akt抗凋亡)上的蛋白磷酸化来发挥作用,进而导致AML的发生[6]。N-ras基因发生突变时不利于预后[7-8]。研究表明,MDS患者在向AML转化过程中,常常会发生N-ras基因突变[9-10],可作为AML患者预后的一个判断。其中,N-ras主要基因突变发生于1号外显子的 12、13密码子上,由G突变为A[11-13]。本文采用 “凸背”引物荧光PCR新方法和Sanger测序法检测N-ras的1号外显子13密码子G13D (GGT>GAT)突变型,比较两者的一致性和灵敏性,寻找一种准确、便捷、有效的N-ras基因突变检测方法,以便更好地作为医生判断患者情况的参考,有利于患者的治疗。
1 材料与方法
1.1 标本来源
收集福建医科大学附属福州市第一医院2012年至2013年间AML患者的外周血97例。其中男性患者61例(62.89%),女性患者36例(37.11%)。年龄范围为50至80岁,其中男性患者67.3±8.6岁,女性患者69.4±7.6岁。标本均为检验科存档血液样品。
1.2 主要仪器与试剂盒
应用7300实时荧光定量PCR仪(ABI公司),ABI 9700 PCR仪 (ABI公司)和QIAamp DNA Blood Mini Kit试剂盒(Qiagen公司)进行检测。
1.3 方法
1.3.1 外周血DNA提取
采用Qiagen公司的QIAamp DNA Blood Mini Kit试剂盒,按试剂盒说明书操作,提取基因组DNA,提取后放置于-20℃保存备用。
1.3.2 引物设计
用Primer Express 5.0软件为“凸背”引物荧光PCR新方法设计N-ras基因的1号外显子的野生型引物探针和突变型引物探针。其中,野生型的上游引物为NRAS-FW1:5′-GTGGTGGTTGGAGCA AAAAG-3′;突变型G13D的上游引物为Nras-FM1: 5′-ACTGGTGGTGGTTGGAGCAAAAAA-3′。共用的下游引物为Nras-RW1:5′-AAGTGGTT CTGGATTAGCTG-3′。共用的探针为Nras-PW1:5′-TGTTGGGAAAAGCGCACTGACAATC-3′。为Sanger测序法设计引物:上游引物为Nras-F2:5′-GCTGTTCATGGCGGTTCC-3′,下游引物为Nras-R2:5′-AGAATCCTCTATGGTGGGATCA-3′,大小为218 bp。
1.3.3 “凸背”引物荧光PCR新方法检测
在“凸背”引物荧光PCR新方法中,设计的野生型上游引物和突变型上游引物分别检测N-ras野生型和 N-ras的 G13D突变型。上游引物在N-ras基因的G13D突变点区与相应型别的模板匹配 (野生型上游引物与N-ras野生型模板匹配,突变型上游引物与N-ras的G13D突变型匹配)。但导入5个A碱基发生突变点后,导入碱基与原序列不匹配而构造1个“凸背”。因为“凸背”与基因原序列不匹配,所以引物跟模板的结合力不强。当其3′端碱基序列与模板相匹配,引物就可以继续延伸,产生荧光曲线。而当其3′端碱基序列与模板不匹配时,因为引物的“凸背”结构的影响,引物将不能延伸下去,无法PCR扩增,产生不了荧光曲线(见图1)。
在7300实时荧光定量PCR仪对同一标本DNA进行野生型引物探针和突变型引物探针的荧光定量PCR。反应条件:95℃15 min;93℃15 s,55℃ 50 s,40个循环。对结果进行分析:同一个标本,若有突变型引探管有荧光曲线,而野生型引探管没有荧光曲线,则此标本为G13D突变型;反之,野生型引探管有荧光曲线,突变型引探管没有荧光曲线,则此样本为野生型;若两者皆有荧光曲线,则此样本杂合型,即既有野生型DNA,也有突变型DNA(见图2)。
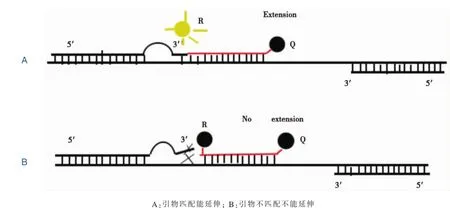
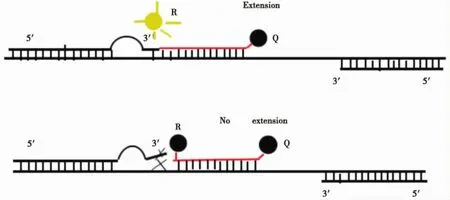
图1 “凸背”引物的作用示意图
1.3.4 Sanger测序法检测
第一步,用引物Nras-F2和Nras-R2在ABI 9700 PCR仪进行N-ras的目的基因PCR扩增。第二步,待PCR扩增结束后,取5 μL PCR产物进行2%琼脂糖凝胶电泳,观察是否在218 bp处有目的条带。第三步,看到有明显的单一目的条带,则纯化回收PCR产物。第四步,在3500 xL Genetic Analyzer上进行PCR测序,然后利用ABI公司Sequencing Analysis软件进行数据收集和分析。
1.4 两种方法灵敏度的检测
先将N-ras野生型质粒和G13D突变型质粒两者稀释至同一浓度:2 ng/μL。然后,以不同的比例 (100%、50%、20%、10%、5%、1%、0%)混合两者,作为PCR模板,分别用“凸背”引物荧光PCR新方法和Sanger测序法进行检测。
1.5 两种方法对97例AML患者的外周血标本的检测
同时用“凸背”引物荧光PCR新方法和Sanger测序法对97例AML患者的外周血标本进行检测,并用配对四格表统计分析数据。
2 实验结果
2.1 两种方法灵敏度的比较
在混有不同比例N-ras突变型G13D基因的样本中,“凸背”引物荧光PCR新方法能检测出含5%G13D型突变的样本,即灵敏度达5%(见图3),而Sanger测序法的灵敏度为10%~20%,故该方法的灵敏度比传统的Sanger测序法更高。
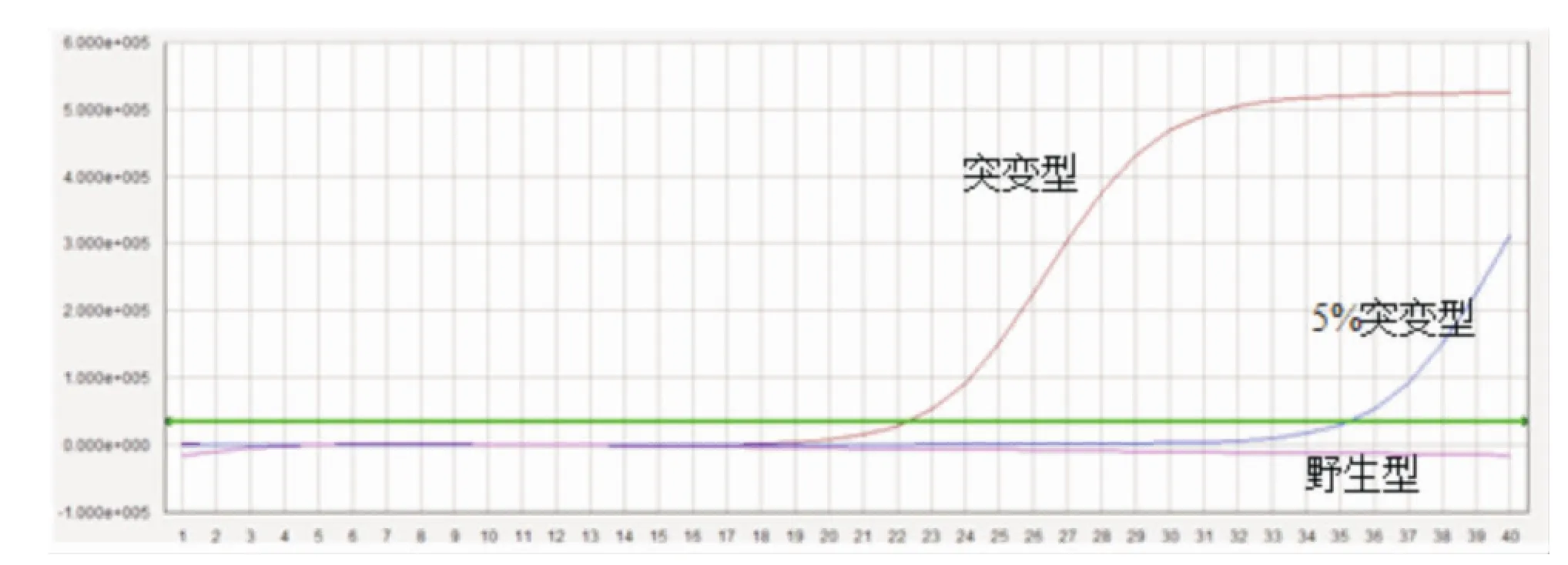
图3 “凸背”引物荧光PCR新方法的灵敏度
2.2 两种方法检测97例AML标本结果
“凸背”引物荧光PCR新方法在97例AML 患者外周血标本中,共检测到N-ras基因G13D突变19例。Sanger测序法检测到18例(见图4)。
将Sanger测序法和“凸背”引物荧光PCR新方法检测结果不同的样本的PCR产物做克隆,经测序确认,该样本含有G13D突变,这说明了“凸背”引物荧光PCR新方法的灵敏度高。
对“凸背”引物荧光PCR新方法和Sanger测序法的检测结果进行统计,如下表(表1)。用配对卡方检验做统计学处理,经SPSS 13.0软件统计分析结果显示,Kappa=0.9(P<0.001),两方法检测结果的一致性有统计学意义,检测一致性好。
3 讨论
AML与环境、职业及遗传因素都有密切的关系。而且,发达国家患AML的几率比发展中国家高,人类会随年龄的增加而增加患AML的风险。AML可以说是一种中、老年病,占成人急性白血病的70%左右,男性发病高于女性。
Ras基因的蛋白产物 p21是一种膜结合 G蛋白,多条信号转导途径都与其有关,如MEK、EPK[14]。当ras基因发生突变,其功能就处于异常活跃状态,失去控制,持续不停地激活调控细胞生长和增殖的信号传导途径,导致细胞异常生长。在ras基因中,MDS的患者在向AML转化过程中往往会发生N-ras基因突变[15-16]。因此,检测N-ras基因是否发生突变,有很大的意义。
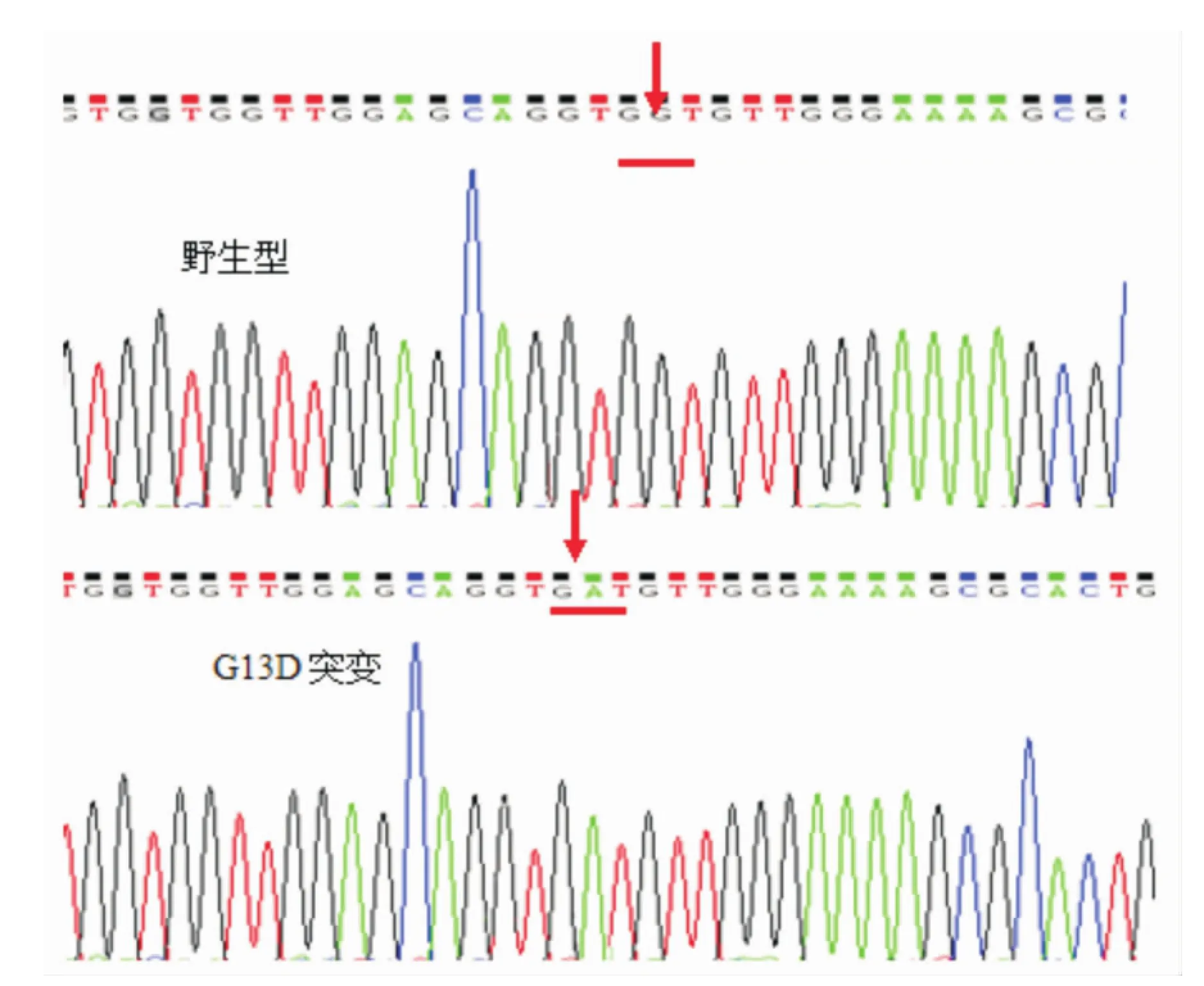
图4 Sanger测序法的测序结果

表1 “凸背”引物荧光PCR技术法和Sanger测序法的检测结果Table 1 The detective results of“convex dorsal”primers fluorescent PCR method and Sanger sequencing method
虽然直接测序法是检测基因突变的金标准,但其缺点也特别明显:灵敏度不高、耗时长、操作繁琐,容易在中间环节出差错。对于突变比例低的标本进行基因突变检测的时候,直接测序法是无法精确的。
本文同时用 “凸背”引物荧光PCR新方法和Sanger测序法对97例AML患者的N-ras的1号外显子的热点突变G13D进行检测,对比结果发现,两者达到94.7%的符合率。用SPSS 13.0统计软件进行统计分析,两种方法检测比较采用配对卡方检验做统计学处理,经SPSS 13.0软件统计分析结果显示,Kappa=0.9(P<0.001),两方法检测结果的一致性有统计学意义,检测一致性极好。在检测N-ras基因G13D突变上,“凸背”引物荧光PCR新方法比Sanger测序法多检测出一例突变标本。经过克隆测序复核验证,该例标本为G13D突变。
从灵敏度上来看,“凸背”引物荧光PCR新方法能检测出低至混有5%N-ras基因G13D突变型质粒的样本,即灵敏度达5%,而Sanger测序法只能达到10%~20%,说明“凸背”引物荧光PCR新方法更有优势。从操作和速度上来比较,“凸背”引物荧光PCR新方法能采用96个孔板的实时荧光PCR仪,在2个小时内能得出90多个样本的结果,而Sanger测序法的操作和时间上都不如 “凸背”引物荧光PCR新方法。
综上所述,在N-ras基因突变检测中,较之Sanger测序法,“凸背”引物荧光PCR新方法具有迅速、简单、灵敏度高等优势,能方便应用到研究N-ras与AML之间的直接关系,也为AML预后提供有力依据。
[1] 邱林,马俊.急性髓细胞白血病预后相关分子遗传学研究的最新进展[J].实用医院临床杂志,2011,8(4)1-6.
[2] 彭玲,罗军.急性髓细胞白血病FLT3基因突变及靶向治疗研究进展[J].Internal Medicine of China,2008,3 (2):232-234.
[3]Reuter CW,Krauter J,Onono FO,et al.Lack of noncanonical RAS mutations in cytogenetically normal acute myeloid leukemia[J].Ann Hematol,2014,93(6):977-982.
[4]Jeong JH,Park SH,Park MJ,et al.N-ras mutation detection by pyrosequencing in adult patients with acute myeloid leukemia at a single institution[J].Ann Lab Med,2013,33(3):159-166.
[5]Yang X,Qian J,Sun A,et al.RAS mutation analysis in a large cohort of Chinese patients with acute myeloid leukemia[J].Clin Biochem,2013,46(7-8):579-583.
[6]Levis M.Recent advances in the development of smallmolecule inhibitors for the treatment of acute myeloid leukemia[J].Current Opinion in Hematology,2005,12(1):55-61.
[7]Kiyoi H, Naoe T, Nakano Y, et al.Prognostic implication of FLT3 and N-RAS gene mutations in acute myeloid leukemia[J].Blood,1999,93(9):3074-3080.
[8]de Melo MB,Lorand-Metze I,Lima CS,et al.N-ras gene point mutations in Brazilian acute myelogenous leukemia patients correlate with a poor prognosis[J].Leuk Lymphoma,1997,24(3-4):309-317.
[9]Kelly LM,Liu Q,Kutok JL,et al.FLT3 internal tandem duplication mutations associated with human acute myeloid leukemias induce myeloproliferative disease in a murine bone marrow transplant model[J].Blood,2002,99(1):310-318.
[10]Shih LY,Huang CF,Wang PN,et al.Acquisition of FLT3 or N-ras mutations is frequently associated with progression ofmyelodysplastic syndrome to acute myeloid leukemia[J].Leukemia,2004,18(3):466-475.
[11]Speletas M,Arvanitidi K,Tzoanopoulos D,et al.Rapid mutational analysis of N-ras proto-oncogenein hematologic malignancies:study of 77 Greek patients[J].Haematologica,2001,86(9):918-927.
[12]Auewarakul CU,Lauhakirti D,Tocharoentanaphol C.Frequency of RAS gene mutation and its cooperative genetic events in Southeast Asian adult acute myeloid leukemia[J].Eur J Haematol,2006,77(1):51-56.
[13]Molina JR,Adjei AA.The Ras/Raf/MAPK Pathway[J].Journal of Thoracic Oncology,2006,1(1):7-9.
[14]Milella M,Tafuri A,Gregorj C,et al.Beyond single pathway inhibition:MEK inhibitors as a platform for the development of pharmacological combinations with synergistic anti-leukemic effects[J].Current Pharmaceutical Design,2005,11(21):2779-2795.
[15]de Souza FT,de Menezes SJ,Macedo SML,et al.Correlation ofN-raspointmutationswith specific chromosomal abnormalities in primary myelodysplastic syndrome[J].Leukemia Research,1998,22(2):125-134.
[16]Padua RA,Guinn BA,Al-Sabah AI,et al.RAS,FMS and p53 mutations and poor clinical outcome in myelodysplasias:a 10-year follow-up[J].Leukemia,1998,12(6):887-892.
Establishment of a new “convex dorsal” primer fluorescence PCR method to detect the mutation of N-ras
JIN Ting,FEI Zhengfang★
(Clinical Laboratory,The First Hospital of Fuzhou,Fujian Medical University,Fuzhou,Fujian,China,350004)
Objective To establish a simple, rapid and effective“convex dorsal” primer fluorescence PCR to detect the mutation of N-ras.Methods The N-ras mutation of G13D (GGT>GAT)was detected by “convex dorsal” primers fluorescent PCR method and Sanger sequencing method,respectively.The samples which were mixed with different proportions of the N-ras mutant plasmid(two methods)were detected,and their coincidence rates were calculated.97 acute myeloid leukemia(AML)peripheral blood samples were tested,and their coincidence rate was calculated.Results The samples which were mixed with 5%N-ras mutant plasmid can be detected by the “convex dorsal” primers fluorescent PCR method.Its sensitivity(5%)was higher than Sanger sequencing method’s.In 97 acutemyeloid leukemia(AML)peripheral blood samples,19 case with N-ras mutations(G13D)were detected by“convex dorsal”primers fluorescent PCR method,and 18 case with N-ras mutations(G13D)were detected by Sanger sequencing method.The coincidence rate is 94.7%.Conclusion The “convex dorsal”primers fluorescent PCR method is more convenient,high sensitivity than sequencing method,and easily achieved.[KEY WORDS]N-ras;“Convex dorsal”primers fluorescent PCR method;Sanger sequencingmethod
·综 述·
福建医科大学附属福州市第一医院检验科,福建,福州 350004★
费政芳,E-mail:fzf776@163.com
