采用多重连接依赖式探针扩增技术对先天性心脏病患儿进行基因拷贝数变异分析
2015-09-10罗世强严提珍唐宁黄际卫廖凤文李伍高李哲涛梁彪
罗世强严提珍唐宁黄际卫廖凤文李伍高李哲涛梁彪★
采用多重连接依赖式探针扩增技术对先天性心脏病患儿进行基因拷贝数变异分析
罗世强1,2严提珍1,2唐宁1,2黄际卫1,2廖凤文3李伍高1,2李哲涛1,2梁彪3★
目的 探讨多重连接依赖式探针扩增(multiplex ligation-dependent probe amplification,MLPA)技术在临床上检测先天性心脏病 (congenital heart disease,CHD)患者基因拷贝数变异(copy number variation,CNV)的可行性,了解中国未挑选的先天性心脏病患儿中基因拷贝数变异的发生情况。
方法 收集未挑选的125例先天性心脏病患儿,以100例年龄、性别匹配的健康儿童为正常对照组,采用MLPA技术(MLPA-kit P311试剂盒)对病例组和对照组的基因组DNA进行分析。 结果 在125例先天性心脏病患儿中,发现5个22q11.2微缺失,阳性检出率为4%(5/125)。在100例正常对照中均未检出拷贝数变异。 结论 CNV是CHD的重要致病机制,而22q11微缺失是CHD患者中常见的CNV的类型之一。MLPA技术具有高通量、快捷及成本较低等特点,可应用于先天性心脏病基因拷贝数异常的检测。
先天性心脏病(CHD);多重连接依赖式探针扩增(MLPA);基因拷贝数变异(CNV);22q11微缺失
先天性心脏病 (congenital heart disease,CHD),简称先心病,是胎儿时期心脏、大血管发育异常而导致的先天性畸形疾病,在新生儿非感染性死亡中占首位,是导致婴幼儿死亡、青少年及成人致残的重要原因之一[1]。国外资料表明足月、活产婴儿先心病的发病率是6‰ ~8‰。近年来先心病发病更呈上升趋势,已位居国内外出生缺陷病因首位[2,3]。随着人类基因组测序的完成,一些新的遗传变异被发现并日益受到重视。目前最受关注的是基因拷贝数变异(copy number variation,CNV),它是指人类基因组中广泛存在的,从1000 bp到数百万bp范围内的缺失、插入、重复和复杂多位点的变异。CNV通过扰乱基因活性和改变基因剂量来影响基因表达、表型差异和表型适应,从而引起疾病[4]。目前大部分散发性CHD的发病机制尚不明确,近年来,CNV与CHD发病关系的研究受到重视[5]。随着多重连接依赖式探针扩增(multiplex ligation dependent probe amplification,MLPA)技术和比较基因组杂交技术(comparative genomic hybridization,CGH)的出现,越来越多的染色体不平衡变异在CHD患者中被发现,为CHD的发病机制提供了新的研究方向。Agergaard等[6]研究发现在CHD患者中,22q11.2缺失发生率达1.4~2.5%,其中以室间隔缺损(ventricular septal defect,VSD)的发生率最高。Posch等[7]研究显示以间隔缺损为主的 CHD患者中存在 NKX2-5、GATA4、TBX5、BMP4、CRELD1基因的突变,但大部分散发病例突变阴性,是否存在上述基因的拷贝数变异尚不清楚。本研究通过MLPA技术对125例散发性CHD患者检测 NKX2-5、GATA4、TBX5、BMP4、CRELD1基因拷贝数变异及22q11.2缺失在CHD患者的分布情况,旨在进一步探讨CHD发病机制。
1 对象与方法
1.1 研究对象
受检对象来自于2012年1月至2014年6月柳州市妇幼保健院儿外科因CHD住院行心脏手术的125例儿童,其中男孩81例,女孩44例,年龄在8个月 ~17岁之间,均无亲缘关系。所有患儿均经心脏彩超、临床、手术确诊。CHD心脏分型情况见表1。本研究受检对象均得到患儿监护人知情同意。

表1 125例先天性心脏病患儿心脏分型情况Table 1 Classification of 125 cases with CHD
1.2 基因组DNA提取及浓度分析
抽取患儿静脉血2~4 mL,EDTA抗凝,采用酚-氯仿法提取基因组DNA,使用紫外分光光度计(GeneQuant 1300型,美国GE公司)测定所提取DNA在260 nm和280 nm处的吸光值,得出其浓度及纯度,并用TE溶液稀释至50 ng/μL的终浓度。纯度要求A260/A280在1.7~2.0之间。
1.3 MLPA分析
本研究采用荷兰MRC公司研发的SALSA MLPA P311-A2 CHD试剂盒,共44条探针,11条探针位于GATA4基因(外显子1~7)及其上下游区域、4条探针位于NKX2-5基因内 (外显子1和2)、10条探针位于TBX5基因内(外显子1~4,6~7,9~10,外显子5和8除外)、4条探针位于BMP4基因内 (外显子1,2,4,5)、2条探针位于CRELD1基因内 (外显子3和10)、3条探针位于22q11区域 (包括CDC45、GP1BB和DGCR8基因)。 12p13、17q23、2p24、6p12、2q37、7p14、4q22、7q32、18p11和6q23各一条探针作为对照。
1.3.1 多重探针杂交
取待测样本DNA 150 ng置于PCR管中,加TE至总体积为5 μL,于9700基因扩增仪(9700型,美国ABI公司)上98℃变性5 min,快速降温,25℃保持。取出PCR管后加入多重探针及MLPA缓冲液各1.5 μL,充分混匀后,95℃变性1 min,60℃杂交16~20 h,保持在54℃接着进行多重探针连接反应。
1.3.2 多重探针连接反应
在上述PCR管内加入连接酶-311 1 μL和连接酶缓冲液A、B各3 μL,及H2O 25 μL配成的连接混合液32 μL,54℃ 反应15 min,然后98℃5 min灭活连接酶-311,15℃保存。
1.3.3 多重PCR反应
在上述连接产物中,加入PCR引物及相应缓冲液混合液2 μL、聚合酶0.5 μL、H2O 7.5 μL配制成的混合液10 μL,总反应体系50 μL,进行PCR扩增。扩增条件为95℃变性 30 s、60℃退火30 s、72℃延伸60 s,35个循环,72℃延伸20 min,15℃保存。每一批反应均有两个正常样本作为对照(Human Genomic DNA,美国Promega公司)。
1.3.4 MLPA产物分析和结果判读
利用遗传分析仪(3500Dx型,美国ABI公司)对多重PCR扩增产物进行毛细管电泳和数据采集,用GeneMapper 3.7软件(美国ABI公司)获得各探针位点峰高和峰面积。所采集的数据通过Coffalyser.Net专用软件(荷兰MRC公司)进行分析,得出基因相对拷贝数比值(Ratio值)。根据试剂盒说明书,以Ratio值在0.7~1.3之间判定为正常,Ratio值<0.7为存在基因缺失,Ratio值>1.3为存在基因重复。
2 结果
2.1 125例CHD病患儿MLPA分析结果
在125例CHD病患儿中,共检出5例22ql1.2微缺失 (CDC45、GP1BB、DGCR8基因拷贝数缺失),阳性率为4.00%(5/125,见表2)。所有阳性样本均由两个研究者进行了2次重复检测,所得结果一致。5例22q11.2微缺失阳性病例中,4例为室间隔缺损 (VSD),1例为法洛四联症。在100例正常对照中均未检测出上述变异。MLPA阳性病例的基因相对拷贝数比值(Ratio比值)见(表3)。部分阳性病例的毛细管电泳图谱见图1。

表2 异常病例的检测结果Table 2 The detection results of abnormal cases
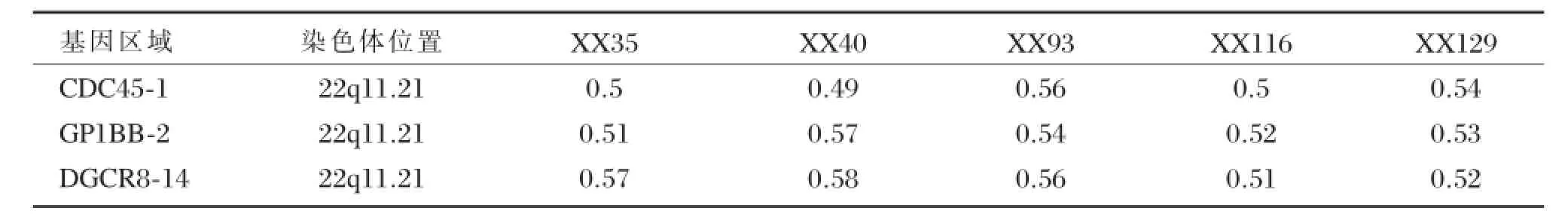
表3 MLPA阳性病例的基因相对拷贝数比值(Ratio比值)Table 3 The relative copy number ratio of MLPA positive cases(Rate ratio)

图1 部分样本的典型毛细管电泳标准化后的柱形图
3 讨论
CHD是人类最常见的出生缺陷之一。目前,我国有CHD患者约400万,其中复杂的、难治的或出生后易发生早期死亡的CHD约占20%以上。遗传变异是其重要的致病因素之一,阐明疾病的分子机制是现代医学的难题。近年来,随着基因组学研究方法和技术的进步,与疾病相关的遗传变异逐渐被发现,这些变异包括:染色体异常、CNV、新发突变和SNP等。染色体异常及CNV往往导致综合征型CHD,表现为心脏、血管的发育异常,甚至心外畸形及多种功能异常[8]。目前,临床对CHD的诊断主要依据临床症状、体征、心脏彩色超声、胸部X线及心电图的结果,这些方法可以有助于对已发生心脏的畸形和功能异常进行诊断,但无法对人群中CHD发生风险进行评估,采用现代分子诊断技术可对CHD患者在分子水平上进行诊断,同时也有助于排查CHD的高危风险。目前用于检测染色体异常和CNV的方法主要有核型分析和FISH,但是两种技术费时费力,且不利于发现新的变异及人群筛查,而MLPA是一种高通量检测基因组序列中拷贝数变异的成熟技术,可用于染色体异常和CNV等分子水平的检测[9]。本研究采用的MLPA试剂盒P311覆盖了与CHD发生相关的多个区域,包括常见的 22q11微缺失、GATA4、NKX2-5、TBX5、BMP4和CRELD1,共发现5例22q11微缺失的病例,证明这一试剂盒是CHD分子检测可靠的方法,其结果可作为临床诊断和产前诊断重要的补充。在产前诊断中,对于发现有阳性结果的胎儿家庭,我们告知其父母患儿出生后可能出现临床表型,由患儿父母选择是否引产;CHD患儿的临床表型有较高的异质性,患儿出现症状的时间也不同,对于已出生的患儿,分子诊断有助于早发现,提醒家长应早期就诊和及时干预,避免延迟诊断所带来的危害。
本研究证实 22q11微缺失是导致广西地区CHD最常见的病因。该变异导致的综合征是由多基因缺陷所导致的先天性多器官发育异常的一种临床症候群,又叫“22q11微缺失综合征”,主要的临床表型有心脏畸形、异常面容、胸腺发育不良、腭裂和低钙血症,人群发生率约为1/4 000。该病为常染色体显性遗传病,93%为新发突变,7%来自父母的遗传。在22q11缺失中,以经典的3 Mb缺失最为常见,占87%,近端1.5 Mb缺失占8%,其余5%为不典型缺失[10]。本研究发现5例患者携带的均为经典的3 Mb缺失。通过采用MLPA技术对CHD的患者进行分析,证实用MLPA对CHD进行分子诊断的可行性,说明 22q11微缺失是CHD常见的致病因素。同时也反应了GATA4、NKX2-5、TBX5、BMP4和CRELD1的拷贝数变异不是CHD的常见致病因素。研究发现本地区CHD患者中22q11.2缺失发生率为4%,高于Agergaard等[6]研究发现的1.4% ~2.5%,可能是因为不同地区、不同民族间存在差异引起。
CHD患儿结合临床症状、体征、心脏彩色超声、胸部X线及心电图的结果,再加上多重连接依赖式探针扩增技术对基因拷贝数变异分析可对CHD在分子水平上进行诊断,有助于排查CHD的高危风险。该技术对CHD患儿的早期诊断及胎儿的产前遗传学诊断意义更大,同时还可以结合其遗传诊断结果对CHD手术患者术后的效果进行评估。总之,MLPA是一种能同时检测多个基因上多个位点,高通量、耗时短、相对价廉的检测方法[11],值得在临床推广应用。
[1]Sissman NJ.Incidence of congenital heart disease[J].JAMA,2001,285(20):2579-2580.
[2]Miranovic V.The incidence of congenital heart disease:previous findings and perspectives[J].Srp Arh Celok Lek,2014,142(3-4):243-248.
[3]Yu Z,Xi Y,Ding W,et al.Congenital heart disease in a Chinese hospital:pre-and postnatal detection,incidence,clinical characteristics and outcomes[J].Pediatr Int,2011,53(6):1059-1065.
[4]Morrow EM.Genomic copy number variation in disorders of cognitive d-evelopment[J].J Am Acad Child Adolesc Psychiatry,2010,49(11):1091-1104.
[5] 陈雪,闫有圣,郝胜菊.先天性心脏病分子遗传学研究进展[J].中国优生优育,2013,19(7):583-587.
[6]Agergaard P,Olesen C,Ostergaard JR,et al.The prevalence of chromo-some 22q11.2 deletions in 2,478 children with cardiovascular malformati-ons.A population-based study[J].Am J Med Genet A,2012,158A (3):498-508.
[7]Posch MG,Perrot A,Schmitt K,et al.Mutations in GATA4,NKX2.5,CRELD1,and BMP4 are infrequently found in patients with congenital c-ardiac septal defects [J].Am J Med Genet A,2008,146A(2):251-253.
[8]Gelb BD, Chung WK.Complex genetics and the etiology of human congenital heart disease[J].Cold Spring Harb Perspect Med,2014,4(7):a13953.
[9] 黄际卫,商璇.多重连接依赖式探针扩增技术在遗传病分子诊断中的应用[J].分子诊断与治疗杂志,2012,04(4):274-278.
[10]Shaikh TH,Kurahashi H,Saitta SC,et al.Chromosome 22-specific low copy repeats and the 22q11.2 deletion syndrome:genomic organization and deletion endpoint analysis[J].Hum Mol Genet,2000,9(4):489-501.
[11]谢臻蔚,吕时铭.先天性心脏病的基因诊断研究进展[J].国际检验医学杂志,2009,30(3):250-251,254.
Gene copy number variation analysis of children with congenital heart disease by using multiplex ligation dependent probe method
LUO Shiqiang1,2,YAN Tizhen1,2,TANG Ning1,2,HUANG Jiwei1,2,LIAO Fengwen3,LI Wugao1,2,LI Zhetao1,2,LIANG Biao3★
(1.Key Laboratory of Birth Defects Prevention and Control in Liuzhou City,Liuzhou,Guangxi,China,545001;2.Laboratory of Liuzhou Maternal and Child Health-Care Hospital, Liuzhou,Guangxi,China,545001;3.Pediatric Surgery of Liuzhou Maternal and Child Health-Care Hospital, Liuzhou,Guangxi,China,545001)
Objective To investigate the efficiency of multiplex ligation dependent probe amplification(MLPA)method in detecting congenital heart disease(CHD)and evaluate the role of somatic copy number variation (CNV)in the genesis of CHD in China.Methods A total of 125 cases with CHD were collected.100 age and sex-matched normal subjects were served as control group.The genomic DNA from all the cases and healthy controls were detected by MLPA-kit P311.Results Of the 125 CHD patients,5 cases were detected with 22q11.2 microdeletion.The total detection rate is 4%(5/125).No CNVs was detected in the control group.Conclusion Somatic CNV plays an important role in the genesis of CHD,of which 22q11.2 microdeletion is one of the most significant and frequent CNV.MLPA is a high throughput,rapid and low-cost technique to detect CHD caused by CNV,including trisomies,microdeletion and microduplication.
Congenital heart disease(CHD);Multiplex ligation-dependent probe amplification (MLPA);Copy number variation(CNV);22q11 Microdeletion
资金项目:柳州市科学研究与技术开发计划项目(20140020404)
1.柳州市出生缺陷预防与控制重点实验室,广西,柳州 545001 2.柳州市妇幼保健院检验科,广西,柳州 545001 3.柳州市妇幼保健院小儿外科,广西,柳州 545001
梁彪,E-mail:biaoge19651107@126.com
注:罗世强和严提珍为并列第一作者
