雌激素受体α基因多态性与男性不育关系的 Meta分析
2015-09-09李天赋周青张翠蒋卫军吴秋月李卫巍许豪勤夏欣一江苏大学生命科学研究院江苏镇江0南京军区南京总医院解放军临床检验医学研究所江苏南京000江苏省计划生育科研所江苏南京009
李天赋,周青,张翠,蒋卫军,吴秋月,李卫巍,许豪勤,夏欣一,(.江苏大学生命科学研究院,江苏 镇江0;.南京军区南京总医院解放军临床检验医学研究所,江苏 南京 000;.江苏省计划生育科研所,江苏南京 009)
雌激素受体α基因多态性与男性不育关系的 Meta分析
李天赋1,周青1,张翠2,蒋卫军2,吴秋月2,李卫巍2,许豪勤3,夏欣一1,2
(1.江苏大学生命科学研究院,江苏 镇江212013;2.南京军区南京总医院解放军临床检验医学研究所,江苏 南京 210002;3.江苏省计划生育科研所,江苏南京 210029)
目的:运用 Meta分析的方法系统评价雌激素受体α基因多态性2位点(rs2234693和 rs9340799)与男性不育的相关性。方法:检索 PubMed、EMABSE、万方、中国知网等数据库,初筛得到文献 24篇,对符合纳入标准的文献使用 Stata 11.0软件在4个模型中进行分析,计算优势比值及95%可信区间评价其关联度,并进行敏感性分析及发表偏倚的评估。结果:共纳入6篇病例 对照研究,包括774名患者和841名健康对照者。Meta分析结果显示rs2234693基因的3种模型CC vs.TT(OR=0.72,95%CI:0.54-0.96)、CT vs.TT(OR=0.74,95%CI:0.58-0.94)和(CC+CT)vs.TT(OR=0.73,95%CI:0.58-0.91)有明显相关性,提示原发性不育的风险降低。而 rs9340799基因2种模型AA vs.GG(OR=1.67,95%CI:1.21-2.32)和 AA vs.(GA+GG)(OR=1.63,95%CI:1.32-2.03)也有明显相关性,提示男性不育的风险显著增加。结论:rs2234693 CC基因型可以降低男性不育的危险性,而rs9340799 AA基因型可能与男性不育相关。
雌激素受体α;男性不育;基因多态性
[Abstract]Objective:To analysis the relationship between two polymorphism genes of estrogen receptor α rs2234693 and rs9340799 and male infertility by Meta-analysis.Methods:We searched PubMed,EMABSE,CNKI and WanFang database,while 24 articles were concluded.Meta analysis was performed using Stata 11.0 software.Calculated the odds ratio and 95% confidence interval and evaluated the strength of the associations,sensitivity and publication bias.Results:For the rs2234693,there were significant association in the comparison of CC vs.TT(OR=0.72,95%CI:0.54-0.96),CT vs.TT (OR=0.74,95%CI:0.58-0.94)and(CC+CT)vs.TT(OR=0.73,95%CI:0.58-0.91)with male infertility.For rs9340799 polymorphism,increased risks were observed for the comparison of AA vs.GG(OR=1.67,95%CI:1.21-2.32)and AA vs.(GA+GG)(OR=1.63,95%CI:1.32-2.03).Conclusion:The rs2234693 CC genotype was associated with the decreased risk for male infertility;however,the rs9340799 AA genotype was associated with an increased risk for male infertility.
[Key words]estrogen receptor α;male infertility;polymorphisms
男性因素是造成20%~25%的家庭无法生育 的原因,其中约有一半是特发性不育[1]。男性不育患者中15%是由遗传因素所致,包括染色体变异和基因突变,造成了精子发生障碍和精子质量下降[2]。以往观点认为雌激素是“女性”激素,但近来越来越多的学者开始关注雌激素在男性生殖中的调节作用[3]。男性生殖系统中附睾、Sertoli细胞、Leydig细胞和生精细胞均存在雌激素[4]。研究发现[5]在发育过程中,补充雌激素会减少 Sertoli细胞数量并降低睾酮的生成,也会破坏胎儿的 Leydig细胞发育,抑制成人减数分裂后精子细胞的凋亡[6]。雌激素的生理功能在发育的不同阶段受到雌激素受体(estrogen receptors,ER)的调控。ER位于人染色体6q25,分为α、β两类,两者在雄性生殖系统的分布有所不同,研究结果也不尽相同[7]。ERα有多个多态性位点,其中位于内含子区域的 rs2234693、rs9340799研究较多[8]。近年来研究显示 ERα与精子发生障碍有密切关联,但研究结果却不一致。为了评估ERα基因多态性与男性不育的相关性,我们基于先前的研究进行了 Meta分析,现报告如下。
1 资料与方法
1.1 文献检索
通过计算机检索 PubMed、EMABSE、CNKI和万方等数据库,搜集国内外发表的关于 ERα基因多态性与男性不育相关性的文献。中文数据库的检索关键词为ERα、雌激素受体、rs2234693、rs9340799、多态性、男性不育。英文检索词:ERα、estrogen receptors、rs2234693、rs9340799、polymorphism、male infertility。语种限定为英文和中文,检索时间为建库至2014年6月30日。同时辅以文献追溯。
1.2 纳入和排除标准
纳入标准:①关于rs2234693、rs9340799多态性与男性不育关系的病例对照研究;②研究对象为人类;③数据齐全,有各基因型在病例组和对照组的频数;④对照组基因型分布符合Hardy-Weinberg(H-W)遗传平衡定律。排除标准:①单纯病例研究、病例报道、综述等文献;②数据质量不可靠或重复发表。
1.3 资料提取
由两位研究者独立进行文献筛选和资料提取,意见不一致时通过讨论或由第三位研究者协助解决。提取数据包括:第一作者姓名、发表年份、种族、病例对照组基因型分布和对照组H-W平衡检验值。
1.4 统计学分析
对照组基因型频率数据 H-W检验使用在线工具(http://ihg.gsf.de/cgi-bin/hw/hwal.pl)分析,P< 0.05表示该研究对照组 H-W检验不平衡。使用Stata 11.0软件计算优势比(OR)及 95%可信区间(95%CI),分析ERα基因多态性与男性不育关联度。共有3种基因型:野生纯合型基因(WW)、杂合型基因(WR)和纯合突变型基因(RR),计算显性遗传模型(WR+RR)vs.WW、隐性遗传模型 RR vs. (WR+WW)、共显性遗传模型WR vs.RR及WW vs.RR的 OR值,并采用 Q检验和 I2定量评估对纳入研究进行异质性检验[9]。若各研究结果之间无显著异质性(P>0.05),采用固定效应模型 Mantel-Haenszel方法合并OR值;反之则选用随机效应模型 DerSimonian and Laird法进行合并[10],并对可能引起异质性的因素进行亚组分析。I2值在0~25%之间为无异质性;25%~50%为轻度异质性;>50%为高异质性。敏感性分析为依次排除单个文献后重新进行 Meta分析,估计综合效应大小。通过 Begg秩相关法和Egger线性回归法[11]检验是否存在发表偏倚,P<0.05为有统计学意义。
2 结果
2.1 文献检索结果
检索到相关文献24篇,初步排除16篇,通过阅读全文排除1篇数据重复的文献和1篇缺少具体数据的文献,最终纳入 6篇[3,12-16]。全部为英文文献,其中4篇来自欧洲人群[3,13,15,16],2篇来自亚 洲黄 种人[12,14]。除文献[14]外对照组均符合 H-W平衡。除文献[13]其余各研究均使用聚合酶链反应 限制性片段长度多态性的方法(polymerase chain reaction -restriction fragment length polymorphism,PCRRFLP)进行基因多态性鉴定。所有研究对照组来源均为健康人群,根据WHO第5版指南,各项精液指标合格。病例组均为不育男性,精液检查确诊为无精子症和严重少精子症,各研究基本情况见表1。
2.2 分析结果
对于rs2234693基因,Meta分析显示欧洲人中CC vs.TT、CT vs.TT和(CC+CT)vs.TT三种模型结果有明显相关性,亚洲人中CC vs.TT、CT vs.TT和(CC+CT)vs.TT三种模型结果有明显相关性,提示 可 能 会 降 低 不 育 的 风 险 性 (表 2)。对rs9340799,AA vs.GG和 AA vs.(GA+GG)则增加了不育的风险系数,根据种群进行的亚组分析也提示在欧洲人中 AA vs.GG和AA vs.(GA+GG)两种模型以及亚洲人中AA vs.(GA+GG)模型结果均有相关性(表3)。
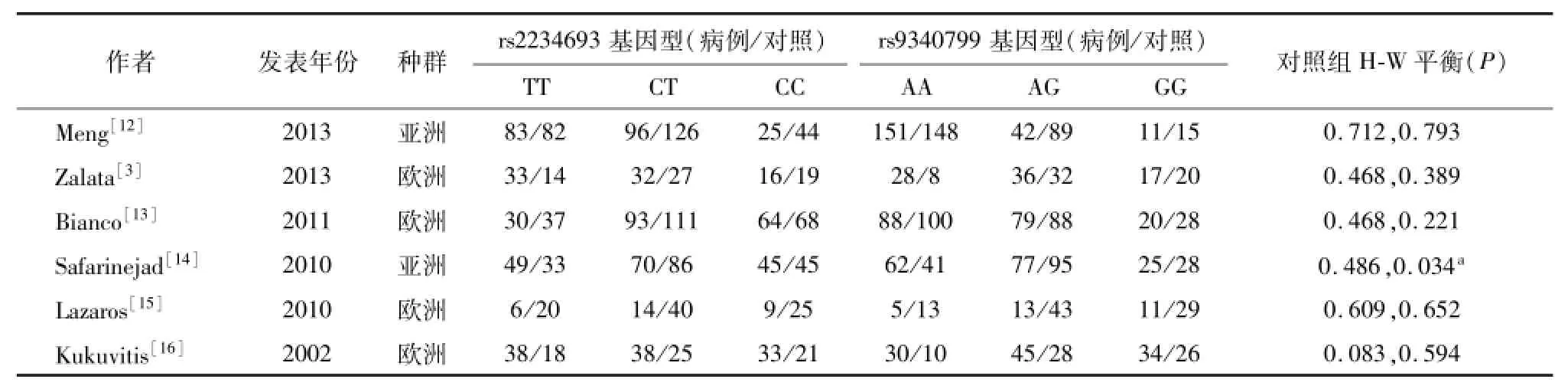
表1 纳入文献的基本情况
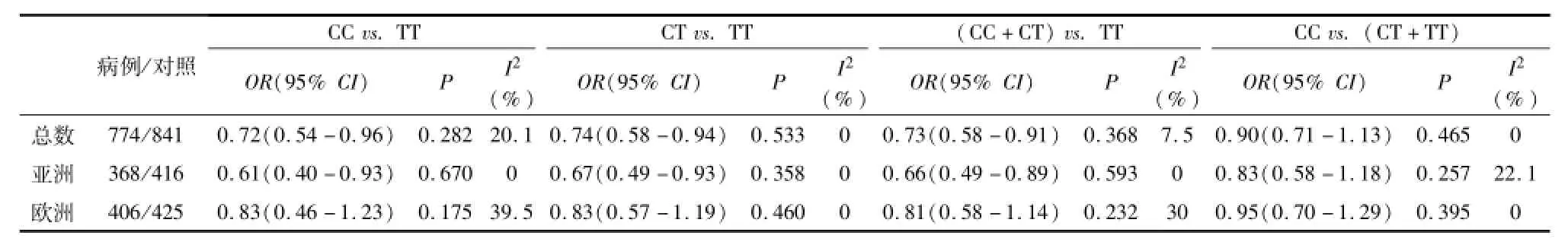
表 2 rs2234693多态性与男性不育的遗传易感性分析
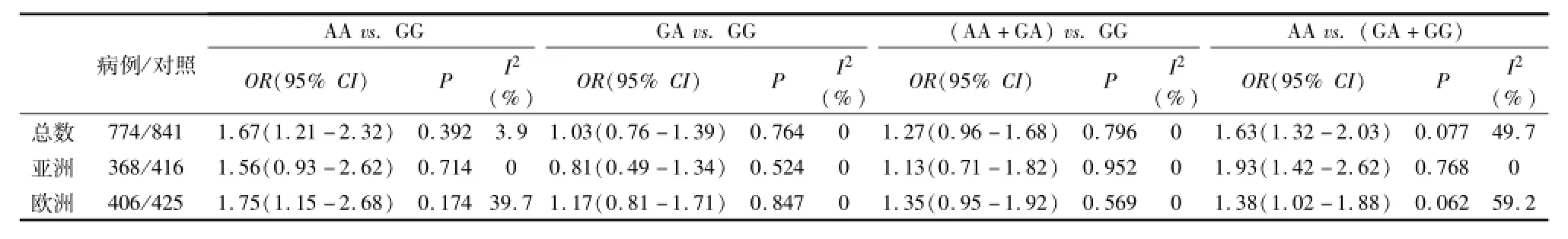
表 3 rs9340799多态性与男性不育的遗传易感性分析
2.3 异质性与敏感性分析
在rs2234693和 rs9340799这两个位点的文献分析中没有发现明显的异质性(P>0.05)。敏感性分析:剔除不符合H-W平衡的文献[14]后,显性遗传模型合并效应量无改变;依次单独剔除1篇文献后,各遗传模型合并效应量仍无明显改变。
2.4 发表偏倚
通过Begg漏斗图和 Egger线性回归法检验是否存在发表偏倚。漏斗图的形状并没有显示明显的不对称,Egger线性回归检验也提示没有发表偏倚(图1、图2、表4)。
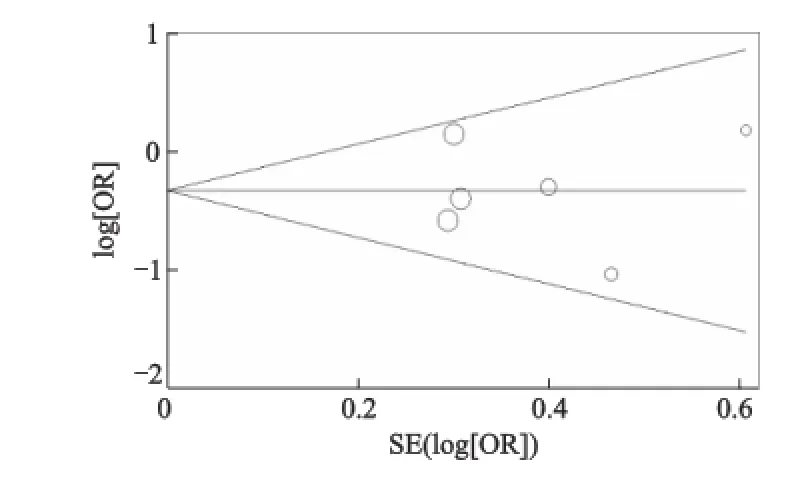
图1 rs2234693基因多态性发表偏倚的漏斗图(CC vs.TT)
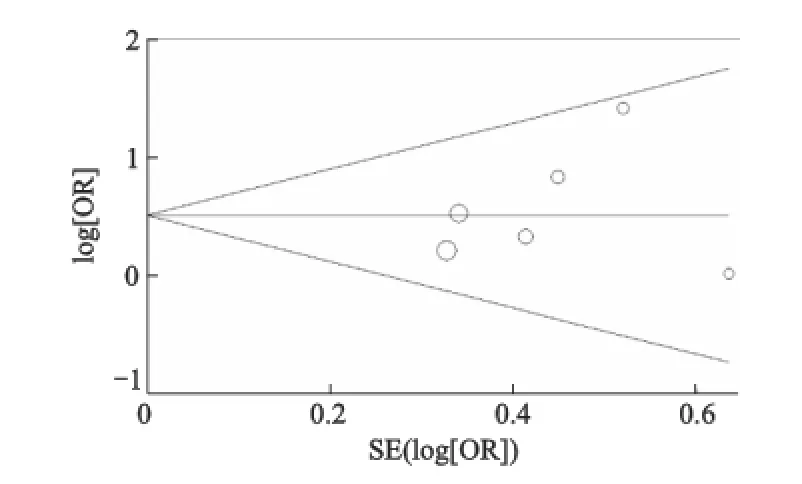
图2 rs9340799基因多态性发表偏倚的漏斗图(AA vs.GG)
3 讨论
大量研究表明,雄性动物的血清和睾丸网中都存在一定量的雌激素[17]。雌激素是生殖细胞的关键因素,参与诱导DNA的氧化损伤,异常的雌激素水平还会导致精子发生障碍[18]。雌激素可以通过增加核呼吸因子1(NRF-1)的表达调控线粒体的功能,通过与 NRF-1启动子区域的雌激素效应器交互作用从而实现对线粒体的调控[3]。以乳房细胞MCF-7为模型的体外实验表明,雌激素可以调控NRF-1的转录并且增加线粒体的合成[19]。这个发现表明ERα的多态性可以通过 NRF-1的转录增加线粒体活性,并使精子活动力增加[15]。受试者基因多态性导致ER功能改变的机制尚不清楚。研究表明基因多态性通过核苷酸序列的改变以及由此引起的ER mRNA二级结构的改变,可以引起mRNA功能的改变[20]。
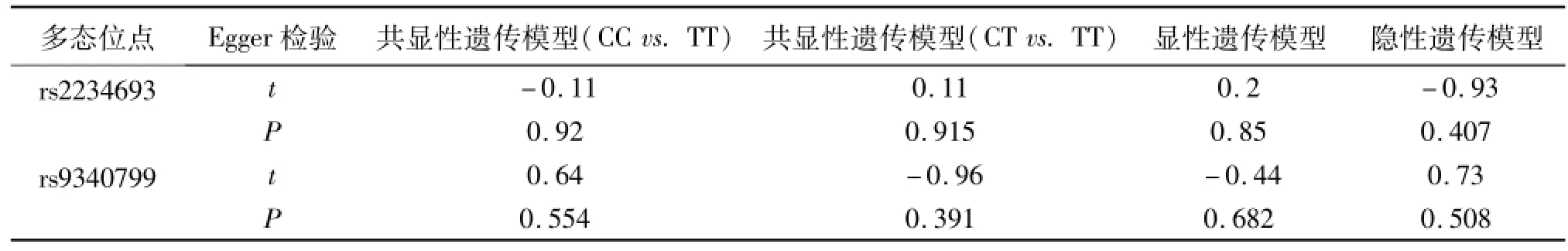
表4 ERα两个多态位点 Egger检验结果
ERα基因多态位点(rs2234693和rs9340799)通过作用于 CYP19调节雌激素,CYP19编码芳香化酶的表达,导致精子数量的下降并引起男性不育[21]。一些研究也证实特定的 ERα基因多态会生成低性激素结合球蛋白(SHBG)从而影响雌激素的结合,影响男性精子发生[22]。SHBG还参与了性激素的传递以及血清中雌、雄激素的浓度控制。Pavlovich等[23]发现与健康人相比,严重少精子症患者伴有低水平的雄激素及高水平的雌二醇。
本研究纳入了6篇病例对照研究,包括774名患者和841名健康对照者。合并结果表明rs9340799 AA基因型可能会增加男性不育的危险性,而 rs2234693 CC基因型可以降低男性不育的危险性。引起这种差异的原因可能在于不同人种间遗传因素及其生活环境的不同。异质性是影响研究结果可靠性的主要因素,本研究在总人群中均未发现明显异质性。H-W平衡是遗传学研究中的基本定律,我们对纳入的文献进行了检验,结果发现有1项研究不符合,剔除后结果无明显改变。我们采用Begg漏斗图和Egger线性回归检验分别定性和定量评估发表偏倚,发现4个遗传模型均无发表偏倚,证明结论可靠。
本研究存在以下不足:纳入文献质量一般,样本量较小,遗传关联性研究只有大量样本才能真实反映基因和疾病之间的关联。其次患者的其他信息(如生活方式、工作、年龄等)无法收集,需要进一步的研究来证实相关性。综上所述,ERα rs2234693 和rs9340799基 因多态 性与男 性 不育有 关。rs2234693 CC基因型可以降低男性不育的危险性,而rs9340799 AA基因型则可能增加男性不育的风险。ERα基因多态性与男性不育的关联性尚需大样本量、多中心研究及依据不育类型、种族和环境等分层分析进一步证实。
[1]Oehninger S,Franken DR,Ombelet W.Sperm functional tests[J].Fertil Steril,2014,102(6):1528 -1533.
[2]Ferlin A,Arredi B,Foresta C.Genetic causes of male infertility[J].Reprod Toxicol,2006,22(2):133 -141.
[3]Zalata A,Abdalla H,El-Bayoumy Y,et al.Oestrogen receptor α gene polymorphisms relationship with semen variables in infertile men[J].Andrologia,2014,46 (6):618-624.
[4]Carreau S,Lambard S,Delalande C,et al.Aromatase expression and role of estrogens in male gonad:a review [J].Reprod Biol Endocrinol,2003,11(1):35.
[5]Delbès G,Levacher C,Duquenne C,et al.Endogenous estrogens inhibit mouse fetal Leydig cell development via estrogen receptor α[J].Endocrinology,2005,146 (5):2454-2461.
[6]Gould ML,Hurst PR,Nicholson HD.The effects of oestrogen receptors α and β on testicular cell number and steroidogenesis in mice[J].Reproduction,2007,134(2):271-279.
[7]王刚,谷守义,陈康宁,等.精子发生阻滞不育患者睾丸雌激素受体α的表达 [J].中华男科学杂志,2011,17(1):27-31.
[8]Gennari L,Merlotti D,De Paola V,et al.Estrogen receptor gene polymorphisms and the genetics of osteoporosis:a huge review[J].Am J Epidemiol,2005,161 (4):307-320.
[9]Higgins JP,Thompson SG,Deeks JJ,et al.Measuring inconsistency in meta-analyses[J].BMJ,2003,327 (7414):557-560.
[10]Midgette AS,Wong JB,Beshansky JR,et al.Cost-effectiveness of streptokinase for acute myocardial infarction a combined meta-analysis and decision analysis of the effects of infarct location and of likelihood of infarction[J].Med Decis Making,1994,14(2):108-117.
[11]Egger M,Smith GD,Schneider M,et al.Bias in metaanalysis detected by a simple,graphical test[J].BMJ,1997,315(7109):629-634.
[12]Meng J,Mu X,Wang YM.Influence of the XbaⅠpolymorphism in the estrogen receptor-α gene on human spermatogenic defects[J].Genet Mol Res,2013,12 (2):1808-1815.
[13]Bianco B,Peluso C,Gava MM,et al.Polymorphisms of estrogen receptors α and β in idiopathic,infertile Brazilian men:a case control study[J].Mol Reprod Dev,2011,78(9):665-672.
[14]Safarinejad MR,Shafiei N,Safarinejad S.Association of polymorphisms in the estrogen receptors α,and β (ESR1,ESR2)with the occurrence of male infertility and semen parameters[J].J Steroid Biochem Mol Biol,2010,122(4):193-203.
[15]Lazaros LA,Xita NV,Kaponis AI,et al.Estrogen receptor α and β polymorphisms are associated with semen quality[J].J Androl,2010,31(3):291-298.
[16]Kukuvitis A,Georgiou I,Bouba I,et al.Association of oestrogen receptor α polymorphisms and androgen receptor CAG trinucleotide repeats with male infertility:a study in 109 Greek infertile men[J].Int J Androl,2002,25(3):149-152.
[17]陈秋生,洪新如,宋岩峰.芳香化酶、雌激素与雄性生殖[J].中国男科学杂志,2008,22(7):55-57.
[18]Carreau S,Delalande C,Silandre D,et al.Aromatase and estrogen receptors in male reproduction[J].Mol Cell Endocrinol,2006,246(1/2):65-68.
[19]Mattingly KA,Ivanova MM,Riggs KA,et al.Estradiol stimulates transcription of nuclear respiratory factor-1 and increases mitochondrial biogenesis[J].Mol Endocrinol,2008,22(3):609-622.
[20]Försti A,Zhao C,Israelsson E,et al.Polymorphisms in the estrogen receptor β gene and risk of breast cancer: no association[J].Breast Cancer Res Treat,2003,79 (3):409-413.
[21]Kinoshita Y,Chen S.Induction of aromatase(CYP19)expression in breast cancer cells through a nongenomic action of estrogen receptor α[J].Cancer Res,2003,63 (13):3546-3555.
[22]Carreau S,Bouraima-Lelong H,Delalande C.Estrogen,a female hormone involved in spermatogenesis[J].Adv Med Sci,2012,57(1):31-36.
[23]Pavlovich CP,King P,Goldstein M,et al.Evidence of a treatable endocrinopathy in infertile men[J].J Urol,2001,165(3):837-841.
Meta analysis the association of polymorphisms in estrogen receptor α with male infertility
LI Tian-fu1,ZHOU Qing1,ZHANG Cui2,JIANG Wei-jun2,WU Qiu-yue2,LI Wei-wei2,XU Hao-qin3,XIA Xin-yi1,2
(1.Institute of Life Sciences,Jiangsu University,Zhenjiang Jiangsu 212013;2.PLA Research Institute of Clinical Laboratory Medicine,
Nanjing General Hospital of Nanjing Military Region,Nanjing Jiangsu 210002;3.Jiangsu Province Research Institute of Planned Parent
hood,Nanjing Jiangsu 210029,China)
R698.2
A
1671-7783(2015)01-0057-05
10.13312/j.issn.1671-7783.y140285
江苏省科技专项基金资助项目(BM2013058)
李天赋(1986—),男,硕士研究生;夏欣一(通讯作者),博士,副主任医师,副教授,E-mail:xiaxy@gmail.com;许豪勤(通讯作者),E-mail:1325825613@qq.com
2014-11-04 [编辑]何承志
