同源重组相关蛋白XRCC3对食管鳞癌细胞放疗敏感性的影响及其分子机制研究*
2015-09-08郭艺航曾宪亮王欢欢吴志强孟茂斌袁智勇
钱 东 郭艺航 曾宪亮 王欢欢 吴志强 孟茂斌 王 平 袁智勇
·基础研究·
同源重组相关蛋白XRCC3对食管鳞癌细胞放疗敏感性的影响及其分子机制研究*
钱东郭艺航曾宪亮王欢欢吴志强孟茂斌王平袁智勇
目的:探讨同源重组相关蛋白XRCC3对食管鳞癌(esophageal squmaous cell carcinoma,ESCC)细胞放疗敏感性的影响及其潜在的分子机制。方法:利用免疫印迹(Western blot),逆转录聚合酶链式反应(reverse transcription PCR,RT-PCR)及免疫组织化学(immunohistochemistry,IHC)分别检测食管鳞癌细胞以及患者石蜡封存组织标本中XRCC3的表达;利用慢病毒感染的方式构建稳定沉默XRCC3表达的食管鳞癌细胞株;运用流式细胞仪通过Annexin V-PI双染检测细胞凋亡;免疫荧光染色法检测细胞DNA损伤以及端粒损伤水平的变化。结果:与正常食管鳞状上皮细胞或组织相比,XRCC3在食管鳞癌细胞及组织中呈高表达;流式及相关实验揭示沉默XRCC3的表达会增加食管鳞癌细胞在放疗的作用下DNA损伤以及端粒损伤的发生并提高了细胞凋亡的发生比例。结论:XRCC3通过保护端粒的稳定减少了电离辐射所致的细胞DNA损伤以及细胞凋亡,最终导致食管鳞癌细胞对放疗的相对抵抗,靶向XRCC3可能成为提高食管鳞癌细胞放疗敏感性的有效策略。
食管鳞癌XRCC3放疗凋亡端粒稳定
Correspondence to:Zhiyong YUAN;E-mail:zhiyong0524@163.com
Department of Radiotherapy,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin,300060,China
This work was supported by the National Natural Science Foundation of China(No.81401948)
食管鳞癌是中国食管癌的主要发病类型,5年生存率不超过30%[1]。大多数食管鳞癌患者在确诊时就处于疾病的进展期,放疗联合化疗成为患者的常规治疗手段[2]。然而食管鳞癌患者对放化疗的整体反应性较差,同时也缺乏能够预测放化疗反应性的相关分子。就目前而言,食管鳞癌的放化疗初治完全缓解率及其TNM临床分期是仅有的被广泛接受的评价其预后的相关因素[3],所以,寻找可以预测患者放化疗效果及其预后的可靠分子标志物对改善临床治疗效果就显得十分必要。XRCC3(X-ray repair complementing defective repair in Chinese hamster cells 3),作为Rad51旁系同源家族基因的重要一员,参与了哺乳动物细胞双链DNA损伤的同源重组修复[4],此外,XRCC3参与的同源重组(homologous recombination,HR)过程对于维持细胞端粒的动态平衡十分关键[5]。本研究前期发现端粒结合蛋白PinX1可以调控XRCC3表达并影响食管鳞癌细胞的放疗敏感性[6],但二者之间的因果关系并不明确,XRCC3对食管鳞癌细胞放疗敏感性的影响也无相关报道。本研究旨在探索XRCC3对食管鳞癌细胞放疗敏感性的影响及其潜在分子机制。
1 材料与方法
1.1材料
从天津医科大学肿瘤医院收集的20例食管鳞癌和正常食管鳞状上皮组织均通过食管镜镜检获取并经过病理学确诊。
食管鳞癌细胞系KYSE30,KYSE150,KYSE410,KYSE510及原代培养食管鳞状上皮细胞为谢丹教授(中山大学,华南肿瘤学国家重点实验室)实验室惠赠,另外一株食管鳞癌细胞系TE-1购自中科院上海生命科学研究院细胞资源中心。
流式凋亡检测抗体购自美国Invitrogen公司,XRCC3兔多抗购买于英国Abcame公司,Phospho-Histone H2AX兔多抗购买于美国Cell Signaling Technology公司,TRF1鼠单抗购买于美国GeneTex公司。GAPDH鼠单抗、辣根过氧化物酶标记的山羊抗鼠二抗、山羊抗兔二抗购美国自SANTA CRUZ公司。1.2方法
1.2.1细胞培养人食管癌细胞株KYSE30、KYSE150、KYSE410、KYSE510采用含10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素的RPMI 1640培养液;人食管癌细胞株TE-1采用含10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素的DMEM培养液;培养条件是37℃,5%CO2的湿化培养箱(Galaxy CO2细胞培养孵育箱)。待细胞密度达80%~90%后,无菌条件下用0.25%的胰酶消化传代或按要求收集细胞完成相关实验。
1.2.2免疫组织化学染色常规石蜡包埋组织,4 μm厚连续切片后脱蜡,梯度酒精水化后进行抗原修复,自然冷却至室温。加3%H2O2室温孵育5~10 min,PBS冲洗。滴加正常山羊血清封闭非特异性抗原后,加一抗,4℃孵育过夜,PBS冲洗。滴加二抗37℃反应15 min,PBS冲洗。DAB显色。苏木素轻度复染,脱水、透明、封片。免疫组织化学阳性结果判断标准:根据阳性染色细胞的染色强度分为3个等级,分别为1、2、3分,根据阳性细胞占细胞总数的比例分为4个等级:0~25%(1分)、25%~50%(2分)、50%~75%(3分)、75%~100%(4分)。将二者的分数相乘的结果即组织的总分(0、1、2、3、4、6、8、9、12),当评分≥6分时,即认为XRCC3为高表达,当评分<6分时,即认为XRCC3为低表达。病理结果有两位病理学医生在不知病例资料的情况下,独立进行阅片,当出现分歧时,由两位专家将不同的判断结果进行重新评估,直到两位专家得到一致的意见。
1.2.3Western blot检测通过试剂盒提取细胞总蛋白,蛋白质定量、分离后PVDF膜上免疫杂交,洗涤后将滤膜与标记的抗免疫球蛋白一抗及二抗分别孵育后,利用发光法检测相关蛋白表达。
1.2.4反 转 录 PCR(reverse transcription PCR,RT-PCR)引物设计:XRCC3-F 5'AACCCGCGGGAGAGTCCCCA 3' XRCC3-R 5'AAAGCCTGTGGGAGGCCCGA 3' GAPDH-F 5'GTTCGACAGTCAGCCGCATCT 3' GAPDH-R 5'CCTGCAAATGAGCCCCAGCCT 3'
收集细胞,提取总RNA,按逆转录试剂盒说明方法逆转录生成cDNA,用上述特异的引物扩增,反应条件:50℃ 2 min,95℃ 10 min预变性,95℃ 15 s,60℃1 min,72℃30 s,35个循环,反应结束后琼脂糖电泳,紫外激发后观察和拍照。
1.2.5平板克隆实验细胞分别接种于6孔板中培养10~21天;当6孔细胞培养板中出现肉眼可观察到的细胞克隆时,弃掉培养基,4%多聚甲醛溶液固定10 min;Gimsa液染色后倒置显微镜下计数各孔细胞总数≥50个的集落数。
1.2.6流式细胞仪Annexin-V/PI双标记法检测细胞凋亡准备细胞并调整待检测细胞浓度为106个/mL,加入Annexin-V-FITC及PI。利用流式细胞仪488 nm激发波长测定Annexin V荧光,620 nm带通滤片检测PI荧光。每样本收集多于10 000个荧光信号。结果判定:以AnnexinV为横轴,PI为纵轴;左上象限分布的为机械性损伤细胞;右上象限分布的为晚期凋亡细胞或者坏死细胞;左下象限分布的为阴性正常细胞;右下象限分布的为早期凋亡细胞。
1.2.7免疫荧光检测端粒末端损伤在6孔板或十二孔板中爬玻璃片接种细胞,根据实验设计来分组。4%多聚甲醛室温固定后加入1%Triton-X100通透细胞;10%正常山羊血清封闭后加一抗TRF1和γ H2AX双染;荧光二抗染色后,DAPI染核。封片,然后共聚焦显微镜下观察并拍照。TIF阳性细胞的计算:TRF1和γH2AX共定位的点代表端粒功能障碍诱导的损伤灶(telomere dysfunction induced foci,TIF)。至少数400个细胞,每个细胞多于5个TRF1和γ H2AX共定位的点认为是TIF阳性的细胞[7]。
1.3统计学分析
实验所得数据采用SPSS 17.0统计学软件处理,数据以x±s表示,多组间均数比较采用单因素方差分析,P<0.05定义为有统计学意义。
2 结果
2.1XRCC3在食管鳞癌细胞和食管鳞癌组织中呈高表达
RT-PCR以及免疫印迹实验结果显示,与正常食管黏膜上皮细胞比较,无论是在mRNA水平(图1A)还是在蛋白水平(图1B),XRCC3在5株食管鳞癌细胞系中均呈高表达。通过免疫组织化学检测(图1C,D),XRCC3在20例食管鳞癌组织中有14例呈高表达,占总数的70%;而在20例正常食管黏膜组织中,只有5例高表达,占总数的25%,二者之间存在统计学显著性差异(图1E,P<0.01)。
2.2干扰XRCC3的表达促进食管鳞癌细胞在放疗作用下凋亡的发生
选择两株食管鳞癌细胞系KYSE 30和TE-1,利用慢病毒感染的方式构建干扰XRCC3表达以及空白对照的稳定细胞系(KYSE 30-shXRCC3,KYSE 30-Control,TE-1-shXRCC3,TE-1-Control,图2A),平板克隆实验结果显示:干扰XRCC3的表达并不会影响细胞的克隆形成能力(图2B)。凋亡是电离辐射所致细胞死亡的主要方式,流式凋亡检测的结果显示,下调XRCC3的表达会促进KYSE 30以及TE-1在放疗的作用下发生凋亡(图2C)。提示下调XRCC3的表达会增加食管鳞癌细胞的放疗敏感性。
2.3干扰XRCC3的表达对食管鳞癌细胞凋亡通路及同源重组通路相关蛋白的影响
进一步检测了反映细胞凋亡通路的常见蛋白PARP及Caspase-3的变化,结果显示,沉默XRCC3的表达会导致放疗作用下TE-1和Kyse 30细胞中剪切体 PARP(Cleaved-PARP)和 剪 接 体 Caspase-3 (Cleaved-Caspase-3)表达的增加(图3A)。同时,Western blot的结果提示,干扰XRCC3的表达会引起同源重组修复相关蛋白XRCC2和Rad51C表达的下调,而其他的相关基因并无变化(图3B)。
2.4干扰XRCC3的表达促进食管鳞癌细胞在放疗作用下DNA损伤及端粒损伤的发生
r-H2AX会在DNA发生损伤时迅速磷酸化并定位于DNA损伤位点,其被用作DNA损伤的指示标志物而广泛应用于DNA损伤修复的研究当中。通过免疫荧光的检测,发现干扰XRCC3的表达会导致食管鳞癌细胞在放疗的作用下磷酸化的r-H2AX染色出现非常明显的增加(图4A,B)。进一步通过检测端粒结合蛋白TRF1与磷酸化r-H2AX的共定位来显示端粒末端的损伤(TIF,telomere dysfunction induced foci),结果显示,下调XRCC3的表达增加了食管鳞癌细胞在放疗的作用下端粒末端损伤的发生(图4A,C)
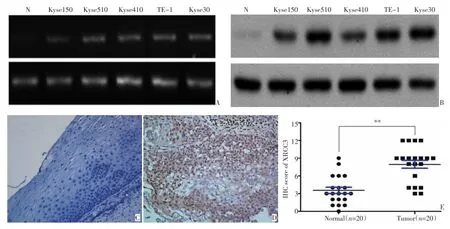
图1 XRCC3在食管鳞癌细胞和食管鳞癌组织中的表达水平(H&E×200)Figure 1 Expression of XRCC3 in ESCC cell lines and tissues(H&E×200)
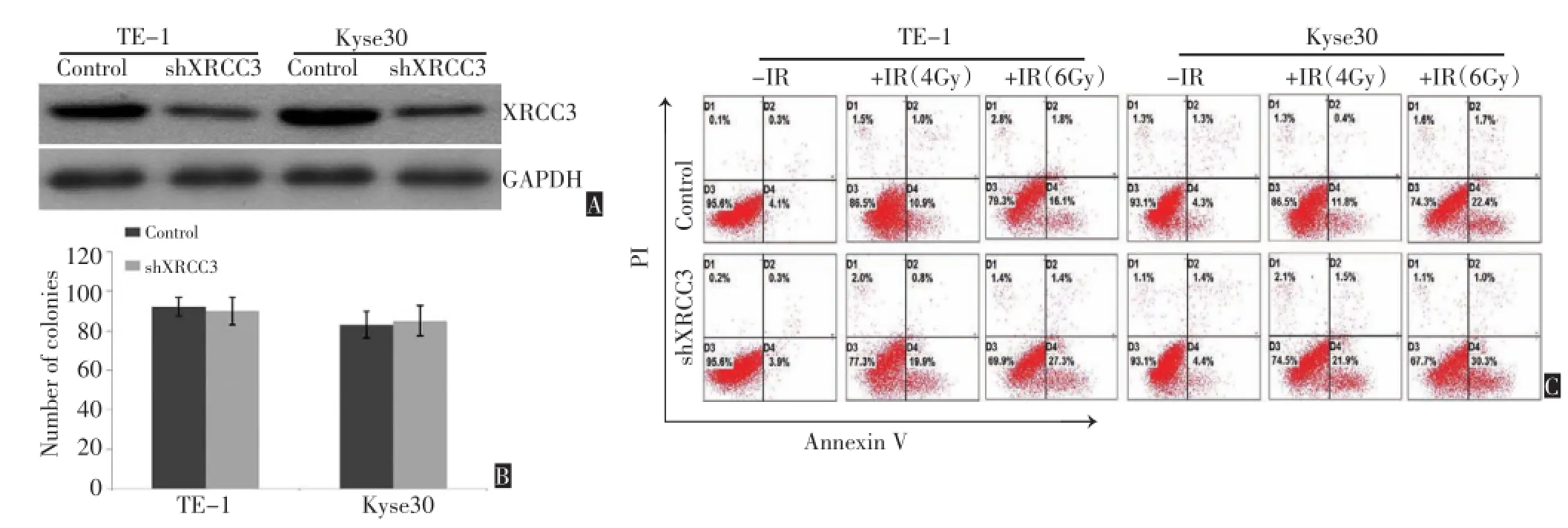
图2 沉默XRCC3的表达对放疗所致食管鳞癌细胞凋亡的影响Figure 2 Silencing of XRCC3 promoted ionizing radiation-induced apoptosis in ESCC cells
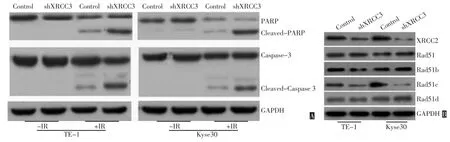
图3 沉默XRCC3的表达对放疗作用下食管鳞癌细胞凋亡相关蛋白及同源重组通路相关蛋白表达的影响Figure 3 Silencing of XRCC3 promoted ionizing radiation-induced cleavage of PARP and caspase-3,as well as inhibited the expression of XRCC2 and Rad51c
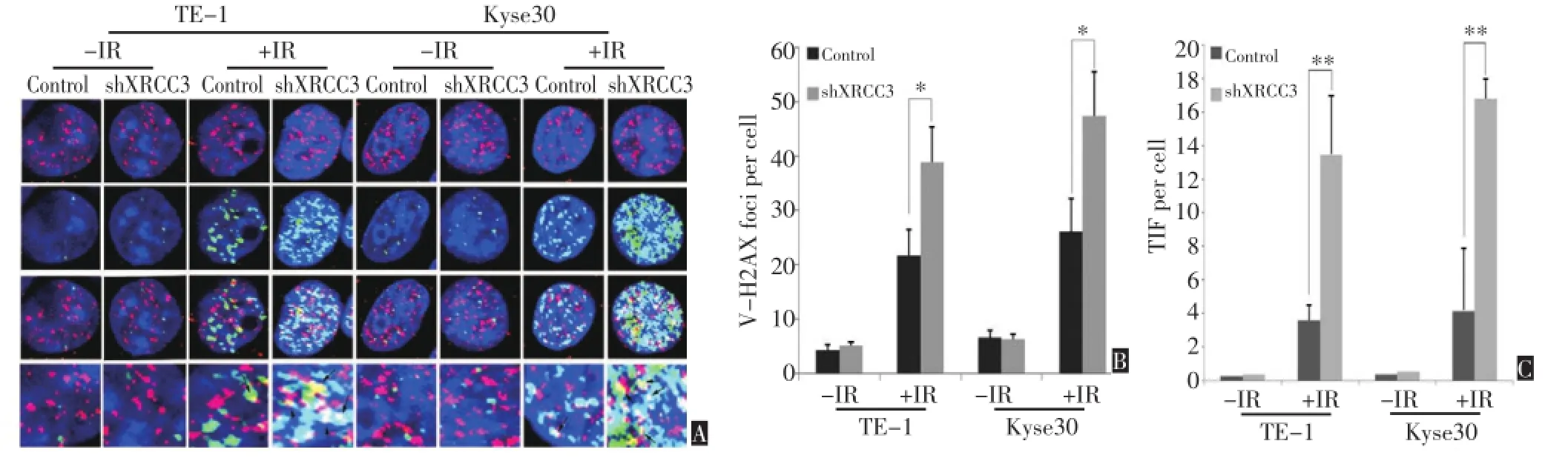
图4 干扰XRCC3的表达对食管鳞癌细胞在放疗作用下DNA损伤及端粒损伤的影响(×1 000)Figure 4 Silencing of XRCC3 promoted ionizing radiation-induced DNA damage and telomere dysfunction in both Kyse30 and TE-1 cells(×1000)
3 讨论
对于食管鳞癌患者而言,无论是根治性治疗还是姑息治疗,放疗都扮演重要的甚至是核心的作用[7-9]。随着分子肿瘤学的飞速发展,从分子水平来改变肿瘤细胞治疗反应的结果成为趋势。但是,关于与患者放疗敏感性相关的肿瘤分子遗传学的研究却十分有限。寻找到更多更精确的可以预测以及调控肿瘤放疗反应的分子标志物(molecular biomarkers),无论对于食管鳞癌还是其他需要接受放疗的肿瘤都具有重要意义,也任重而道远。
XRCC3作为同源重组相关基因家族成员之一,参与了双链DNA损伤修复的过程。本研究显示,无论是在食管鳞癌细胞还是组织中,XRCC3都呈高表达,而在食管鳞癌细胞中干扰XRCC3的表达会增加细胞对放疗的敏感性。起源于严重的无法完全修复的DNA损伤或者说基因组的破坏和不稳定的凋亡被认为是大多数实体肿瘤放射致死的主要机制[10]。本研究的结果显示,在食管鳞癌细胞中干扰XRCC3的表达显著增加了放疗作用下细胞凋亡的发生,凋亡通路蛋白PARP及Caspase-3的激活也明显增加。这提示食管鳞癌细胞中XRCC3的高表达可能通过抑制电离辐射作用下细胞凋亡通路的激活从而阻止细胞凋亡的发生,最终导致细胞对放疗的相对抵抗。本结果显示,干扰XRCC3的表达还可以导致其他同源重组相关基因(XRCC2,Rad51c)蛋白水平的下调。表明XRCC3关系着整个细胞同源重组修复通路的稳定,这与先前的报道一致[11-12]。
电离辐射导致细胞凋亡的最主要原因是其直接损伤细胞的DNA,本研究明确显示,在食管鳞癌细胞中干扰XRCC3的表达会导致细胞在放疗的作用下DNA损伤明显增加。电离辐射会导致细胞DNA多种类型的损伤,包括DNA单链损伤,DNA双链损伤等,在多种损伤类型当中,DNA双链损伤(DSB)被认为是最严重、最难修复的一种,一旦DSB没有被修复,会导致细胞在下一个分裂周期或多个分裂周期后发生凋亡和死亡。当这种损伤被错误地修复后,细胞染色体发生异常和不稳定而最终可能引发细胞的恶性转化,与肿瘤的发生密切相关[13]。对于DNA双链损伤,细胞通过多种机制进行修复,最常见的是非同源末端连接(nonhomologous end joining,NHEJ)修复和同源重组修复(homologous recombination repair,HRR[14]。以往的研究表明非同源末端连接(nonhomologous end joining,NHEJ)修复在电离辐射所致的双链DNA损伤中扮演着重要的角色,同源重组(Homologous recombination,HR)只起着次要的作用[15-17]。但是,有研究提示同源重组除了参与DNA损伤修复以外,还有一个作用就是参与细胞端粒D-Loop环的形成,对于端粒的稳定与否至关重要[5]。端粒功能障碍会导致异常的染色体末端融合,而这种异常的融合会引发基因组的不稳定,端粒稳定性是维持几乎所有的肿瘤细胞正常生长增殖所必须的。许多研究都表明端粒稳定性的破坏可以使得肿瘤细胞对化疗药物和电离辐射更加敏感[18-19]。进一步研究结果也正好提示了这一点,发现干扰XRCC3的表达增加了食管鳞癌细胞在放疗的作用下端粒末端损伤。XRCC3表达的下调可能通过损伤了细胞同源重组能力而导致肿瘤细胞端粒的失保护,影响了细胞对电离辐射的敏感性。
综上所述,本研究发现XRCC3在食管鳞癌细胞中呈高表达,而干扰XRCC3的表达会导致细胞在电离辐射的作用下端粒不稳定性及DNA损伤的增加,其结局是放疗后细胞凋亡的增加,最终增强了细胞的放疗敏感性。因此,靶向XRCC3及其参与的同源重组通路将可能成为提高食管鳞癌患者放射增敏的有效策略。
1 Pennathur A,Gibson MK,Jobe BA,et al.Oesophageal carcinoma [J].Lancet,2013,381(9864):400-412.
2 Lloyd S,Chang BW.Current strategies in chemoradiation for esophageal cancer[J].J Gastrointest Oncol,2014,5(3):156-165.
3 Napier KJ,Scheerer M,Misra S.Esophageal cancer:A Review of epidemiology,pathogenesis,staging workup and treatment modalities[J].World J Gastrointest Oncol,2014,6(5):112-120.
4 Pierce AJ,Johnson RD,Thompson LH,et al.XRCC3 promotes homology-directed repair of DNA damage in mammalian cells[J]. Genes Dev,1999,13(20):2633-2638.
5 Wang RC,Smogorzewska A,de Lange T.Homologous recombination generates T-loop-sized deletions at human telomeres[J].Cell,2004,119(3):355-368.
6 Qian D,Zhang B,He LR,et al.The telomere/telomerase binding factor PinX1 is a new target to improve the radiotherapy effect of oesophageal squamous cell carcinomas[J].J Pathol,2013,229(5):765-774.
7 Takai H,Smogorzewska A,de Lange T.DNA damage foci at dysfunctional telomeres[J].Curr Biol,2003,13(17):1549-1556.
8 Li B,Zhang WC,Zhao LJ,et al.Therapeutic strategy to prevent the recurrence of esophageal carcinoma after radical resection[J]. Chinese Journal of Clinical Oncology,2013,40(24):1553-1557.[李博,章文成,赵路军,等.食管癌根治术后复发的治疗策略[J].中国肿瘤临床,2013,40(24):1553-1557.]
9 Berger B,Belka C.Evidence-based radiation oncology:oesophagus [J].Radiother Oncol,2009,92(2):276-290.
10 Eriksson D,Stigbrand T.Radiation-induced cell death mechanisms [J].Tumour Biol,2010,31(4):363-372.
11 Lio YC,Schild D,Brenneman MA,et al.Human Rad51C deficiency destabilizes XRCC3,impairs recombination,and radiosensitizes S/G2-phase cells[J].J Biol Chem,2004,279(40):42313-42320.
12 Griffin CS,Simpson PJ,Wilson CR,et al.Mammalian recombination-repair genes XRCC2 and XRCC3 promote correct chromosome segregation[J].Nat Cell Biol,2000,2(10):757-761.
13 Curtin NJ.DNA repair dysregulation from cancer driver to therapeutic target[J].Nat Rev Cancer,2012,12(12):801-817.
14 Kakarougkas A,Jeggo PA.DNA DSB repair pathway choice:an orchestrated handover mechanism[J].Br J Radiol,2014,87(1035):20130685.
15 Wang C,Lees-Miller SP.Detection and repair of ionizing radiation-induced DNA double strand breaks:new developments in nonhomologous end joining[J].Int J Radiat Oncol Biol Phys,2013,86(3):440-449.
16 Chiruvella KK,Liang Z,Wilson TE.Repair of double-strand breaks by end joining[J].Cold Spring Harb Perspect Biol,2013,5 (5):a012757.
17 Rass E,Grabarz A,Bertrand P,et al.Double strand break repair,one mechanism can hide another:alternative non-homologous end joining[J].Cancer Radiother,2012,16(1):1-10.
18 Wong KK,Chang S,Weiler SR,et al.Telomere dysfunction impairs DNA repair and enhances sensitivity to ionizing radiation[J]. Nat Genet,2000,26(1):85-88.
19 Sabatino L,Picano E,Andreassi MG.Telomere shortening and ionizing radiation:a possible role in vascular dysfunction[J]?Int J Radiat Biol,2012,88(11):830-839.
(2014-09-10收稿)
(2014-12-13修回)
(本文编辑:周晓颖)

钱东专业方向为肿瘤的放射治疗。E-mail:qiankeyu1984@126.com
Effects and underlying mechanisms of homologous recombination-associated protein XRCC3 on esophageal squamous-cell carcinoma radiotherapy response
Dong QIAN,Yihang GUO,Xianliang ZENG,Huanhuan WANG,Zhiqiang WU,Maobin MENG,Ping WANG,Zhiyong YUAN
Objective:To investigate the effects and underlying mechanisms of XRCC3 on esophageal squamous-cell carcinoma (ESCC)radiotherapy response.Methods:Expression levels of XRCC3 were detected by reverse transcription PCR,Western blot,and immunohistochemistry.We knocked down XRCC3 with lentiviral infection in ESCC cells.Cell apoptosis was examined by flow cytometry.DNA damage and telomere dysfunction-induced foci were determined by immunofluorescence.Results:The expression levels of XRCC3 in ESCC cells and tissues were higher than those in normal esophageal epithelial cells and corresponding adjacent noncancerous esophageal tissues.Knockdown of XRCC3 in ESCC cells substantially increased the therapeutic efficacy of radiation.We demonstrated that the radiation resistance of XRCC3 was attributed to the XRCC3-maintaining telomere stability,which reduced ESCC cell death through radiation-induced apoptosis.Conclusion:Our data suggested that XRCC3 protects ESCC cells from ionizing radiation-induced DNA damage and death by enhancing telomere stability.Thus,XRCC3 can be used as a promising therapeutic target for ESCCs.
esophageal squamous-cell carcinoma,XRCC3,radiotherapy,apoptosis,telomere stability
10.3969/j.issn.1000-8179.20141557
天津医科大学肿瘤医院放射治疗科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060)*本文课题受国家自然科学基金青年科学基金项目(编号:81401948)资助
袁智勇zhiyong0524@163.com
