单纯Hyper-CVAD方案或联合自体造血干细胞移植一线治疗淋巴母细胞淋巴瘤的疗效分析*
2015-09-10史幼梧石远凯周生余杨建良何小慧张长弓杨韩晓红
史幼梧 石远凯 秦 燕 刘 鹏 桂 琳 周生余 杨建良 何小慧张长 弓杨 晟 韩晓红 孙 燕
·论著·
单纯Hyper-CVAD方案或联合自体造血干细胞移植一线治疗淋巴母细胞淋巴瘤的疗效分析*
史幼梧石远凯秦燕刘鹏桂琳周生余杨建良何小慧张长弓杨晟韩晓红孙燕
目的:探讨单纯Hyper-CVAD方案与Hyper-CVAD方案联合自体造血干细胞移植一线巩固治疗淋巴母细胞淋巴瘤(lymphoblastic lymphoma,LL)的疗效。方法:回顾性分析26例青少年和成人初治采用改良Hyper-CVAD方案的LL患者资料。其中,22例不伴骨髓受侵的患者中,11例接受单纯改良Hyper-CVAD方案治疗,另外11例接受改良Hyper-CVAD方案联合HDT/AHSCT巩固治疗。结果:全组61.5%(16/26)的患者初治达完全缓解(complete remission,CR)或不确定的CR(unconfirmed CR,CRu),中位随访29.5个月,5年的总生存(overall survival,OS)率和无进展生存(progress-free survival,PFS)率分别为66.8%和50.2%。22例无骨髓受侵的患者中,单纯Hyper-CVAD组与联合HDT/AHSCT组的5年OS率分别为60.0%和70.7%(P=0.438),5年PFS率分别为43.6%和62.3%(P=0.209),均无统计学差异。单因素预后分析结果显示,初治缓解后1年内疾病进展或复发与预后不良相关(P=0.012)。结论:改良Hyper-CVAD方案是青少年和成人LL一线有效的治疗方案。对于无骨髓侵犯的患者,单纯改良Hyper-CVAD已能取得较好疗效,联合HDT/AHSCT巩固治疗未能进一步改善预后。
淋巴母细胞淋巴瘤HyperCVAD方案高剂量治疗自体造血干细胞移植
淋巴母细胞淋巴瘤(lymphoblastic lymphoma,LL)是非霍奇金淋巴瘤(Non-Hodgkin's lymphoma,NHL)的一种少见亚型,在成人中约占NHL的2%[1]。LL是前体B或T淋巴母细胞来源的恶性肿瘤,其中B细胞来源仅占约10%,其余均为T细胞来源[2]。在世界卫生组织(World Health Organization,WHO)有关NHL的疾病分类中,LL与急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)被归为一类,称前驱淋巴性肿瘤,并定义骨髓中幼稚淋巴细胞比例≥25%为ALL,<25%为LL[2]。LL的生物学行为呈高度侵袭性,细胞增殖快,既往以CHOP方案(环磷酰胺+阿霉素+长春新碱+强的松)为主的传统NHL化疗方案的疗效并不理想[3-4]。近年来,应用高剂量强度的ALL样化疗方案使LL的疗效显著改善[5-6]。Thomas等[7]应用Hyper-CVAD方案(环磷酰胺+长春新碱+阿霉素+地塞米松(A方案),大剂量甲氨蝶呤+阿糖胞苷(B方案))治疗成人LL患者,3年总生存(overall survival,OS)率和无进展生存(progress-free survival,PFS)率分别达70%和66%。由于LL的高度侵袭性,一线治疗后完全缓解(complete remission,CR)率高,而CR后的复发率亦较高,因此,临床上探索应用高剂量治疗联合自体造血干细胞移植(high-dose therapy followed by autologous hematopoietic stem cell transplantation,HDT/AHSCT)作为化疗缓解后的巩固治疗。现将本院应用改良Hyper-CVAD方案联合HDT/AHSCT一线治疗LL的病历资料进行回顾分析,并与同期单纯应用改良Hyper-CVAD方案治疗的患者进行比较,以评价HDT/AHSCT对LL患者的临床价值。
1 材料与方法
1.1临床资料
2004年11月至2010年11月,中国医学科学院肿瘤医院采用改良Hyper-CVAD方案治疗初治LL患者26例。患者均经病理检查明确诊断(WHO标准),并至少完成3周期治疗,具有完整的治疗和随诊记录。26例患者中,男性21例,女性5例;年龄12~41岁,中位年龄19岁,临床特征见表1。
1.2方法
1.2.1初治方案26例患者初治均采用改良Hyper-CVAD方案。包括A方案:环磷酰胺(cyclophosphamide,CTX)300 mg/m2,持续静脉滴注2 h以上,每12 h 1次,第1至第3天;长春新碱(vincristine,VCR)2 mg,静脉推注,第4、11天;表柔比星(epirubicin,EPI)80 mg/m2,持续静脉滴注24 h以上,第4天;地塞米松(dexamethasone,DXM)40 mg,口服或静脉滴注,第1至第4天及第11至第14天。B方案:甲氨蝶呤(methotrexate,MTX)1 g/m2,持续24 h静脉滴注,第1天;阿糖胞苷(cytarabine,Ara-C)1 g/m2,静脉滴注,每12 h 1次,第2、3天。每例患者接受了3~8个周期化疗,平均5个周期。所有患者均未接受维持治疗。
对于诊断时无中枢神经系统(central nervous system,CNS)受侵的患者进行CNS预防性治疗,MTX 10 mg+DXM 5 mg,或Ara-C 50 mg+DXM 5 mg,鞘内注射,共6~8次。对于诊断时已有CNS受侵的患者,上述方案每周1次鞘内注射,至脑脊液检查恢复正常后,再进行2~4次鞘内注射。
1.2.2巩固治疗方案11例初治缓解的患者接受了HDT/AHSCT巩固治疗。预处理方案包括:BEAC方案(卡氮芥+足叶乙甙+阿糖胞苷+环磷酰胺)10例(90.9%)和BEAM-R方案(卡氮芥+足叶乙甙+阿糖胞苷+美法仑+利妥昔单抗)1例(9.1%)。对于合并纵隔巨大肿物或化疗后未达CR的患者,予45~50 Gy的受累野局部放疗。
1.2.3疗效评估和随访依据国际工作组标准(International Workshop Criteria,IWC)进行疗效评估,分为CR、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)[8]。末次随访时间为2014年9月24日,中位随访时间29.5个月,观察终点为PFS和OS。OS定义为自诊断至任何原因死亡或末次随访的时间,PFS定义为自开始治疗至疾病进展或末次随访的时间。
1.3统计学分析
应用SPSS 20.0软件进行统计学分析。生存分析采用Kaplan-Meier法,组间生存率比较采用Log rank检验。组间均衡性采用秩和检验和卡方检验。显著性水平α=0.05。
2 结果
2.1初治疗效
26例患者中,16例(61.5%)达CR或不确定的CR (unconfirmed CR,CRu),10例(38.5%)达PR。达CR 或CRu的中位化疗周期数为5个。

表1 26例LL患者的临床特征Table 1 Clinical characteristics of 26 lymphoblastic lymphoma(LL)patients
2.2生存分析
全组26例患者中12例治疗后出现疾病进展,至末次随访时,7例死亡,19例生存,全组中位OS时间为29.5个月,中位PFS时间为16.5个月,5年的OS率为66.8%,5年的PFS率为50.2%。
在22例诊断时无骨髓受侵的患者中,11例接受单纯改良Hyper-CVAD方案治疗,另外11例接受改良Hyper-CVAD方案联合HDT/AHSCT巩固治疗,两组间患者临床特征分布均衡(表2),5年OS率分别为60.0%和70.7%(P=0.438,图1),5年PFS率分别为43.6%和62.3%(P=0.209,图2),差异均无统计学意义。
2.3预后影响因素分析
在22例无骨髓受侵的患者中,单因素分析结果显示,初治诱导缓解后1年内进展的患者预后差,而性别、免疫表型、B症状、乳酸脱氢酶(lactic dehydrogenase,LDH)升高、β2微球蛋白升高与LL患者预后无关,Ann Arbor分期影响患者的无进展生存,但对总生存无显著影响(表3)。

表2 组间均衡性Table 2 Interclass equilibration
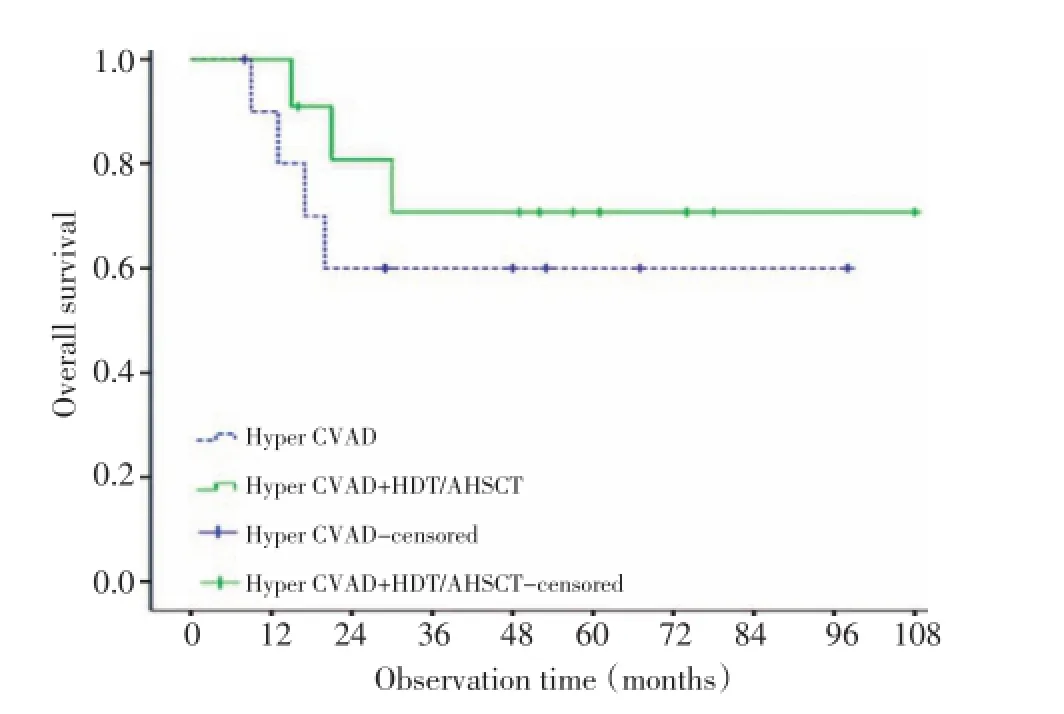
图1 单纯Hyper-CVAD组和Hyper-CVAD方案联合HDT/AHSCT巩固治疗组患者的总生存曲线Figure 1 Overall survival of patients treated with the Hyper-CVAD regimen alone and the Hyper-CVAD regimen combined with HDT/AHSCT
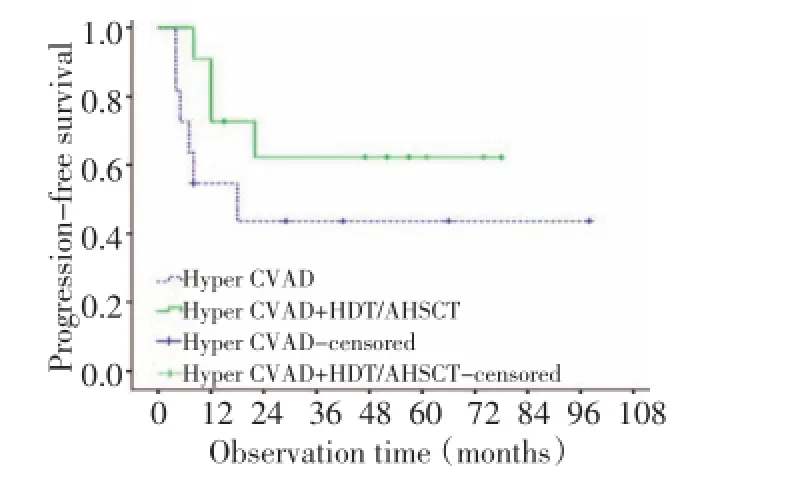
图2 单纯Hyper-CVAD组和Hyper-CVAD方案联合HDT/AHSCT巩固治疗组患者的无进展生存曲线Figure 2 Progression-free survival of patients treated with the Hyper-CVAD regimen alone and the Hyper-CVAD regimen combined with HDT/AHSCT
3 讨论
LL常见于青少年和年轻的成年男性,绝大多数为T细胞来源,诊断时大多可发现纵隔肿物,病程中骨髓和CNS受累常见[9]。本研究中26例LL患者的中位年龄为19岁,男性占80.7%,其中,88.5%的患者免疫表型为T细胞,有纵隔肿物者占80.8%,符合LL的流行病学和临床特点。
初始治疗对于LL至关重要,一旦疾病进展或复发,患者预后很差[10]。多种方案曾被尝试用于LL的一线治疗,由于传统CHOP样方案疗效不佳[3-4],目前常采用ALL样的强化治疗方案,治疗效果显著改善,患者长期生存提高到70%~84%[7,11]。2004年Thomas等报道了33例LL患者应用Hyper-CVAD方案并联合2年维持治疗和局部放疗可取得理想的治疗效果,全组完全缓解率达91%,长期生存率达70%,但该方案治疗相关不良反应较为严重[7]。因此,中国医学科学院肿瘤医院结合中国人体质耐受情况,对标准Hyper-CVAD方案进行改良,将B方案中Ara-C减量至1 g/m2进行探索,研究结果显示,改良Hyper-CVAD方案一线治疗LL的有效率为100%,且毒性反应在可接受范围内[12]。本研究中26例LL患者均采用上述改良Hyper-CVAD方案,客观缓解率为100%,CR率为61.5%,远期疗效与文献报道相仿[7]。
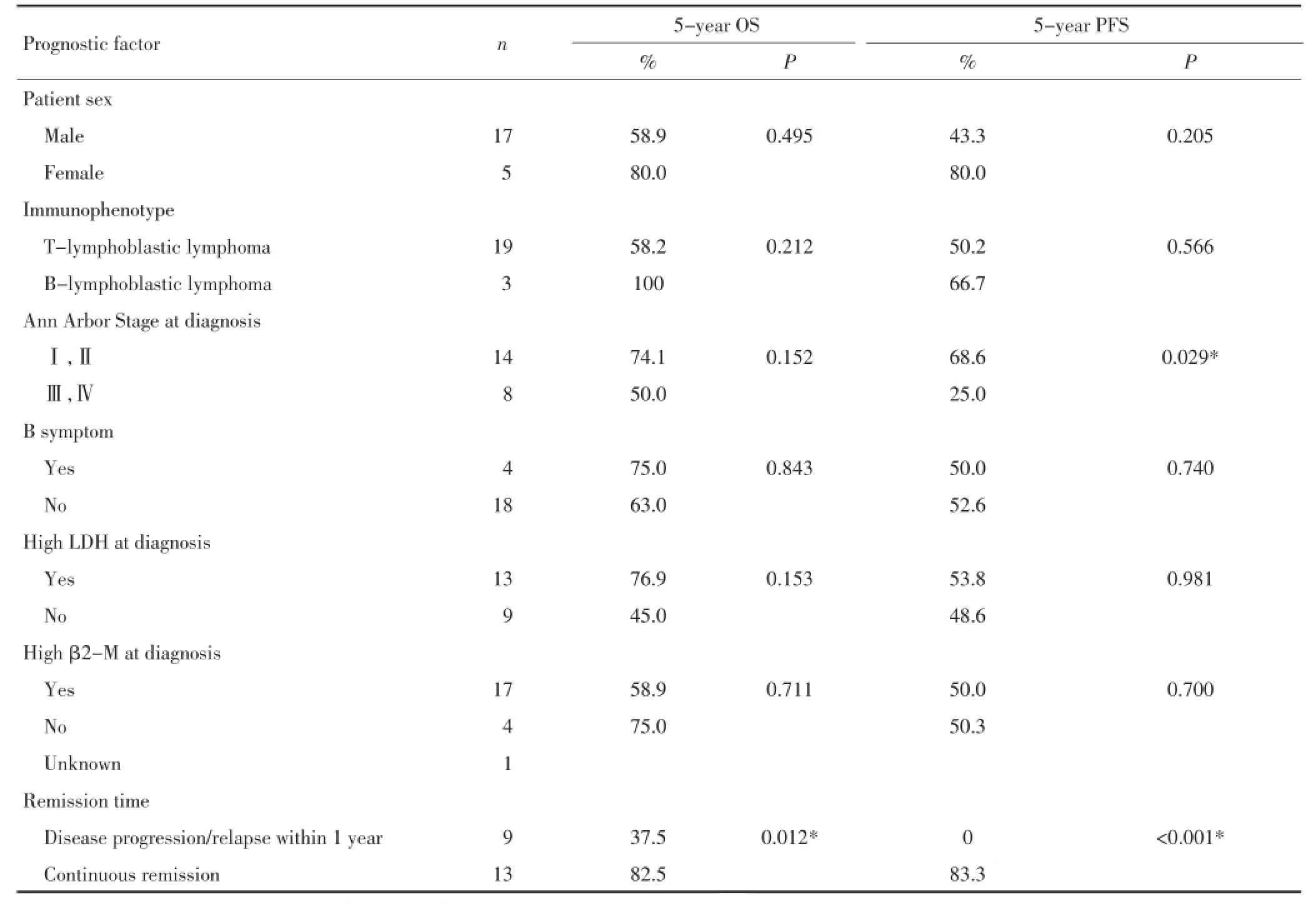
表3 预后影响因素的单因素分析(22例无骨髓受侵的LL患者)Table 3 Univariate analysis of predictive factors influencing survival(22 LL patients without bone marrow involvement)
由于LL具有高缓解率和高复发率的临床特点,自体或异基因造血干细胞移植支持下的高剂量巩固化疗成为国内外研究者进行探索的治疗选择。然而,由于LL发病率低难以开展大样本随机对照研究,同时回顾性研究中存在病例选择偏倚导致HDT/AHSCT在初治LL治疗中的地位难以得到确切评估。Song等[13]报道了一项意向性(intent-to-treat)分析研究,34例LL患者经NHL/ALL混杂方案诱导缓解后,29例接受移植巩固治疗(4例异基因和25例自体移植),移植后4年OS率和无事件生存(event-free survival,EFS)率分别可达79%和73%。另一项前瞻性随机对照研究比较了ALL样方案一线治疗达完全缓解后接受HDT/AHSCT巩固治疗和常规维持治疗的结果。中位随访37个月时,移植组和常规维持治疗组3年的无病生存(disease-free survival,DFS)率分别为55%和24%,OS率分别为56%和45%,差异均无统计学意义。然而,值得注意的是,该研究中HDT/AHSCT巩固治疗可以减少45%的疾病复发风险,同时,以HDT/AHSCT代替2年的维持治疗可以缩短治疗时间,改善患者的生存质量[14]。
骨髓受侵是LL常见的的预后不良因素之一[4,13],本研究在不伴骨髓受侵的两组LL患者中比较单纯Hyper-CVAD方案与Hyper-CVAD方案联合HDT/ AHSCT巩固治疗的远期疗效,两组组间可能与预后相关的各项临床特征分布均匀。研究结果显示,两组5年OS和PFS均无显著差异,即对于不伴骨髓受侵的LL患者而言,高剂量强度的单纯ALL样化疗方案已能取得较好的疗效,HDT/AHSCT巩固治疗未能进一步改善远期生存。因此,有研究指出应选择具有预后不良高危特征的初治LL患者接受HDT/AHSCT巩固治疗[15]。骨髓微小残留病灶(minimal residual disease,MRD)可用于预测LL患者的复发风险,并据此制定个体化的治疗策略。该研究中,MRD阴性的患者接受常规维持治疗,MRD阳性的患者接受移植巩固治疗或常规维持治疗,结果显示:MRD阴性的患者预后优于MRD阳性的患者,而在MRD阳性的患者中,移植巩固治疗的疗效优于常规维持治疗。该研究表明监测骨髓MRD有助于早期识别预后不良的LL患者,在诱导缓解后予以造血干细胞移植支持下的更强的巩固化疗,有助于降低复发风险,改善患者生存[15]。
在成人LL,一些临床特征可能提示预后不良,包括:年龄、性别、疾病分期、B症状、CNS或骨髓受侵、LDH升高等,但目前尚没有明确的预后因素在成人LL的大宗病例研究中得到证实。一项基于人群的针对成人LL的治疗预后分析研究显示,在经过年龄调整和治疗方案调整后,女性患者的预后差于男性(HR 4.29,P=0.002),同时,诊断时CNS受累是治疗后疾病进展的风险因素(HR 13.3,P=0.03)[10]。另一项研究评估了接受ALL样方案治疗的青少年和成人LL患者的预后,其中年龄大于35岁是唯一预后不良因素[16]。本研究中,预后影响因素的单因素分析显示,初治缓解后1年内疾病进展或复发是预后不良的唯一显著相关因素。此外,与既往报道一致[15],免疫表型为T来源和Ann Arbor分期为Ⅲ、Ⅳ期可能与预后不良有关,但在本研究中由于样本量较小,未显示出统计学意义。
综上所述,改良Hyper-CVAD方案是青少年和成人LL一线有效的治疗方案。对于无骨髓侵犯的患者,单纯改良HyperCVAD已能取得较好疗效,联合HDT/AHSCT巩固移植未能进一步改善预后。初治缓解后1年内疾病进展或复发与预后不良相关,Ann Arbor分期为Ⅲ、Ⅳ期与治疗后进展/复发相关。
1 A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin's lymphoma.The Non-Hodgkin's Lymphoma Classification Project[J].Blood,1997,89(11):3909-3918.
2 Sabattini E,Bacci F,Sagramoso C,et al.WHO classification of tumours of haematopoietic and lymphoid tissues in 2008:an overview [J].Pathologica,2010,102(3):83-87.
3 Nathwani BN,Diamond LW,Winberg CD,et al.Lymphoblastic lymphoma:a clinicopathologic study of 95 patients[J].Cancer,1981,48(11):2347-2357.
4 Qin Y,Shi YK,He XH,et al.Comparison of the efficiency of CHOP-based regimen with or without high dose consolidation treatment combined with hematopoietic stem cell transplantation in 63 lymphoblastic lymphoma patients[J].Chinese Journal of Oncology,2009,31(6):469-473.[秦燕,石远凯,何小慧,等.单纯CHOP样方案与CHOP样方案联合造血干细胞移植巩固治疗淋巴母细胞淋巴瘤的疗效分析[J].中华肿瘤杂志,2009,31(6):469-473.]
5 Katz OB,Ben BA,Abrahami G,et al.Treatment of T cell lymphoblastic lymphoma in children and adolescents:Israel Society of Pediatric Hematology Oncology retrospective study[J].Isr Med Assoc J,2011,13(3):161-165.
6 Hoelzer D,Gokbuget N,Digel W,et al.Outcome of adult patients with T-lymphoblastic lymphoma treated according to protocols for acute lymphoblastic leukemia[J].Blood,2002,99(12):4379-4385.
7 Thomas DA,O'Brien S,Cortes J,et al.Outcome with the hyper-CVAD regimens in lymphoblastic lymphoma[J].Blood,2004,104(6):1624-1630.
8 Cheson BD,Horning SJ,Coiffier B,et al.Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas.NCI Sponsored International Working Group[J].J Clin Oncol,1999,17(4):1244.
9 Portell CA,Sweetenham JW.Adult lymphoblastic lymphoma[J]. Cancer J,2012,18(5):432-438.
10 Ellin F,Jerkeman M,Hagberg H,et al.Treatment outcome inT-cell lymphoblastic lymphoma in adults-a population-based study from the Swedish Lymphoma Registry[J].Acta Oncol,2014,53(7):927-934.
11 Bersvendsen H,Kolstad A,Blystad AK,et al.Multimodal treatment with ALL-like chemotherapy,Auto-SCT and radiotherapy for lymphoblastic lymphoma[J].Acta Oncol,2014,53(5):680-687.
12 Shi W,Shi YK,He XH,et al.A Clinical report on modified Hyper-CVAD regimen in patients with lymphobalstic lymphoma[J]. National Medical Journal of China,2010,90(14):978-981.[施薇,石远凯,何小慧,等.改良Hyper-CVAD方案治疗前体淋巴母细胞淋巴瘤患者的临床分析[J].中华医学杂志,2010,90(14):978-981.]
13 Song KW,Barnett MJ,Gascoyne RD,et al.Primary therapy for adults with T-cell lymphoblastic lymphoma with hematopoietic stem-cell transplantation results in favorable outcomes[J].Ann Oncol,2007,18(3):535-540.
14 Sweetenham JW,Santini G,Qian W,et al.High-dose therapy and autologous stem-cell transplantation versus conventional-dose consolidation/maintenance therapy as postremission therapy for adult patients with lymphoblastic lymphoma:results of a randomized trial of the European Group for Blood and Marrow Transplantation and the United Kingdom Lymphoma Group[J].J Clin Oncol,2001,19(11):2927-2936.
15 Cortelazzo S,Intermesoli T,Oldani E,et al.Results of a lymphoblastic leukemia-like chemotherapy program with risk-adapted mediastinal irradiation and stem cell transplantation for adult patients with lymphoblastic lymphoma[J].Ann Hematol,2012,91(1):73-82.
16 Pinheiro JE,Pracchia LF,Beitler DMB,et al.Prognostic Factors in Adolescent and Adult Patients With Acute Lymphoblastic Leukemia With Two Protocols of Chemotherapy:A Cross-Sectional Study[J].Clin Lymphoma Myeloma Leuk,2015,15(1):7-14.
(2014-10-30收稿)
(2014-12-30修回)
(编辑:杨红欣)

史幼梧专业方向为自体造血干细胞移植治疗恶性淋巴瘤的疗效及预后因素的研究。
E-mail:shilele413@163.com
Efficiency of the HyperCVAD regimen with or without high-dose therapy combined with autologous hematopoietic stem cell transplantation in lymphoblastic lymphoma
Youwu SHI,Yuankai SHI,Yan QIN,Peng LIU,Lin GUI,Shengyu ZHOU,Jianliang YANG,Xiaohui HE,Changgong ZHANG, Sheng YANG,Xiaohong HAN,Yan SUN
Correspondence to:Yuankai SHI;E-mail:syuankai@cicams.ac.cn
Department of Medical Oncology,Cancer Institute/Hospital of the Chinese Academy of Medical Science&Beijing Union Medical College,the National New Drug(Antineoplastic)Clinical Research Center;Beijing Key Laboratory of Antineoplastic Molecu lar Targeted Drug Clinical Research,Beijing 100021,China This work was supported by the National Medical Science and Technique Foundation during the"9th Five-Year Plan"(No.A20199610396-906-01-12);the Ministry of Health Special Fund for OutstandingYoung Scientific Talents(No.B121994002);the Initial Fund of Returned Students from Ministry of Personnel(No.B311994001);the Special Scientific Funds of the Ministry of Education for Doctorship-Conferring Unit of Higher Education Institutions(No.20010023018,20050023045,and B201995002);and the Fok Ying-Tung Education Foundation for the Young Teachers in the Institutions of Higher Learning(No.B231996001)
Objectives:This study evaluated the efficiency of HyperCVAD regimen with or without high-dose therapy(HDT) combined with autologous hematopoietic stem cell transplantation(AHSCT)in lymphoblastic lymphoma(LL).Methods:Data of 26 adolescent and adult LL patients were retrospectively analyzed.These patients were initially treated with the modified HyperCVAD regimen in a basic institution.Except 4 of the total 26 patients who suffered bone-marrow involvements,11 patients received consolidation treatment of HDT/AHSCT,and the other 11 did not.Results:Of the total patients,61.5%achieved complete remission(CR)or unconfirmed CR.With a median follow-up period of 29.5 months,the 5-year overall survival(OS)and progress-free survival(PFS)rates were 66.8%and 50.2%,respectively.Of the 22 patients without bone marrow involvement,the corresponding 5-year OS rates were 60.0%and 70.7%in the patients treated with the HyperCVAD regimen alone and in those who received HDT/AHSCT as consolidationtherapy(P=0.438),with 5-year PFS rates of 43.6%and 62.3%,respectively(P=0.209).Disease progression or relapse within a year was identified as the only significant prognostic factor for OS in univariate analysis.Conclusion:The HyperCVAD regimen is an effective initial therapy for adolescent and adult LL patients.For patients without bone marrow involvement,the HyperCVAD regimen combined with HDT/AHSCT is not superior over the HyperCVAD regimen alone.
lymphoblastic lymphoma,HyperCVAD regimen,high-dose therapy,autologous hematopoietic stem cell transplantation
10.3969/j.issn.1000-8179.20142172
中国医学科学院北京协和医学院肿瘤医院内科,国家新药(抗肿瘤)临床研究中心;抗肿瘤分子靶向药物临床研究北京市重点实验室(北京市100021)
*本文课题受国家“九·五”攻关课题(编号:A20199610396-906-01-12);卫生部优秀青年科技人材专项基金(编号:B121994002);人事部归国留学人员启动基金(编号:B311994001);高等学校博士学科点专项科研基金(编号:20010023018、20050023045、B201995002);霍英东高等院校青年教师基金(编号:B231996001)资助
石远凯syuankai@cicams.ac.cn
