胞浆-5'-核苷酸酶-Ⅱ在非小细胞肺癌组织中的表达及其临床意义*
2015-09-08曲莉莉刘晓晴王伟霞汤传昊李俭杰李晓燕高红军李晓兵刘广贤
曲莉莉 刘晓晴 王伟霞 汤传昊 李俭杰 李晓燕 高红军李晓兵 刘广贤
·临床研究与应用·
胞浆-5'-核苷酸酶-Ⅱ在非小细胞肺癌组织中的表达及其临床意义*
曲莉莉①刘晓晴①王伟霞①汤传昊①李俭杰①李晓燕①高红军①李晓兵②刘广贤③
目的:胞浆-5'-核苷酸酶-Ⅱ(CN-Ⅱ)是一种核苷酸酶,具有水解酶及磷酸转移酶的活性,其异常表达可能与多种核苷类药物耐药有一定相关性。本研究旨在探讨CN-Ⅱ在非小细胞肺癌(non-small cell lung cancer,NSCLC)组织中的表达及其与临床病理因素的关系。方法:应用免疫组织化学方法检测116例NSCLC原发及转移病灶中CN-Ⅱ的表达并分析其中67例曾接受过吉西他滨方案化疗的患者其CN-Ⅱ表达与吉西他滨近期疗效及生存的相关性,采用χ2检验及Fisher精确检验分析其表达水平与临床病理因素的相关性,采用Kaplan-Meier方法分析TTP及OS(overall survival,OS),采用对数秩和检验比较不同CN-Ⅱ表达情况之间的差异。结果:116例NSCLC标本中CN-Ⅱ阳性表达率为53.4%,其表达水平与患者的年龄、性别、KPS评分、临床分期、肿瘤病理类型及分化程度等均无显著相关性。NSCLC原发病灶与淋巴结等转移病灶中CN-Ⅱ的表达水平亦无显著性差异。对67例接受含吉西他滨方案化疗NSCLC患者肿瘤组织标本的检测发现,吉西他滨化疗有效组(CR+PR)、疾病控制组(CR+PR+SD)及无效组(PD)的CN-Ⅱ阳性表达率分别为30.4%、36.7%及57.6%,前两者与后者相比均有显著性差异(CR+PR vs.PD组,P=0.008;CR+PR+SD vs.PD组,P=0.013);28例CN-Ⅱ阳性及39例阴性患者中位肿瘤进展时间(progeression free survival,PFS)分别为4.0个月及5.5个月,有显著性差异(95%CI:4.452-6.148,P=0.041),两组患者中位OS分别为9.5个月及11.0个月,无显著性差异(95% CI:8.667-13.333,P=0.282)。结论:CN-Ⅱ异常表达与吉西他滨治疗疗效有一定相关性,有可能成为潜在的疗效预测因子。
5'-核苷酸酶吉西他滨耐药性非小细胞肺癌
Correspondence to:Xiaoqing LIU;E-mail:liuxq@medmail.com.cn
1Department of Lung Cancer,2Department of Pathology,3Department of Hematology,the Affiliated Hospital of the Academy of Military Medical Science,Beijing 100071,China
This work was supported by grants from the Capital Medical Development Foundation(No.2007-3042)
吉西他滨(gemcitabine,Gem)是晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的一线化疗药物,与其他化疗药物一样,原发与继发性耐药使得其临床疗效受阻。近年来以Gem耐药相关基因指导NSCLC个体化治疗的研究多见报道,其中核糖核苷酸还原酶亚基1(ribonucleotide reductase subunit 1,RRM1)是目前研究较为广泛的分子指标,但RRM1并不能完全解释Gem的耐药,仅采用此一项指标来预测Gem疗效有一定局限性,因此研究与探索新的分子预测指标具有重要临床意义。研究发现胞浆-5'-核苷酸酶-Ⅱ(cyto-solic 5'-nucleotidaseⅡ,CN-Ⅱ)可能与Gem耐药有一定相关性[1],其异常表达可能影响药物在肿瘤细胞内的代谢过程,从而影响Gem化疗疗效[2]。
本研究筛选出67例曾接受过含Gem方案化疗患者的肿瘤组织标本,初步观察其CN-Ⅱ蛋白表达情况与Gem近期疗效及患者生存之间的关系,为临床个体化治疗提供理论依据。
1 材料与方法
1.1一般资料
收集2000年3月至2007年9月于军事医学科学院附属医院就诊的116例NSCLC患者肿瘤组织标本,检测其CN-Ⅱ蛋白表达情况。患者年龄21~76岁,中位年龄54岁。临床分期采用1997年国际抗癌联盟(UICC)TNM分期标准,Ⅰ期0例,Ⅱ期1例,ⅢA期8例,IIIB期39例,Ⅳ期68例。116例标本中手术切除的组织标本8例,纤维支气管镜活检或经皮肺穿刺活检标本49例,转移淋巴结穿刺活检标本56例,其他转移部位穿刺活检标本3例。由医院两位高年资病理医师根据WHO(2004年)新分类标准结合免疫组织化学结果进行病理诊断。本研究经医院伦理委员会批准,患者及家属知情同意并签署协议书。
筛选67例曾接受含Gem方案化疗的NSCLC患者肿瘤组织标本,回顾性分析其CN-Ⅱ表达情况与Gem近期疗效及患者生存的关系。化疗疗效的评定采用RECIST1.0实体瘤近期疗效评价标准(2003年前采用WHO标准)。从治疗第1天计算至影像学或临床进展日期。总生存(overall survival,OS)从NSCLC确诊计算至死亡日期。67例患者的随访截止日期为2010年2月1日,中位随访时间3年。
1.2方法
1.2.1实验方法标本均10%甲醛固定,常规脱水,石蜡包埋,4 μm厚切片。采用免疫组织化学SP二步法检测116例标本中CN-Ⅱ蛋白表达情况。兔抗人CN-Ⅱ多克隆抗体购自北京博奥森公司。操作严格按产品说明书进行。以人正常胰腺组织阳性片作为
阳性对照,用PBS代替一抗作为空白对照。
1.2.2结果判定CN-Ⅱ蛋白表达以胞浆内出现弥漫的棕黄或棕褐色颗粒为阳性。结合染色强度和阳性细胞数进行分级。两人双盲法分别观察切片,随机选取10个高倍视野(×400),评分后取平均值。按染色强度评分标准:不着色0分,淡黄色1分,深黄色或褐色2分,深褐色3分。按阳性细胞比例评分标准:<10%为0分,10%~25%为1分,26%~50%为2分,>50%为3分。二分法以乘积等于3为界,乘积≤3记为低表达(阴性),乘积>3记为高表达(阳性)。1.3统计学分析
应用SPSS 17.0统计学分析软件,采用配对χ2检验和Fisher精确检验分析不同临床病理特征的患者其CN-Ⅱ表达有无差异性。采用Kaplan-Meier方法估计TTP及OS,采用对数秩和检验(Long rank test)比较不同CN-Ⅱ表达情况之间的差异。以P<0.05为差异具有统计学意义。
2 结果
2.1CN-Ⅱ在NSCLC组织中的表达
免疫组织化学方法显示CN-Ⅱ在NSCLC组织中主要定位于肿瘤细胞胞浆,呈棕黄或棕褐色,部分细胞可见胞核与胞浆同时着色(图1)。在NSCLC组织中CN-Ⅱ的阳性表达率为53.4%(62/116)。
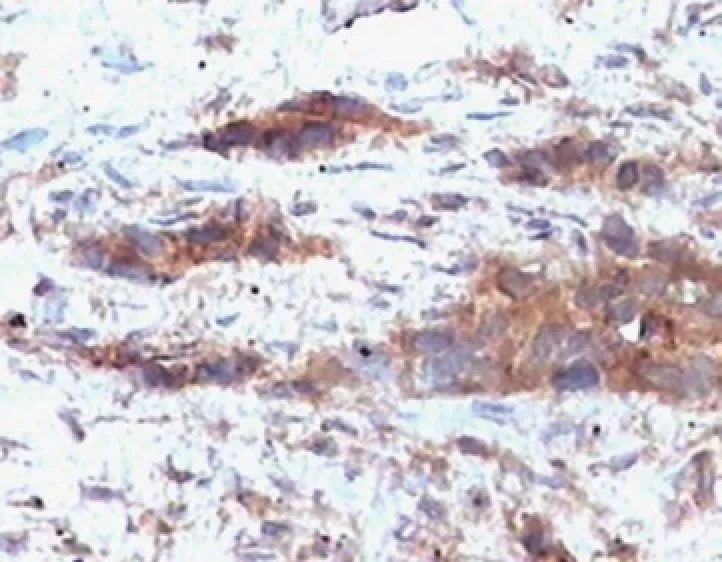
图1 CN-Ⅱ在NSCLC细胞中的表达(IHC×400)Figure 1 Expression of CN-II in non-small cell lung cancer(NSCLC)tissues(IHC×400)
2.2CN-Ⅱ表达与临床病理特征的关系
表达CN-Ⅱ蛋白的NSCLC患者的年龄、性别、ECOG评分、临床分期、肿瘤组织学分型均无显著相关性(表1)。NSCLC原发病灶组织57例,其CN-Ⅱ阳性表达率49.1%,转移病灶组织共59例,原发灶与转移灶中CN-Ⅱ的表达无显著性差异(表2)。
2.3CN-Ⅱ表达水平对吉西他滨近期疗效及患者生存期的影响
67例患者曾接受含Gem方案化疗,其CN-Ⅱ阳性表达率为41.7%(28/67),CN-Ⅱ表达水平与患者的年龄、性别、肿瘤分期及病理类型无显著相关性(表3)。67例患者中26例接受了吉西他滨联合顺铂方案(吉西他滨1.0 g/m2d1,d8、顺铂75 mg/m2),40例为吉西他滨联合卡铂方案(吉西他滨1.0 g/m2d1,d8、卡铂AUC=5 d1),1例为吉西他滨联合多西紫杉醇方案(吉西他滨1.0 g/m2d1,d8、多西紫杉醇75 mg/m2d1)。

表1 CN-Ⅱ表达与116例NSCLC患者临床病理特征之间的关系Table 1 Relationship between CN-Ⅱ expression and clinicopathological characteristics in 116 NSCLC patients

表2 NSCLC原发病灶与转移灶中CN-Ⅱ表达水平比较Table 2 Correlation analysis of CN-Ⅱexpression and gemcitabine efficacy in primary and metastatic lesions
54例为一线治疗,治疗周期1~6周期,客观有效率(CR+PR)为38.9%(21/54),疾病控制率(CR+PR+ SD)为77.8%(42/54),疾病控制患者的中位无进展生存期(progression free survival,PFS)为6.0个月。13例为二线治疗,治疗周期1~4周期,其客观有效率15.4%(2/13),疾病控制率53.9%(7/13),疾病控制患者的中位PFS为3.5个月。所有患者总的客观有效率34.3%(23/67),疾病控制率73.1%(49/67)。Gem治疗有效(CR+PR)及疾病控制(CR+PR+SD)与疾病进展(PD)的患者相比其CN-Ⅱ表达有显著性差异(P= 0.027,P=0.031,表4)。
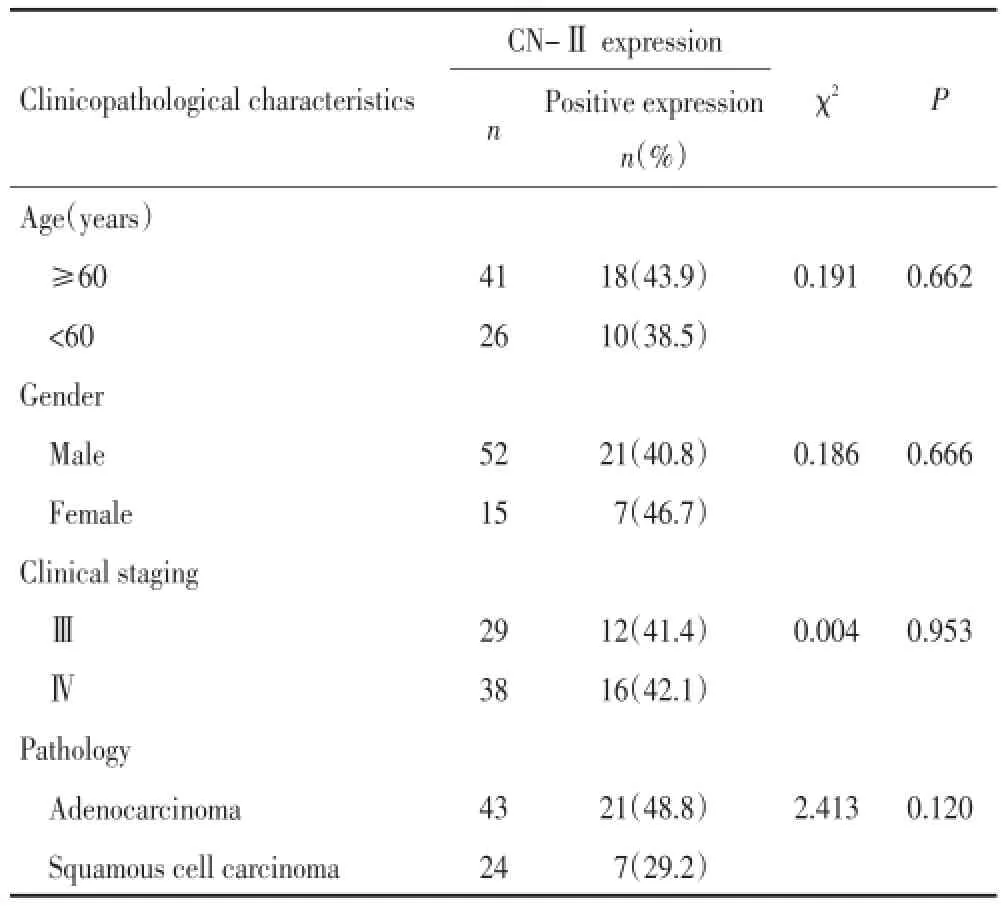
表3 CN-Ⅱ表达与67例接受Gem治疗的NSCLC患者临床病理特征的关系Table 3 Relationship between CN-Ⅱexpression and clinicopathological characteristics in 67 NSCLC patients treated with gemcitabine

表4 CN-Ⅱ表达与吉西他滨近期疗效的相关性分析Table 4 Relationship between CN-Ⅱexpression and gemcitabine efficacy
67例患者中有28例CN-Ⅱ阳性(41.8%),39例CN-Ⅱ阴性(58.2%),两组患者中位PFS分别为4.0个月及5.5个月,二者相比有显著性差异(95%CI:4.452-6.148,P=0.041,图2A)。49例随访到生存期,中位随访时间3年,18例患者失访(记为删失数据)。所有患者OS 4.5~25.0个月,中位OS 11.0个月。CN-Ⅱ阳性及阴性组患者中位OS分别为9.5个月及11.0个月,CN-II阴性组优于阳性组,但二者相比未发现有显著性差异(95%CI:8.667-13.333,P=0.282,图2B)。

图2 67例不同CN-Ⅱ表达状态的NSCLC患者接受吉西他滨治疗Figure 2 Kaplan-Meier survival curve of CN-Ⅱ expression in 67 NSCLC patients who received gemcitabine chemotherapy.
3 讨论
目前,驱动基因指导下的分子靶向治疗在NSCLC中取得较好的疗效,且根据EGFR及ALK基因突变状态制定一线治疗方案,已为NCCN指南所推荐,这使得肺癌的治疗已走上基因为导向的个体化治疗之路[3-4]。然而作为NSCLC标准治疗之一的化疗,始终未能突破瓶颈,可否实现分子标志物指导下的个体化化疗,目前还无肯定的答案,2013年ASCO年会报道两项有关化疗生物标志物前瞻性研究均宣告失败[5-6],这使得探索之路更加艰难。
Gem是目前NSCLC常用的一线化疗药物,其在治疗初诊或既往化疗失败患者的总有效率仅20%~40%[7-8]。Gem具水溶性,需特殊的核苷转运蛋白将其转运至肿瘤细胞内,之后其经过两步磷酸化反应被转化为具有活性的Gem磷酸盐,干扰DNA合成及修复,诱导肿瘤细胞凋亡[9-10]。Gem的耐药机制较为复杂,目前研究认为主要与摄取转运过程障碍和胞浆内活化及分解酶异常有关[10]。
CN-Ⅱ系卤酸脱卤酶(haloacid dehalogenase,HAD)超家族成员之一,分子量65 kDa,其分布广泛,具有水解酶及磷酸转移酶的活性[11],呈底物专一性,是细胞内重要的代谢调解酶[12-13]。CN-Ⅱ由APT激活变构调节以及可被无机磷酸盐抑制[13]。在5'-核苷酸酶家族中,CN-Ⅱ与核苷类药物耐药的关系最为密切[14]。研究表明纯化的CN-Ⅱ酶可将多种核苷类似物作为其催化底物,水解其磷酸活化产物,使得药物不能继续磷酸化活化,从而降低其抗肿瘤活性[15],而且其可将IMP或GMP的磷酸基团转移到外源性的核苷类似物,使得其活化受阻[13]。体外细胞实验发现,Gem耐药肿瘤细胞中CN-ⅡmRNA表达水平明显高于其亲代细胞[16],且已有多个研究显示,抑制CN-II活性可直接导致肿瘤细胞凋亡,且可增加细胞毒药物的抗肿瘤活性[17-18],目前已有专门以CN-Ⅱ作为靶点的抗肿瘤药物β羟基磷酸酯核苷类似物(β-hydroxyphosphonate nucleoside analogues)在研发中,体外实验已初步显示出较好的抗肿瘤活性[19]。
临床研究中无论检测CN-ⅡmRNA,还是蛋白表达水平,因受临床标本量以及检测方法简便、可操作性强等因素影响,采用免疫组织化学方法检测CN-Ⅱ蛋白水平的表达更具可行性,但此方法缺点是检测结果仅为半定量,可信度较差。目前检索到的CN-Ⅱ在NSCLC组织中的表达研究即采用了免疫组织化学的方法,Pascal等[20]检测了43例接受含吉西他滨方案化疗的NSCLC患者肿瘤组织中CN-Ⅱ的表达水平,其以40%为界将组织标本分为阳性组与阴性组,结果显示CN-Ⅱ高表达率72.1%,表达水平低的患者生存期较短(180天vs.330天,P=0.047),预后较差,而研究并未显示两组患者之间含吉西他滨方案化疗客观有效率以及PFS有显著性差异。文献中未明确其判定CN-Ⅱ表达水平高低的依据,由于其判定CN-Ⅱ阳性时未考虑细胞定位及染色深浅问题,肿瘤细胞的胞浆和(或)胞核着色均将其判定为阳性表达。本研究显示CN-Ⅱ在NSCLC组织中的阳性表达率为53.4%,低于文献报道的72.1%,这可能与本研究选用的阳性判定标准较为严格有关,肿瘤细胞胞浆着色或胞浆与胞核同时着色计为阳性,仅胞核着色计为阴性,同时亦综合考虑了细胞染色的深浅来判定结果。本研究认为免疫组织化学检测方法的标准化以及判定标准的统一化将可能是研究的关键点,这将增加不同研究结果之间的可比性,以进一步推动CN-Ⅱ的临床研究。
有关CN-Ⅱ在NSCLC肿瘤组织中表达情况的研究可检索到的文献较少,本研究结果显示CN-Ⅱ表达与NSCLC患者的年龄、性别、ECOG评分、肿瘤临床分期均无相关性,腺癌与鳞癌患者其表达亦无显著性差异,此结果与文献报道相一致[20]。通过比较含Gem方案化疗不同疗效患者其肿瘤组织中CN-Ⅱ表达情况发现,治疗无效的患者其CN-Ⅱ阳性率显著高于治疗有效及疾病控制的患者,且CN-Ⅱ阴性组患者PFS较阳性组患者长,由此推测CN-Ⅱ阳性表达的患者接受含Gem方案化疗可能疗效欠佳。另通过生存分析显示,CN-Ⅱ阴性表达的患者OS相对较长,但与阳性组患者相比未发现有显著性差异。这与Pascal等[20]文献报道的结果有一定差异,文献中并未发现CN-Ⅱ与吉西他滨治疗疗效有相关性,相反,CN-Ⅱ可作为预测接受吉西他滨治疗患者预后的独立预测因子,CN-Ⅱ高表达的患者OS要优于低表达者。本研究中两组均受回顾性资料限制,虽文献中接受含吉西他滨方案化疗的患者均为一线治疗,但治疗方案较杂,这在一定程度上可能影响了实验结果;且两组研究所纳入的病例数均有限,如能在此基础上更进一步扩大样本量也许能提高结果的可信度;此外,患者OS影响因素较多,尤其是患者在接受吉西他滨治疗后的多线治疗,方案及疗程、疗效均有较大的差异,如能在前瞻性研究的基础上进行多因素分析将更有利于明确CN-Ⅱ的临床意义。
目前研究显示CN-Ⅱ可能与含吉西他滨方案化疗疗效有一定相关性,但研究多局限于小样本的回顾性研究,亟待临床前瞻性的大规模研究来验证,且CN-Ⅱ联合多个分子指标建立起疗效预测模型可能更具意义。目前分子标志物指导下的个体化化疗尚未真正应用于临床,是否其可以如分子靶向治疗一样获得较好的疗效,仍需高级别的循证医学证据。
1 Hunsucker SA,Mitchell BS,Spychala J.The 5'-nucleotidases as regulators of nucleotide and drug metabolism[J].Pharmacol Ther,2005,107(1):1-30.
2 Jordheim LP,Cros E,Galmarini CM,et al.F-ara-AMP is a substrate of cytoplasmic 5'-nucleotidase II(CN-II):HPLC and NMR studies of enzymatic dephosphorylation[J].Nucleosides Nucleotides Nucleic Acids,2006,25(3):289-297.
3 Minuti G,Dincecco A,Cappuzzo F.Target therapy for NSCLC with driver mutations[J].Expert Opiin Biol Ther,2013,13(10):1401-1412. 4National Comprehensive Cancer Network.NCCN clinical practice guidelines in oncology[J].Non-small cell lung caner version2,2013. 5Bepler G,Williams CC,Schell ML,et al.Molecular analysis directed,international,phaseⅢtrial in patients with advanced non-small cell lung cancer[J].J Clin Oncol,2013,31(15s):abstr 8001.
6 Moran T,Cobo M,Domine M,et al.Interim analysis of the Spanish Lung Cancer Group(SLCG)BRCA1-RAP80 Expression Customization(BREC)randomized phase III trial of customized therapy in advanced non-small-cell lung cancer(NSCLC)patients(p)(NCT00617656/GECP-BREC)[J].J Clin Oncol,2013,31(18s):abstr LBA8002.
7 Manegold C,Von Pawel J,Zatiouka P,et al.B017704(AVAIL):A phaseⅢ randomised study of first-line bevacizumab combined with cisplatin/gemcitabine(CG)in patients(TS)with advanced or recurrent non-squamous,non-small cell lung cancer(NSCLC)[J]. Ann Oncol,2008,19:viii 1.
8 Li Y,Wang LR,Chen J,et al.First-line gemcitabine plus cisplatin in nonsmall cell lung cancer patients[J].Dis Markers,2014,2014:960458. 9Mini E,Nobili S,Caciagli B,et al.Cellular pharmacology of gemcitabine[J].Ann Oncol,2006,17(5):7-12.
10 Wonganan P1,Lansakara-P DS,Zhu S,et al.Just getting into cells is not enough:mechanisms underlying 4-(N)-stearoyl gemcitabine solid lipid nanoparticle's ability to overcome gemcitabine resistance caused by RRM1 overexpression[J].J Control Release,2013,169(1-2):17-27.
11 Kroep JR,Loves WJ,van der Wilt CL,et al.Pretreatment deoxycytidinekinaselevelspredictinvivo gemcitabine sensitivity[J]. Mol Cancer Ther,2002,1(6):371-376.
12 Oqawa M,Hori H,Ohta T,et al.Sensitivity to gemcitabine and its metabolizing enzymes in neuroblastoma[J].Clin Cancer Res,2005,11(9):3485-3493.
13 Itoh R.Enzymatic properties and physiological roles fo cytosolic 5'-nucleotidase II[J].Curr Med Chem,2013,20(34):4260-4284.
14 Allegrini S,Scaloni A,Careddu MG,et al.Mechanistic studies on bovine cytosolic 5'-nucleotidase II,an enzyme belonging to the HAD superfamily[J].Eur J Biochem,2004,271:4881-4891.
15 Wu Jz,Larson J,Walker H,et al.Phosphorylation of ribavirin and viramidine by adenosine kinase and cytosolic 5'-nucleotidase II:Implications for ribavirin metabolism in erythrocytes[J].Antimicrob Agents Chemother,2005,49(6):2164-2171.
16 Dumontet C,Bauchu EC,Fabianowska K,et al.Common resistance mechanisms to nucleoside analogues in variants of the human erythroleukemic line K562[J].Adv Exp Me Biol,1999,457:571-577.
17 Jordheim LP,Chaloin L.Therapeutic perspectives for CN-II in cancer[J].Curr Med Chem,2013,20(34):4292-4303.
18 Gallier F,Lallemand P,Meurillon M,et al.Structural insights into the inhibition of cytosolic 5'-nucleotidase II(CN-II)by ribonucleoside 5'-monophosphate analogues[J].PloS Comput Biol,2011,7(12):e1002295.
19 Meurillon M,Marton Z,Hospital A,et al.Structure-activity relationships of β-hydroxyphosphonate nucleoside analogues as cytosolic 5'-nucleotidase II potential inhibitors:synthesis,in vitro evaluation and molecular modeling studies[J].Eur J Med Chem,2014,77:18-37. 20 Pascal S,John RM,Sylvie I,et al.CN-Ⅱexpression predicts survival in patients receiving gemcitabine for advanced non-small cell lung cancer[J].Lung Cancer,2005,49(3):363-370.
(2014-10-07收稿)
(2014-11-10修回)
(编辑:杨红欣)

曲莉莉专业方向为肺癌的基础及临床研究。E-mail:qulili1130@126.com
Expression and clinical significance of CN-Ⅱ in non-small cell lung cancer tissues
Lili QU1,Xiaoqing LIU1,Weixia WANG1,Chuanhao TANG1,Jianjie LI1,Xiaoyan LI1,Hongjun GAO1,Xiaobing LI2,Guangxian LIU3
Objective:Cytosolic 5'-nucleotidase(CN-Ⅱ),a nucleotide kinase,exhibits both 5'-nucleotidase and nucleoside phosphotransferase activities.Abnormal CN-Ⅱexpression may be correlated with the resistance of nucleoside analogs in anticancer drugs. This study was designed to investigate CN-Ⅱexpression in human non-small cell lung cancer(NSCLC)tissues and its correlation with the clinicopathological parameters as well as the prognosis of patients treated with gemcitabine.Methods:Immunohistochemistry was used to detect CN-Ⅱexpression in 116 cases of paraffin-embedded NSCLC samples.The correlations with the clinicopathological parameters and the response to gemcitabine chemotherapy of CN-Ⅱwere analyzed through the Chi-square test.Log-rank test was used to determine whether or not CN-Ⅱexpression is correlated with the overall survival of patients.Results:The positive rate of CN-Ⅱwas 53.4%in 116 NSCLC tissues.No significant correlation existed between CN-Ⅱexpression and the clinicopathological parameters. Among the 67 of the 116 patients who received gemcitabine chemotherapy,those with tumor progression(positive rate of 57.6%)exhibited higher CN-Ⅱexpression than those with therapeutic efficacy(positive rate of 30.4%,P=0.008)and disease-control chemotherapy (positive rate of 36.7%,P=0.013).The progression-free survival was 4.5 and 5.5 months in the CN-Ⅱ-positive and CN-II-negative groups,respectively,with significant differences(95%CI:4.452 to 6.148,P=0.041).Correspondingly,the overall survival was 9.5 and 11.0 months in the two groups(95%CI:8.667 to 13.333,P=0.282).Conclusion:CN-Ⅱmay be a prognostic factor for gemcitabine chemotherapy in NSCLC patients.
cytosolic 5'-nucleotidase,gemcitabine,resistance,non-small cell lung cancer
10.3969/j.issn.1000-8179.20141672
①军事医学科学院附属医院肺部肿瘤内科(北京市100071);②病理科;③血液内科*本文课题受首都医学发展科研基金(编号:2007-3042)资助
刘晓晴liuxq@medmail.com.cn
