茚三酮定量蛋白质方法的改进
2015-09-06朱文祥谢学辉柳建设
朱文祥,谢学辉,冯 帆,柳建设
(东华大学 环境科学与工程学院,上海 201620)
茚三酮定量蛋白质方法的改进
朱文祥,谢学辉,冯 帆,柳建设
(东华大学 环境科学与工程学院,上海 201620)
首次结合高温碱裂解和乙二醇体系反应液的优势,对茚三酮定量蛋白质的方法进行了改进,同时对测量过程中的关键参数进行了优化,确定了测量波长为570nm、裂解时间为15min、显色时间为15min和冷却时间为5min.在该改进方法条件下,以BSA(牛血清白蛋白)作为标准样品绘制了标准曲线,验证了该方法具有良好的重复性和稳定性.将该方法与茚三酮直接测定法和考马斯亮蓝染色法进行比较,结果表明其具有更高的灵敏度和准确性,在生物、化学、医学等领域具有广泛应用前景.
茚三酮;碱裂解;乙二醇;考马斯亮蓝
蛋白质的准确定量是生物、医学、食品、法医、环境等领域的常见问题[1].蛋白质定量法主要有凯氏定氮法、紫外吸收法、Lowry法、BCA(bicinchoninic acid)法,这些方法都具有操作过程复杂、影响因素较多、准确性和灵敏度较低等缺陷[2].考马斯亮蓝染色法操作简便,受到广大科研工作者的亲睐[3],但该法灵敏度低、准确性较差[3-5].因此,寻找一种灵敏、准确、稳定的蛋白质定量法迫在眉睫.
茚三酮在酸性的还原性环境下能与氨基酸、蛋白质中的α-氨基迅速反应,产物罗曼紫(Ruhemann’s purple)在波长560~580nm有吸收峰[6].该方法被广泛应用于食品、法医、临床诊断等领域中氨基酸和蛋白质的定性或定量检测[7-9],其反应机理如图1所示.文献[1]报道茚三酮与氨基酸反应的灵敏度比与蛋白质反应高40倍,这是因为相同质量下,氨基酸中所含α-氨基的数量要远大于蛋白质中的数量.因此,通过茚三酮定量氨基酸来间接定量蛋白质含量,其灵敏度和准确度更有保障.

图1 茚三酮与氨基酸反应机理[6]Fig.1 Mechanism of reaction between ninhydrin and animo acids [6]
因此,将蛋白质完全裂解成氨基酸后再用茚三酮定量氨基酸是实现蛋白质准确定量的新途径[10].而寻找合适的裂解方式和稳定的茚三酮反应液是实现茚三酮准确定量蛋白质首要解决的两大难题.目前,茚三酮定量蛋白质法中采用两类蛋白质裂解方法,即高温酸裂解法[5,11-13]和高温碱裂解法[10,14-15].高温酸裂解法一般耗时长达4~24h,相比之下,高温碱裂解法耗时短,裂解效率高,可在0.5h内将蛋白质完全裂解,并能消除样品中胺类、核酸等物质对茚三酮反应的影响[10,14-15],故高温碱裂解法更有优越性.茚三酮反应液的稳定性决定定量的准确性[16].以醋酸纤维素、二甲基亚砜、乙醇、丙酮等为溶剂的反应液均有报道,但其稳定性差,配制过程复杂,需现配现用[17],极大限制了茚三酮在定量氨基酸和蛋白质的应用.文献[5]的研究发现,相比广泛使用的醋酸纤维素和二甲基亚砜,以毒性更低的乙二醇为溶剂能明显提高显色液的稳定性,能在一个月内保持测量的准确性,此外,在配制和保存过程中无需氮气环境,更为简便、经济.
鉴于以上分析,采用高温碱裂解法裂解蛋白质,然后以乙二醇为溶剂的反应液定量裂解后的氨基酸,这可能是实现茚三酮法准确定量蛋白质的有效途径.目前,此方面的研究未见报道.因此,本文结合高温碱裂解法和乙二醇溶剂下的茚三酮反应液的优势,建立改进的茚三酮定量蛋白质的方法,在优化测量参数的基础上,研究了该改进方法的准确性、重复性、稳定性和灵敏性.最后通过与直接茚三酮测定法和考马斯亮蓝染色法对比,验证了本文改进方法是一种更为实用、灵敏、准确、稳定的蛋白质定量方法.
1 材料与方法
1.1 试剂与仪器
氢氧化钠(国药集团,上海);茚三酮(Sigma-aldrich,美国);考马斯亮蓝定量试剂盒(上海生工生物工程有限公司,上海);微量紫外分光光度计(Implen公司,德国);高压灭菌锅(上海申安仪器有限公司,上海).其他试剂均为分析纯.
1.2 蛋白质高温裂解
将蛋白质标准液分装在2 mL离心管中,烘箱中105℃烘干2 h左右.取出后向每只离心管中加入500μL 13.5mol/L的NaOH裂解液,盖紧离心管管盖,在漩涡混合器上轻轻混匀后将其放入高压灭菌锅高温裂解.为防止离心管管盖在高温高压环境下开裂,可用封口膜以橡皮筋固定离心管管盖.
1.3 茚三酮反应液的配制
参照文献[5]配制茚三酮反应液.
1.4 测定流程
取100μL上述蛋白质裂解液,加入170μL冰醋酸,轻微振荡混匀后,加入200μL茚三酮反应液,在沸水浴中加热后室温下冷却,取250μL产物加到750μL的50%异丙醇溶液中,在旋涡混合器上剧烈振荡30s后,由微量紫外分光光度计测定吸光度值.
1.5 最佳测量条件的优化
最佳测量波长:茚三酮与含有α-氨基的物质发生化学反应,生成产物在波长560~580nm内有特征吸收峰.但据相关报道,在不同反应条件下产物的最佳吸收波长可为480[18],565[19],568[8,20],570[21],575nm[5-6].为确定在本文所改进方法下反应产物的最佳测量波长,将牛血清白蛋白(BSA)标准液经高温高压碱裂解,并与茚三酮进行显色反应,将产物在波长450~700nm范围内进行扫描.
最佳裂解时间:裂解时间的长短直接决定蛋白质是否完全裂解成游离氨基酸.在装有蛋白质标准液的离心管烘干后加入500μL 13.5mol/L的NaOH裂解液,在高压灭菌锅中分别裂解5,10,15,20min,以未加蛋白质的裂解液作空白对照,每组做4个平行试验.
最佳显色时间:茚三酮与氨基酸反应过程中,显色时间是决定产物生成量的关键因素.在含有蛋白质裂解液的离心管中加入200μL茚三酮反应液,沸水浴中分别加热5,10,15,20,25min,以未加蛋白质的裂解液作为空白对照,每组做4个平行试验.
最佳冷却时间:在沸水浴中生成的反应产物需经一定时间冷却才能准确测量.将装有反应产物的离心管放在室温下分别冷却0,5,10,15,20min后测量,以未加蛋白质的裂解液作为空白对照,每组做4个平行试验.
1.6 标准曲线及其重复性检验
按照所述的测定流程,分别取含BSA为2,4,6,8,10,20,30,40μg的裂解液与茚三酮反应液反应,以未加蛋白质的PBS(磷酸盐)缓冲液为空白对照,每组做4个平行试验,制作蛋白质标准曲线.72 h后再次取含BSA为6和8μg的裂解液与上述茚三酮反应液反应,检验该法的重复性和茚三酮反应液的稳定性.
1.7 稳定性检验
本文采用精密度和蛋白质的回收率两个指标来表征所述方法的稳定性.精密度以相对标准偏差(relative standard deviation,RSD)表示,在空白加标试验条件下计算蛋白质的回收率.此外,为探究在高温高压强碱性环境下氨基酸结构是否遭到破坏,以氨基酸中结构最为简单的甘氨酸为例,通过本改进方法和本改进方法中省去高温高压碱裂解步骤的相对比进行论证.
1.8 灵敏度与准确性分析
采用本文所建立的改进方法,取含BSA、明胶、蛋白酶K和溶菌酶(2,4,6,8,10μg)的裂解液,按照上述测定流程制作蛋白质标准曲线.茚三酮直接测定法省去高温碱裂解步骤,其他步骤与本改进方法一致.考马斯亮蓝染色法按照经典的测定流程,分别取含有蛋白质量为2,4,6,8,10μg的PBS缓冲液100μL,再加入考马斯亮蓝反应液1mL,5min 后测定波长595nm处的吸光度值,制作蛋白质标准曲线.
2 结果与讨论
2.1 最佳测量条件优化结果
将反应产物在波长450~700nm内进行扫描,结果如图2(a)所示.由图2(a)可知,产物在波长570nm 处有最大特征吸收峰.
将BSA标准液在灭菌锅中高温碱裂解,其产物吸光度随裂解时间的变化如图2(b)所示.结果表明裂解15min可使蛋白质完全裂解为游离氨基酸.
将蛋白质裂解液与茚三酮反应液混合后在沸水浴中进行显色反应,产物吸光度随加热时间的变化趋势如图2(c)所示.由图2(c)可知,随着加热时间的延长,产物的吸光度变化不大,说明该显色反应迅速、灵敏、稳定,显色15min后可使游离氨基酸与茚三酮完全反应,之后出现略微下降,这是由于罗曼紫降解所致.
将反应产物在室温下冷却不同时间后再测量其吸光度值,结果如图2(d)所示.由图2(d)可知,产物不经冷却会导致吸光度测量值偏低,冷却不少于5min后吸光度值保持恒定,同时说明罗曼紫在50%异丙醇溶液中能较长时间稳定存在.
综上分析可知,测量波长为570nm、高温裂解时间为15min、显色时间为15min、冷却时间为5min 为该改进的茚三酮定量蛋白质方法的最佳测量条件.
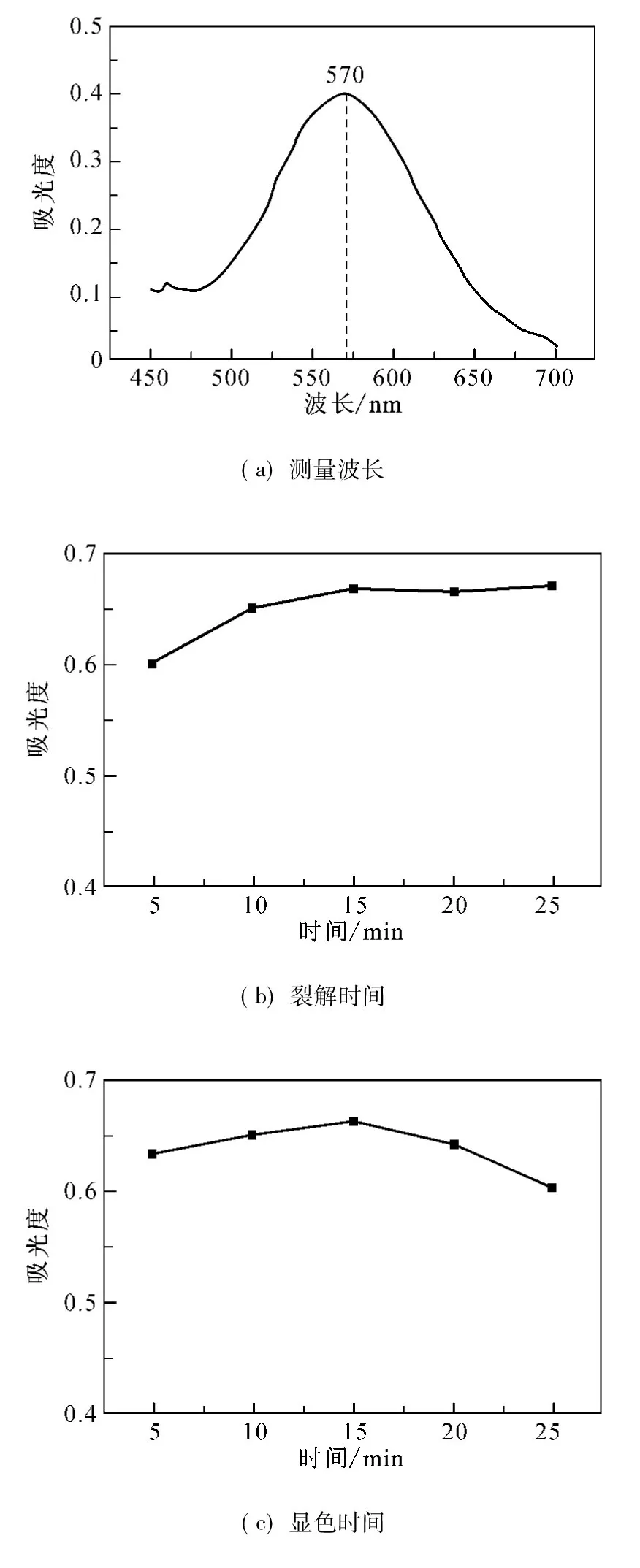
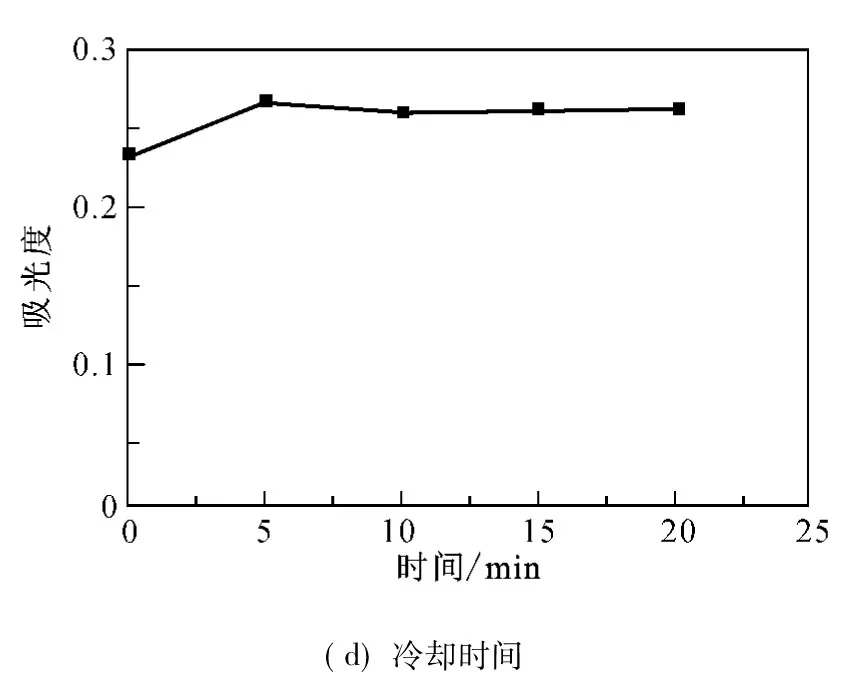
图2 改进的茚三酮法参数优化图Fig.2 The parameters optimization of the improved ninhydrin assay
2.2 蛋白质标准曲线及重复性检验
以该改进的茚三酮定量蛋白质方法测定的BSA标准曲线如图3所示.在蛋白质量为2~40μg时,蛋白质量与吸光度值具有很好的线性关系(R2=0.996,RSD<0.6),说明该改进的茚三酮定量蛋白质方法能准确测量该范围的蛋白质,并且在蛋白质量仅为40μg时,吸光度值已接近2.5,反应现象明显,从侧面反映该方法的灵敏度极高.在低蛋白质量范围内(2~10μg),线性关系方程式为y=0.07x-0.0216,R2=0.998,RSD<0.04,表明该方法在定量极微量蛋白质时具有更大优势.72 h后再以含BSA为6和8μg的裂解液与上述茚三酮反应液反应,结果表明该改进方法的重复性高,同时说明该茚三酮反应液稳定性好,增强了以茚三酮定量蛋白质方法的实用性.

图3 牛血清白蛋白(BSA)标准曲线及重复性检验Fig.3 The standard curve of bovine serum albumin (BSA) and repeatability test
2.3 稳定性检验
蛋白质的回收率试验结果如表1所示.由表1可知,本改进方法在测定时数据相对标准偏差均小于4%,蛋白质回收率接近100%,说明该方法在测量时的稳定性及精密度好.

表1 回收率试验Table 1 Recovery experiments
甘氨酸对比试验如表2所示.由表2可知,在短时间内,蛋白质在高温高压强碱性环境下裂解与未经高温高压碱裂解对比,可以发现其裂解液的吸光度未有明显改变,说明氨基酸中的氨基结构未遭到破坏.由此可知,蛋白质经高温高压碱裂解后所释放的游离氨基酸在此条件下依然能保持α-氨基结构的完整性,从而保证了该方法在蛋白质定量过程中的稳定性.

表2 甘氨酸在高温高压强碱性水解液中的稳定性Table 2 Stability of glycine in alkaline hydrolysis with high pressure and temperature
2.4 灵敏度与准确性分析
分别取BSA、溶菌酶(Lysozyme)、蛋白酶K(Proteinase K)和明胶(Geltin),以本文改进的茚三酮法(IN)、茚三酮直接测定法(DN)和考马斯亮蓝染色法(CBB)做对比试验,试验结果如图4所示.本文改进的茚三酮定量蛋白质方法在测定2~10μg蛋白质的吸光度均较大,说明该法灵敏度高;且相同质量不同种类蛋白质的吸光度相近,说明该方法在蛋白质定量时只与蛋白质量有关,与种类基本无关;不同蛋白质标准曲线的线性程度高(R2≥0.998),线性直线近乎重叠,进一步说明该方法在测量蛋白质时准确性好.而茚三酮直接测定法在蛋白质量2~10μg 内无法检测到BSA、溶菌酶和明胶,说明茚三酮直接测定法的灵敏度极低,无法实现低浓度蛋白质的定性和定量,但在定量蛋白酶K时吸光度较大,这很可能是由于该蛋白质裸露的α-氨基含量明显高于其他3种蛋白质.相比于其他两种定量蛋白质方法,考马斯亮蓝染色法显示不同种类蛋白质标准曲线的线性程度波动大(R2=0.951~0.998),表明该方法的灵敏度与准确性均较差.
通过上述对比分析可知,采用本文所述改进的茚三酮定量蛋白质方法,其准确性与灵敏度明显优于茚三酮直接测定法和考马斯亮蓝染色法.

图4 相同质量不同种类蛋白质分别采用改进的茚三酮法、茚三酮直接测定法与考马斯亮蓝法测定比较Fig.4 Comparison of four kinds of proteins measured by IN assay,DN assay and CBB assay
3 结 语
(1) 本文首次结合高温碱裂解和以乙二醇为溶剂的反应液的优势,对茚三酮定量蛋白质法进行改进研究.采用该方法对茚三酮测定蛋白质含量反应过程中的关键参数进行了优化研究,确定了相关最佳参数:测量波长为570nm、裂解时间为15min、显色时间为15min和冷却时间为5min.
(2) 基于该改进的茚三酮定量蛋白质方法,用BSA作为标准样品制作标准曲线,在蛋白质量仅为2~40μg即能实现准确定量,并在低蛋白质量范围内(2~10μg)标准曲线方程为:y=0.07x-0.0216(R2=0.998,RSD<0.04).蛋白质回收率试验表明测量相对标准偏差为1.01%~3.39%和蛋白质回收率为97.4%~100.5%,同时以甘氨酸为对象论证了该改进方法中的高温高压碱裂解在短时间内对氨基酸中氨基结构无影响.由此证明该方法在测定过程中具有较高重复性和稳定性.
(3) 本文改进的茚三酮定量蛋白质法,利用了茚三酮与氨基酸中氨基的高度灵敏反应,虽在操作过程中将目标产物稀释近8倍,但还能准确定量到2 μg蛋白质,说明该方法在定量极微量蛋白质上具有更大潜力,且不同种类蛋白质的标准曲线线性程度高,且曲线近乎重合,从而说明本方法的灵敏性、准确度和适用性高.通过与茚三酮直接测定法和考马斯亮蓝染色法比较可知,本文改进的方法是一种更为灵敏、准确、稳定的蛋白质定量方法,在生物、化学、医学等领域具有广泛应用前景.
[1] NAYUNI N K,CLOUTMAN-GREEN E,HOLLIS M,et al.Critical evaluation of ninhydrin for monitoring surgical instrument decontamination[J].Journal of Hospital Infection,2013,84(2):97-102.
[2] PERRETT D.From ‘protein’ to the beginnings of clinical proteomics[J].Proteomics-Clinical Applications,2007,1(8):720-738.
[3] WENRICH B R,TRUMBO T A.Interaction of nucleic acids with Coomassie Blue G-250in the Bradford assay[J].Analytical Biochemistry,2012,428(2):93-95.
[4] COMPTON S J,JONES C G.Mechanism of dye response and interference in the Bradford protein assay[J].Analytical Biochemistry,1985,151(2):369-374.
[5] STARCHER B.A ninhydrin-based assay to quantitate the total protein content of tissue samples[J].Analytical Biochemistry,2001,292(1):125-129.
[7] ZHANG Y,FU Y,ZHOU S,et al.A straightforward ninhydrin-based method for collagenase activity and inhibitor screening of collagenase using spectrophotometer[J].Analytical Biochemistry,2013,437(1):46-48.
[8] SIDDIQUI F A,ARAYNE M S,SULTANA N,et al.Spectrophotometric determination of gabapentin in pharmaceutical formulations using ninhydrin and π-acceptors[J].European Journal of Medicinal Chemistry,2010,45(7):2761-2767.
[9] HOSSEINIMEHR S J,POURMORAD F,MOSHTAGHI E,et al.Colorimetric determination of Baclofen with ninhydrin reagent and compare with HPLC method in tablet[J].Asian Journal of Chemistry,2010,22(1):522-526.
[10] MCGRATH R.Protein measurement by ninhydrin determination of amino acids released by alkaline hydrolysis[J].Analytical Biochemistry,1972,49(1):95-102.
[11] ABERNATHY D G,SPEDDING G,STARCHER B.Analysis of protein and total usable nitrogen in beer and wine using a microwell ninhydrin assay[J].Journal of the Institute of Brewing,2009,115(2):122-127.
[12] KANG S U,LUBEC G.Determination of in-gel protein concentration by a ninhydrin-based method[J].Proteomics,2011,11(3):481-484.
[13] BROOKS S P J,LAMPI B J,SARWAR G,et al.Acomparison of methods for determining total body protein[J]. Analytical Biochemistry,1995,226(1): 26-30.
[14] ROBERTS C W,BREWER J M,ALEXANDER J. Congenital toxoplasmosis in the Balb/c mouse: Prevention of vertical disease transmission and fetal death by vaccination[J]. Vaccine,1994,12(15): 1389-1394.
[15] MOSHA T C E,BENNINK M R.Microelement and amino acid profiles of cereal-bean-sardine composite supplementary foods for preschool-age children in tanzania[J]. Journal of Food Processing and Preservation,2011,35(1): 1-19.
[16] MOORE S,STEIN W H. Photometric ninhydrin method for use in the chromatography of amino acids[J]. Journal of Biological Chemistry,1948,176(1): 367-388.
[17] SUN S W,LIN Y C,WENG Y M,et al. Efficiency improvements on ninhydrin method for amino acid quantification[J]. Journal of Food Composition and Analysis,2006,19(2): 112-117.
[18] RAUL DELFINO M,MARIA MONZON C,DEL CARMEN TERESA SARNO M. Validation of ninhydrin quantitative method for cephalexin generic tablets[J]. Current Pharmaceutical Analysis,2013,9(1): 13-19.
[19] ALARFAJ A,RAZEQ A A,AL-QAHTANI N. Spectrophotometric determination of alendronate sodium in bulk drug and in pharmaceutical formulation[J]. Asian Journal of Chemistry,2011,23(2): 697-700.
[20] GARANYAN G S,KHANFERYAN R A,OGANESYAN E T. Chemical and biological investigation of hydrolysate based on lactic-acid bacterial cultures[J]. Pharmaceutical Chemistry Journal,2010,44(8): 459-462.
[21] KANG S U,HEO S,LUBEC G. In-gel total protein quantification using a ninhydrin-based method[J]. Amino Acids,2013,45(4): 1003-1013.
Improvement of Protein Determination by Ninhydrin Assay
ZHUWen-xiang,XIEXue-hui,FENGFan,LIUJian-she
(School of Environmental Science and Engineering,Donghua University,Shanghai 201620,China)
Alkaline hydrolyzed proteins in high temperature and ninhydrin reagent prepared in the ethylene glycol dissolving system were first combined with respective advantage.Several key parameters including measure wavelength,hydrolyzing time,colouration time and cooling time were optimized,which were 570nm,15min,15min and 5min,respectively.The high repeatability and stability of this Improved Ninhydrin (IN) assay was testified by the standard curve of BSA (Bovine Serum Albumin).Futhermore,it reveals that IN assay shows higher linear and sensitivity than Direct Ninhydrin and Coomassie Brilliant Blue assay.Therefore,the IN assay has great application prospects in the field of biology,chemistry and medicine owing to its sensitivity,accuracy and stability for determination of a variety of proteins.
ninhydrin; alkaline hydrolysis; ethylene glycol; Coomassie Brilliant Blue
1671-0444(2015)01-0060-05
2013-10-11
国家自然科学基金资助项目(41073060);教育部博士点新教师基金资助项目(20120075120014);上海市自然科学基金青年资助项目(12ZR1440400);上海市重点学科建设资助项目(B604)
朱文祥(1989—),男,江西鹰潭人,硕士研究生,研究方向为环境生物技术.E-mail:zhuwenxiang2011@126.com柳建设(联系人),男,教授,E-mail:liujianshe@dhu.edu.cn
Q 5-33;Q 530
A
