米曲霉固态发酵三七渣产淀粉酶的研究
2015-09-03谭显东羊依金
王 浪, 谭显东, 胡 伟, 羊依金
(成都信息工程大学资源环境学院,四川成都610225)
三七渣是三七提取皂苷后的废弃物,目前主要采用露天堆放、焚烧或填埋的方式进行处置,不仅造成了大量生物质资源的浪费,还会带来二次污染。研究表明,三七渣中富含淀粉、蛋白质、氨基酸、脂肪酸、维生素、微量元素等多种营养物质以及三七多糖等生物活性成分(杨智等,1994)。采用三七渣替代常规饲料原料作为固态发酵培养基使用,可以降低生产成本,实现其资源化利用。三七渣经米曲霉发酵后所得的发酵培养物中含有大量的淀粉酶,可以作为饲料添加剂使用。本研究采用单因素试验和正交试验对米曲霉固态发酵三七渣产淀粉酶的工艺条件进行了研究和优化。
1 材料与方法
1.1 材料
1.1.1 菌种 米曲霉(Aspergillus oryzae),由山东农业大学生命科学学院保藏与提供。
1.1.2 三七渣 三七渣,由四川省某中成药集团提供,经自然风干、烘干、粉碎、过筛后,置于干燥器中备用。其组成成分的质量分数为:粗淀粉33.13%,粗蛋白质12.28%,真蛋白质9.97%,还原糖1.37%。
1.1.3 培养基 PDA培养基:马铃薯浸取液1000mL,葡萄糖20.0 g,琼脂15.0 g,pH值自然,121℃灭菌30 min,用于米曲霉的培养和种子液的制备。
三七渣培养基:过60目筛的三七渣10 g,培养基含水率为65%,初始pH自然,培养基于121℃灭菌30 min,用于米曲霉固态发酵产淀粉酶的研究。除特殊说明外,本试验所用培养基组成均为此。
1.2 试验方法
1.2.1 菌悬液的制备 将在PDA上培养3 d的米曲霉菌种,用灭过菌的无菌水冲洗,制备孢子悬浮液,制备的菌悬液浓度为2×107个/mL。
1.2.2 发酵培养 除特殊说明外,米曲霉发酵培养过程如下:在固态发酵培养基中,接入10%的米曲霉孢子菌悬浮液 (即在10.0 g三七渣固态发酵培养基中接入1 mL菌悬浮液,即为10%的接种量,下同),将其置于PYX-280M-C霉菌培养箱中恒温培养,培养温度为30℃,培养时间为5 d。
1.2.3 酶液的制备 称取1.000 g发酵培养物(湿物料)于锥形瓶中,加入50 mL蒸馏水并充分搅拌使其均匀悬浮,再将其放入40℃的恒温水浴锅中浸提60 min后,用8层纱布过滤上述提取液,再将滤液经5000 r/min离心10 min后取其上清液置于4℃下保存,备用。
1.2.4 淀粉酶活的测定 淀粉酶活的测定参照芶琳和单志(2010)的方法。
酶活单位定义为:在试验条件下,5 min内降解1 mg/mL的淀粉溶液生成1 μmol还原糖需要的酶量,定义为1个酶活单位,记为U/g湿物料。
1.2.5 单因素试验 分别考察氮源添加量、初始含水量、培养时间、三七渣粒径对产淀粉酶的影响。
1.2.6 正交试验 选取培养时间、三七渣粒径和含水率3个因素,进行L9(33)正交试验。
本次研究中每个试验结果均为3个平行试验的平均值。
2 结果与讨论
2.1 单因素试验
2.1.1 硫酸铵添加量对产淀粉酶的影响 在三七渣基质中按照一定比例(0%~5%)添加硫酸铵,考察氮源添加量对产酶的影响,结果见图1。

图1 硫酸铵添加量对产淀粉酶的影响
由图1可见,不添加硫酸铵时发酵培养物的淀粉酶活最高,随着硫酸铵添加量的增加,淀粉酶活反而逐渐减小,最终趋于平稳,这说明三七渣中主要营养成分比较均衡,其碳氮比合适淀粉酶的生产。Swetha等(2007)采用米曲霉固态发酵工农业废料产淀粉酶,结果发现,添加氮源并未促进淀粉酶的增加,与本试验结果类似。但胡伟等(2013)却发现采用黑曲霉发酵三七渣产淀粉酶,适量添加氮源(40~60 mg硫酸铵/g干药渣)有利于淀粉酶的生产。
2.1.2 三七渣粒径对产淀粉酶的影响 分别采用过 20、40、60、80、100、120 目筛的三七渣作为发酵基质,考察三七渣粒径对产淀粉酶的影响,结果见图2。
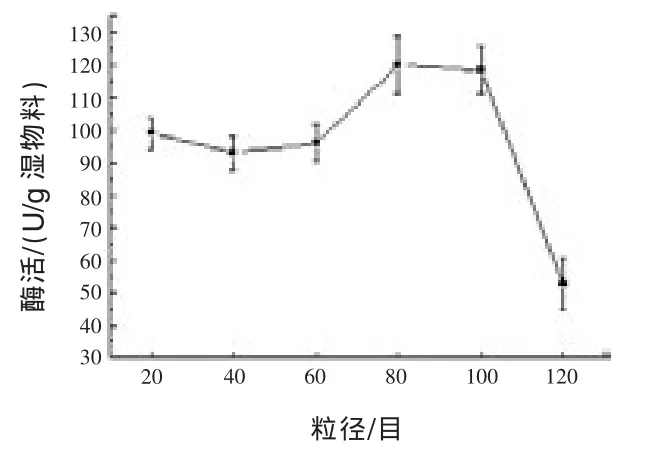
图2 三七渣粒径对产淀粉酶的影响
从图2可见,采用过80目筛的三七渣作为发酵基质,发酵培养物的淀粉酶活最高。基质颗粒过大或过小都会影响产酶:小的物料颗粒可以提供较大的微生物生长面积,从而提高反应速率,但是颗粒太小又容易导致物料结块和孔隙率降低,增大传热和传质阻力,影响微生物的呼吸,进而影响微生物生长和产酶;大颗粒物料由于存在较大的孔隙率有利于提高传质、传热效率,但是只能提供较小的微生物生长面积 (Krishna和Chandrasekaran,1996;Frantisek 和 Anil,1995)。
2.1.3 含水率对产淀粉酶的影响 初始含水率对于微生物的增殖和酶的产生是一个重要的因素,含水率过高或者过低都会影响固态发酵产酶量(Pengthamkeerati等,2012)。 含水率过低,影响营养物质的溶解与传输;含水率过高,则易使物料结块,阻碍气体和热量的扩散和传输,都不利于菌体的生长(张福元和陈风风,2008)。本次研究考察了培养基初始含水率为50%~75%时对产淀粉酶的影响,结果见图3。

图3 含水率对产淀粉酶的影响
由图3可见,当培养基的初始含水率为50%~65%时,淀粉酶活随初始含水率的增大而增大。当初始含水率达到65%时,淀粉酶活达到最大(114.4 U/g),此后随着含水率的增加,酶活逐渐下降。采用黑曲霉固态发酵三七渣时,在水含量为55%时,淀粉酶活力就能达到最高 (胡伟等,2013),而 Suhad 等(2011)研究表明固体基质的含水率为40%~70%时有利于米曲霉产淀粉酶,这说明不同的基质和微生物对发酵培养基初始含水率的要求是有差别的。
2.1.4 培养时间对产淀粉酶的影响 从图4可以看出,发酵培养3 d后淀粉酶活达到最高(113.94 U/g),之后酶活又有所下降,其酶活达到峰值的时间比采用黑曲霉单菌或黑曲霉/产朊假丝酵母混菌发酵三七渣时提前了很多,后两者淀粉酶活达到峰值的时间分别为168 h和216 h(谭显东等,2014;胡伟等,2013);而采用麦麸或木薯渣和生物污泥的混合物作为培养基质固态发酵产淀粉酶的最适培养时间分别为5 d和2 d(Farid和Shata,2011;Pengthamkeerati等,2012)。 这也说明,发酵基质和微生物的种类对淀粉酶活到达峰值的时间影响较大。

图4 培养时间对产淀粉酶的影响
2.2 正交试验 为了获得最优的培养工艺条件,本次研究采用L9(33)正交试验进行相关条件的优化。正交试验因素与水平见表1,试验结果与方差分析分别见表2和表3。
由表3可以看出,含水率、粒径、培养时间以及三者之间的交互作用对试验结果的影响均极显著(P<0.01),这三个因素以及它们之间的交互作用对试验结果影响程度的排序为:培养时间>含水率>粒径>交互作用。由于所考察的三个因素之间的交互作用显著,因而需进行多重比较才能获得最优试验条件组合。多重分析结果见表4。

表1 因素与水平

表2 正交试验结果

表3 正交试验方差分析结果
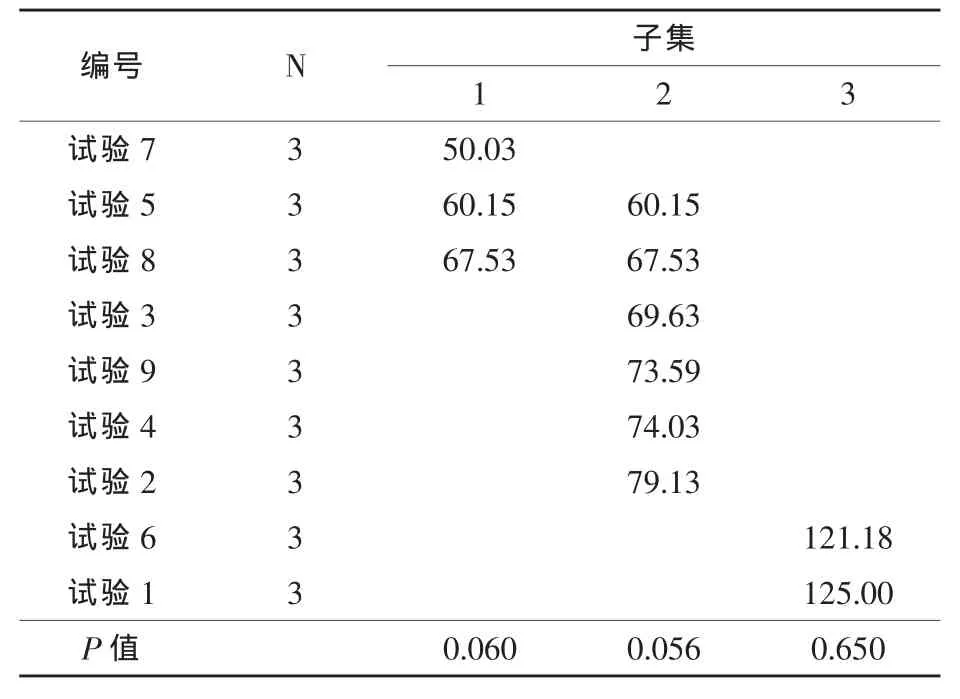
表4 正交试验多重比较结果
由表4可以看出,试验1和试验6的结果最优,两者之间无显著差异,考虑到生产成本,较优的工艺条件搭配为试验1(A1B1C1)。在此条件下,米曲霉固态发酵三七渣所得发酵培养物中淀粉酶活为125.00 U/g湿物料,优于黑曲霉发酵的结果(胡伟等,2013)。
3 结论
3.1 含水率、粒径、培养时间以及三者之间的交互作用对试验结果的影响均极显著 (P<0.01),这三个因素以及它们之间的交互作用对试验结果影响程度的排序为:培养时间>含水率>粒径>交互作用。
3.2 在优化的工艺条件下,即采用过60目筛的三七渣,培养基初始含水率60%,培养时间2 d,接种量10%,米曲霉固态发酵三七渣所得发酵培养物中淀粉酶活为125.00 U/g湿物料。
[1]芶琳,单志.生物化学实验[M].成都:西南交通大学出版社,2010.95~97.
[2]胡伟,谭显东,王君君,等.黑曲霉固态发酵三七渣产淀粉酶的研究[J].环境污染与防治,2013,35:60 ~ 63.
[3]谭显东,胡伟,段娅宁,等.三七渣发酵生产蛋白饲料的菌体生长动力学[J].中国粮油学报,2014,4:72 ~ 77.
[4]杨智,傅梅红,杨立新,等.三七残渣营养成分分析[J].人参研究,1994,2:28~29.
[5]张福元,陈风风.混菌发酵酒糟饲料的初步研究[J].饲料研究,2008,11,32 ~ 34.
[6]Farid M A F,Shata H M A H.Amylase production from Aspergillus oryzae LS1 by solid-state fermentation and its use for the hydrolysis of wheat flour[J].Iranian Journal of Biotechnology,2011,9(4):267 ~ 274.
[7]Frantisek Z,Anil K P.Studies on the effect of particle size on solid-state fermentation of sugarcane bagasse into animal feed using white-rot fungi[J].Bioresource Technology,1995,54:85 ~ 87.
[8]Krishna C,Chandrasekaran M.Banana waste as substrate for α -amylase production by B.subtilis (CBTK 106)under solid state fermentation[J].Appl Microbiol Biotechnol,1996,46:106 ~ 111.
[9]Pengthamkeerati P,Numsomboon S,Satapanajaru T,et al.Production of alpha-amylase by Aspergillus oryzae from cassava Bagasse and wastewater Sludge under Solid-State Fermentation[J].Environmental Progress and Sustainable Energy,2012,31(1):122 ~ 129.
[10]Suhad A A.Alpha Amylase production by Aspergillus oryzae using solid state fermentation[J].Engineering and Technology Journal,2011,29 (14):2954~2960.
[11]Swetha S,Dhanya G,Kesavan M N,et al.Alpha amylase production by Aspergillus oryzae employing solid-state fermentation[J].Journal of Scientific and Industrial Research,2007,66:621 ~ 626.
