香菇多糖的化学修饰研究
2015-09-02梅光明李铁军浙江省海洋水产研究所浙江舟山360北京海燕药业有限公司北京006
梅光明,薛 彬,郝 强,李铁军(.浙江省海洋水产研究所,浙江舟山 360;.北京海燕药业有限公司,北京 006)
香菇多糖的化学修饰研究
梅光明1,薛彬1,郝强2,李铁军1
(1.浙江省海洋水产研究所,浙江舟山316021;2.北京海燕药业有限公司,北京102206)
利用硫酸酯化和羧甲基化对一种酸提香菇多糖SP2进行化学改性,并对反应产物进行取代度计算,应用红外光谱仪和DSC扫描仪对改性产物进行表征。结果表明:硫酸酯化后香菇多糖SP2的取代度为0.87,回收率为88.6%;羧甲基化后香菇多糖SP2的取代度为0.47,回收率为83.6%;红外光谱分析显示改性产物均出现明显的新特征吸收峰,表明SP2成功进行了硫酸酯化和羧甲基化改性;DSC扫描结果表明改性产物与香菇多糖SP2比较,硫酸酯化和羧甲基化改性物热焓都发生改变,出现放热峰,进一步证明硫酸基和羧甲基加到了糖链上。
香菇;多糖;化学修饰
多糖作为一类重要的免疫调节剂,具有良好的抗肿瘤、抗病毒等重要药理活性。研究表明,多糖的生物活性与其一级结构、高级结构、水溶性、粘度等多种因素有关。
一些多糖的活性与其中所含的某些化学基团有密切关系,如硫酸基、羟基和乙酰基等。含有硫酸基的天然海藻多糖对抗HIV病毒已得到证实,并且抑制HIV的作用同分子中硫酸盐的含量有关[1-3]。为了提高多糖的活性,开发多糖的新用途,对多糖的化学修饰研究已成为当前研究的一个新热点。在对多糖的化学修饰中,最常见的为多糖的硫酸酯化,此外还包括羧甲基化、磷酸酯化、乙酰化、羟乙基化等。在天然多糖的分子中引入一定量的硫酸基等强极性基团,可改善水溶性,以便于进一步研究其生物活性。对香菇多糖进行硫酸酯化和羧甲基化,并进行红外光谱、DSC研究[4-6]。
1 材料与方法
1.1主要材料与仪器
香菇多糖SP2、硫酸酯化多糖SP2、羧甲基化多糖SP2,小鼠肿瘤细胞株SP-2(本校分子医学实验室提供),人宫颈癌细胞株HeLa、人肝癌细胞株HepG2(武汉大学医学院提供)。
1.2主要仪器
主要实验仪器如下:AL204分析天平,上海梅特勒公司;pH计,梅特勒-托利多仪器(上海)有限公司;恒温水浴锅(HH-2),金坛市杰瑞尔电器有限公司;搅拌器,金坛市荣华仪器厂;傅立叶变换红外光谱仪,Thermo Nicolet Nexus FT-IR,USA;DSC,DCS-Q10型,美国热电公司。
1.3实验方法
1.3.1香菇多糖的硫酸酯化
多糖的硫酸酯化的方法有:Wolfrom法、浓硫酸法、三乙胺—三氧化硫法等。本章研究选择的是Wolfrom法[7]。
1.3.1.1酯化试剂的制备
无水吡啶置于圆底三口烧瓶中,经冰盐浴冷却后,在搅拌下(无水吡啶:氯磺酸=1:2)将氯磺酸滴加入烧瓶中搅拌40 min。在此期间会出现淡黄色固体,反应结束后,将酯化试剂于-20℃下封存备用。
1.3.1.2硫酸化香菇多糖的制备
[8-11]的方法,取香菇多糖SP2溶于无水甲酰胺中,在室温下搅拌30 min,再加入酯化试剂,在60℃的水浴中搅拌2 h。反应结束后,加入预冷的重蒸水稀释溶液,再加入NaOH中和溶液,离心,流水透析3 d,再蒸馏水透析1 d,旋转蒸发浓缩后,加入无水乙醇,置于4℃温度下醇沉24 h,离心、冷冻干燥得到白色的硫酸酯化香菇多糖。
1.3.1.3标准曲线的绘制
取0.3 g明胶溶于100 mL蒸馏水中,再称取1 g氯化钡溶于上述明胶液中,4℃温度保存,备用。
称取0.1 g的Na2SO4溶于25 mL的蒸馏水中,分别取0 μL、20 μL、40 μL、60 μL、80 μL、100 μL的4 mg/mL Na2SO4分别与蒸馏水混合总体积为100 μL。分别加入3 mL的上述制备好的明胶液,振荡后静止15 min,测360 nm吸光值作出标准曲线。
标准曲线为:y=0.203 2 x-0.009 7,R2=0.999 1。
其中:y是样品在360 nm处的吸光度,x为待测溶液的浓度(mg/mL)。
1.3.1.4硫酸基取代度的计算
取代度(DS)=(1.62×S%)/(32-1.02×S%)。其中:S%为样品中S的百分含量。
1.3.1.5硫酸基含量的测定—氯化钡-明胶比浊法
参考文献[12-15]的方法,称取30 mg硫酸酯化香菇多糖样品,溶于3 mL浓度为1 mol/L HCl中,封管于安瓿瓶中,在100℃水解6 h,冷却到室温。取50 μL安瓿瓶中的糖水解液于试管中,再加入100 μL浓度为4 mol/L的三氯乙酸溶液和3 mL的明胶液,振荡后静止15 min,测360 nm的吸光值(对照管不加糖水解液,以50 μL的1 mol/L HCl代替)。
1.3.2香菇多糖的羧甲基化
参考文献[15-17]的方法取香菇多糖SP2溶于2 mol/L NaOH溶液中,剧烈搅拌下加入氯乙酸,于60℃的水浴中搅拌4 h。冷却到室温,再加入预冷的冰醋酸中和pH=7.0,离心,流水透析3 d,再蒸馏水透析1 d,旋转蒸发浓缩后,加入无水乙醇,置于4℃温度下醇沉24 h,离心,冷冻干燥得到白色的羧甲基化香菇多糖。
羧甲基的测定 参考文献[18-24]的方法取羧甲基多糖样品,在100℃干燥1 h后转入一锥形瓶中,加入3 mL 70%的甲醇,混合后放置3~5 min。在分别加入10 mL水,50 mL 0.5 moL/L的NaOH,混合后振荡3~5 h,直至样品溶解。然后用0.1 moL/L,盐酸滴定,用酚酞显示终点,计算每克羧甲基多糖所需的盐酸的毫摩尔数(A):

式中,V0:加入的NaOH的体积(mL);V1:空白测定所消耗HCl的体积(mL);V2:样品测定所消耗HCl的体积(mL);M0:加入的NaOH的浓度(moL/L),本实验中为0.5 moL/L;M:测定所用HCl的浓度(moL/L),本实验中为0.1 moL/L;W:测定所用样品的质量(g)。
羧甲基取代度(DS)按下式计算:
DS=0.162 A/1-0.058 A。
1.3.3红外光谱分析
香菇多糖SP2经过KBr压片,上红外光谱仪扫描分析,分辨率为4 cm-1,累加32次,扫描前扣除空气背景,扫描范围4 000~400 cm-1。
1.3.4DSC热分析
称取3~5 mg多糖,放置于铝制小坩埚中压紧后,在流速为45 mL/min的氮气气氛下,空铝为参比,以10℃/min的升温速率,从30~300℃范围内扫描。
2 结果与分析
2.1硫含量标准曲线
采氯化钡-明胶比浊法测定硫含量,根据硫酸基标准曲线(图1)得到回归方程为:y=0.203 2 x-0.009 7,相关系数为R2=0.999 1。
其中:y是样品在360 nm处的吸光值,x是待测液浓度(mg/mL)。

图1 硫酸基标准曲线Fig.1 Standard curve of sulphate
2.2硫酸酯化测定
从硫酸基标准曲线查出对应的浓度,换算成硫酸基的取代度,经计算硫酸酯化后香菇多糖SP2的取代度为0.87,回收率为88.6%。
2.2.1红外结果分析
对比图2为香菇多糖SP2的红外图谱,从图3可以看出,香菇多糖SP2硫酸酯在3 000~2 800 cm-1,1 400~1 200 cm-1范围内均有糖类化合物的特征吸收峰;在1 251.26 cm-1处出现了强的S=O不对称振动吸收峰;在805.62 cm-1处出现C-O-S拉伸振动峰,证明硫酸基已经与香菇多糖结合成酯。
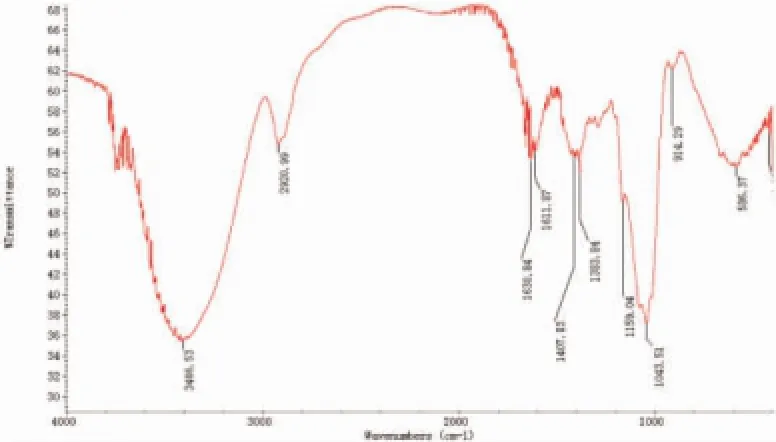
图2 香菇多糖SP2的红外图谱Fig.2 Infrared spectroscopy of SP2

图3 Wolfrom法硫酸酯化香菇多糖SP2的红外图谱Fig.3 Infrared spectroscopy of sulfated SP2 by Wolfrom method
2.2.2香菇多糖SP2硫酸酯化热分析
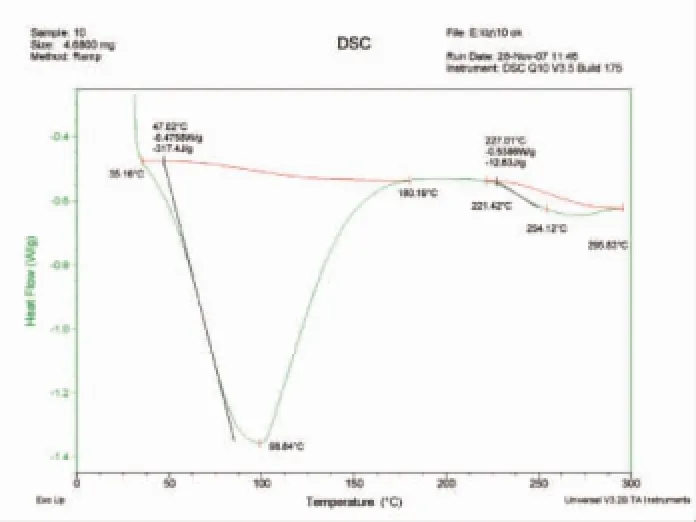
图4 香菇多糖SP2的DSC图谱Fig.4 DSC of lentinan SP2

图5 硫酸酯化香菇多糖SP2的DSC图谱Fig.5 DSC of sulfated SP2
由图5显示可知,硫酸酯化的香菇多糖SP2热焓变化分成了三个阶段,第一阶段65.37~136.82℃为吸热,焓变为50.80 J/g;第二阶段143.58~208.98℃为吸热,焓变为214.3 J/g;第三阶段227.11~249.85℃为放热,焓变为23.68 J/g。和香菇多糖(图4)相比较硫酸酯化的香菇多糖出现了放热峰,说明可能有氧化还原反应发生,表明硫酸基已经与香菇多糖结合成酯。
2.3羧甲基化测定
经计算羧甲基化后香菇多糖SP2的取代度为0.47,回收率为83.6%。
2.3.1红外结果分析
羧甲基化香菇多糖SP2的红外图谱如图6~7所示,与香菇多糖SP2的红外图谱如图6-6相比较,羧甲基化香菇多糖在3431.58 cm-1处有O-H伸缩振动吸收峰;3 180.48 cm-1处有C-H伸缩振动吸收峰;1 400.67 cm-1处有C-H变角振动吸收峰;上述三处均有糖类化合物的特征吸收峰;在1 618.51 cm-1处出现了羧基C=O非对称伸缩振动吸收峰;在1 331.33 cm-1处出现C=O对称伸缩振动吸收峰;在1 451.25 cm-1处为甲基的C-H变角振动吸收峰,此四处峰证明香菇多糖中羧甲基已经存在。
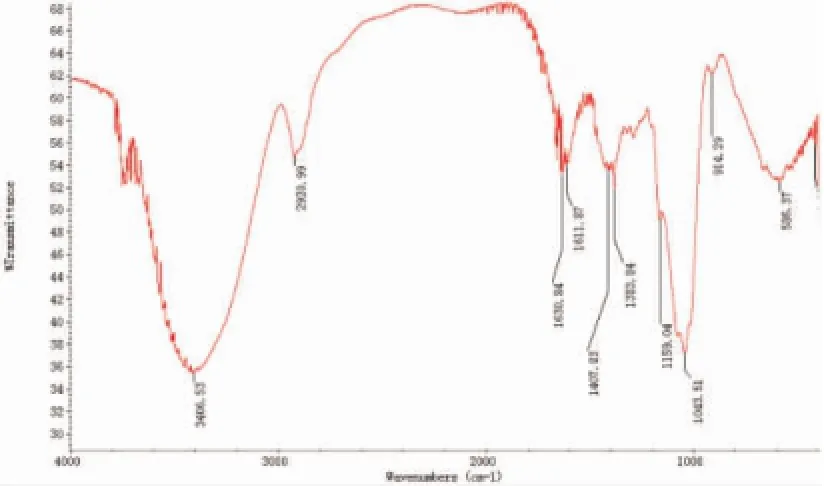
图6 香菇多糖SP2的红外图谱Fig.6 Infrared spectroscopy of SP2

图7 羧甲基化香菇多糖SP2的红外图谱Fig.7 Infrared spectroscopy of CM-SP2
2.3.2香菇多糖SP2羧甲基化热分析
从图9可以看出,羧甲基化的香菇多糖热焓变化分成了两个阶段,第一阶段59.33~193.70℃为吸热,焓变为270.7 J/g;第二阶段281.36~306.27℃为放热,焓变为26.78 J/g。香菇多糖和羧甲基化香菇多糖的第一个吸热峰,为脱去所带的结合水。和香菇多糖(图6-8)相比较羧甲基化的香菇多糖出现的第二个峰为放热峰,表明香菇多糖结合上了其它的基团。
3 结论
1)经过硫酸酯化后香菇多糖SP2的取代度为0.87,回收率为88.6%;羧甲基化后香菇多糖SP2的取代度为0.47,回收率为83.6%。
2)硫酸酯化后香菇多糖SP2经过红外光谱仪扫描,在1 251.26 cm-1处出现了强的S=O不对称振动吸收峰;在805.62 cm-1处出现C-O-S拉伸振动峰,证明硫酸基已经与香菇多糖SP2结合成酯。羧甲基化后香菇多糖SP2经过红外光谱仪扫描,在1 618.51 cm-1处出现了羧基C=O非对称伸缩振动吸收峰;在1 331.33 cm-1处出现C=O对称伸缩振动吸收峰;在1 451.25 cm-1处为甲基的C-H变角振动吸收峰,并且还存在糖链特征峰在3 431.58 cm-1处有O-H伸缩振动吸收峰;3 180.48 cm-1处有C-H伸缩振动吸收峰;1 400.67 cm-1处有C-H变角振动吸收峰;上述三处均为糖类化合物的特征吸收峰;证明香菇多糖SP2中羧甲基已经存在。

图8 香菇多糖SP2的DSC图谱Fig.8 DSC of lentinan SP2
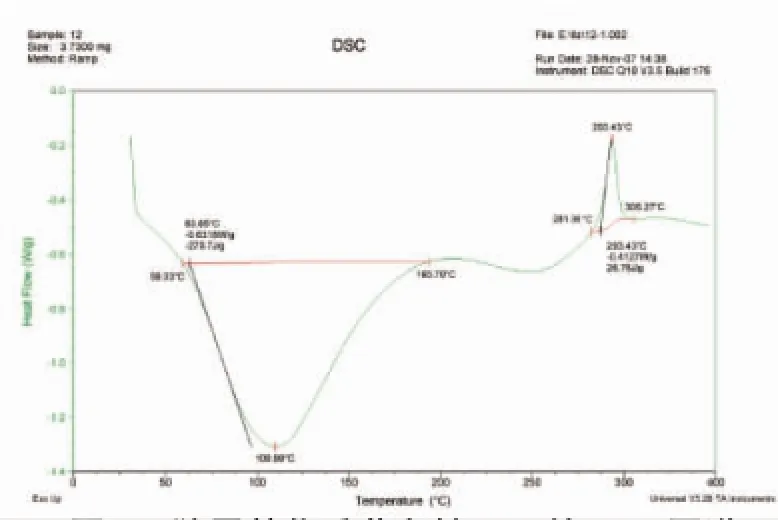
图9 羧甲基化香菇多糖SP2的DSC图谱Fig.9 DSC of CM-lentinan SP2
3)经过DSC对硫酸酯化香菇多糖SP2和羧甲基化香菇多糖SP2的测定后,所出的结果和香菇多糖SP2相比较,硫酸酯化香菇多糖SP2和羧甲基化香菇多糖SP2都热焓都发生了改变,并且都出现了放热峰,可进一步证明硫酸基和羧甲基加到了糖链上。
参考文献:
[1]MCCLURE M O,MOORE J P,BLANC D F,et al.Investigations into the mechanism by which sulfated polysaccharides inhibit HIV infection in vitro[J].AIDS research and human retroviruses,1992,8(1):19-26.
[2]INA K,KATAOKA T,ANDO T.The use of lentinan for treating gastric cancer[J].Anti-cancer Agents in Medicinal Chemistry,2013,13(5):681-688.
[3]ATTIA S M,HARISA G I,ABD-ALLAH A R,et al.The influence of lentinan on the capacity of repair of DNA damage and apoptosis induced by paclitaxel in mouse bone marrow cells[J].Journal of Biochemical and Molecular Toxicology,2013,27(7):370-377.
[4]ISODA N,EGUCHI Y,NUKAYA H,et al.Clinical efficacy of superfine dispersed lentinan(beta-1,3-glucan)in patients with hepatocellular carcinoma[J].Hepatogastroenterology,2009,56(90):437-441.
[5]BISEN P S,BAGHEL R K,SANODIYA B S,et al.Lentinus edodes:a macrofungus with pharmacological activities[J].Current Medicinal Chemistry,2010,17(22):2 419-2 430.
[6]CHIHARA G,MAEDA Y Y,HAMURO J,et al.Inhibition of mouse sarcoma 180 by polysaccharides from Lentinus edodes[J]. Nature,1969,222(5194):687-688.
[7]UENO Y,CHINO K,WATANABE M,et al.Homolytic carbocyclization by use of a heterogeneous supported organotin catalyst. A new synthetic route to 2-alkoxytetrahydrofurans and gamma-butyrolactones[J].J Am Chem Soc,1982,104(20):5 564-5 566.
[8]申进文,冯雅岚,庄庆利,等.香菇子实体多糖提取工艺优化研究[J].河南农业科学,2010,41(3):90-92.
[9]方积年.多糖的分离纯化及其纯度鉴别与分子量测定[J].药学通报,1984,19(10):46-49.
[10]王顺春,方积年.香菇多糖硫酸化衍生物的制备及生U结构分析[J].生物化学与生物物理学报,1999,31(5):594-596.
[11]燕航,钟耀广,王淑琴,等.硫酸酯化香菇多糖衍生物制备的研究[J].化学与生物工程,2006(3):44-45.
[12]颜邦干,李卫旗,吴学谦.香菇多糖的分子结构及其硫酸酯化改性的研究[J].中国食品学报,2006,6(5):11-16.
[13]郭振环,胡元亮,马霞.硫酸化香菇多糖对新城疫疫苗免疫效果的影响[J].南京农业大学学报,2010,33(1):76-80.
[14]张惠芬,樊建,束嘉秀,等.硫酸—蒽酮分光光度法测定SPS的方法研究[J].昆明理工大学学报,2002,27(3):74-83.
[15]周林,郭祀远,蔡妙颜,等.粘度法测定水溶液中裂褶多糖分子量[J].功能高分子学报,2005,18(4):692-695.
[16]张昕,张强,梁彦龙.香菇多糖的抗肿瘤和降糖作用机制的研究进展[J].中国药事,2008,22(2):149-154.
[17]栗衍华,谭成玉,王秀武,等.硫酸化多糖的制备及其生物活性的研究进展[J].精细与专用化学品,2006,14(16):6-9.
[18]卢成英,李国章,黄早成,等.香菇多糖提取纯化研究[J].中国林副特产,2006(4):24-27.
[19]田光辉.香菇多糖提取工艺的优化[J].延安大学学报:自然科学版,2002,21(1):46-47.
[20]刘成梅,付桂明,游海,等.百合多糖的纯化与化学结构鉴定研究[J].食品科学,2002,23(5):114-117.
[21]高石花,黎国庆,覃江克,等.油茶枯多糖的水提工艺及纯化研究[J].食品科技,2013(4):191-195.
[22]YANG W,PEI F,SHI Y,et al.Purification,characterization and anti-proliferation activity of polysaccharides from Flammulina velutipes[J].Carbohydrate Polymers,2012,88(2):474-480.
[23]BLUHM T L,SARKO A.The triple helical structure of lentinan,a linear β-(1→3)-D-glucan[J].Canadian Journal of Chemistry,1977,55(2):293-299.
[24]XU W T,ZHANG F F,LUO Y B,et al.Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J].Carbohydrate Research,2009,344(2):217-222.
Chemical Modification and Biological Activity of Polysaccharide from Lentinus edodes
MEI Guang-ming1,XUE Bin1,HAO Qiang2,et al
(1.Marine Fishery Research Institute of Zhejiang Province,Zhoushan316100;
2.Beijing HaiYan Pharmaceutical CO Ltd,Beijing102206,China)
Sulfated derivative and carboxy methylation was used for chemical modification of Polysaccharide from Lentinus edodes(SP2)and the degree of substitution of its reaction products was calculated,furthermore modified product characterization was present by infrared spectrometer and DSC scanner.The results indicated that degree of substitution of the SP2 developed by Sulfated derivative was 0.87 and its the recovery rate reached 88.6%;meanwhile the two values by carboxy methylation were respectively 0.47 and 83.6%;infrared spectrometer showed a novel characteristic absorption peak of corresponding reaction products which means that sulfated derivative and carboxy methylation?has been successfully developed;comparison modified products with SP2 by DSC scanner,their enthalpies of modified products Sulfated derivative and carboxy methylation have been changed that represent either sulfate group or carboxymethyl has been joint in oligosaccharide chain.
Lentinus edodes;polysaccharides;chemical modification
R285
A
1008-830X(2015)04-0335-05
2014-12-20
浙江省省属科研院所扶持专项(2012F20026);浙海渔计[2011]123号
梅光明(1984-),男,湖北黄冈人,工程师,硕士,研究方向:食品加工与质量安全控制.E-mail:meigm123@163.com
