补骨脂醇提物对大鼠尿内源性代谢产物的影响
2015-08-31汤响林梁乾德王宇光马增春肖成荣谭洪玲赵永红黄先菊中南民族大学药学院生理与药理教研室湖北武汉430000军事医学科学院放射与辐射医学研究所北京00850
胡 超,汤响林,李 杰,梁乾德,王宇光,马增春,肖成荣,谭洪玲,赵永红,黄先菊,高 月(.中南民族大学药学院生理与药理教研室,湖北武汉430000;.军事医学科学院放射与辐射医学研究所,北京 00850)
补骨脂醇提物对大鼠尿内源性代谢产物的影响
胡 超1,2,汤响林2,李杰2,梁乾德2,王宇光2,马增春2,肖成荣2,谭洪玲2,赵永红2,黄先菊1,高月2
(1.中南民族大学药学院生理与药理教研室,湖北武汉430000;2.军事医学科学院放射与辐射医学研究所,北京 100850)
目的 基于代谢组学的方法研究补骨脂醇提物(EEFP)对正常大鼠尿液内源性代谢产物的影响。方法 雄性SD大鼠每天1次分别ig给予EEFP 0.54,1.08和1.62 g·kg-1,连续给药2周,末次给药后收集12 h尿液。应用超高效液相色谱/四极杆飞行时间质谱(UPLC-Q-TOF-MS)分析尿液,MassLynx采集并处理数据,采用主成分分析(PCA)方法和偏最小二乘判别分析(PLS-DA)方法,分析各组大鼠内源性代谢产物的差别,通过正交偏最小二乘法(OPLS-DA)、变量重要程度(VIP)和t检验筛选潜在生物标志物并测定其相对含量。结果 PCA结果显示,各组样本点较好地聚合在一起,各EEFP给药组与空白对照组互相完全分离,且与空白对照组之间的距离随EEFP给药剂量的增加而增大;EEFP 0.54,1.08和1.62 g·kg-1中对甲酚葡糖苷酸和半乳糖-β-1,4-木糖相对含量分别为40.0±11.2,2.7±2.6,16.8±6.3和45.9±16.4,32.6±22.1,8.0±8.3,明显低于空白对照组的107.0±26.9和82.3±13.6(P<0.01);EEFP 1.08和1.62 g·kg-1中5-L-谷氨酰基-牛磺酸、葡萄糖酸内酯相对含量分别为22.4±10.0,47.6±19.1和138.2±18.8,337.3±64.0,明显高于空白对照组的2.6±1.6和20.5±6.8(P<0.01);EEFP 1.62 g·kg-1组D-泛酸-L-半胱氨酸相对含量为74.2±31.5,明显高于空白对照组的0.6±0.5(P<0.01);随EEFP给药剂量的增加,D-泛酸-L-半胱氨酸、5-L-谷氨酰基-牛磺酸和葡萄糖酸内酯含量呈升高的趋势(P<0.01),半乳糖-β-1,4-木糖和对甲酚葡糖苷酸含量呈下降的趋势(P<0.01)。结论 EEFP给药2周后,大鼠尿内源性物质有显著改变,与能量代谢、酪氨酸和牛磺酸代谢以及葡萄糖代谢有关。
补骨脂醇提物;代谢组学;生物标志物;尿
DOl:10.3867/j.issn.1000-3002.2015.06.009
中药补骨脂(Fructus Psoraleae)为豆科植物补骨脂(Psoralea corylifolia L.)的干燥成熟果实,其味辛、苦、温,归肾、脾经,具有温肾助阳、纳气平喘、温脾止泻之功效,历代中医用于肾虚、冷泻、遗滑精、小便频数、腰膝冷痛;外治用于皮肤病和白癜风等[1]。补骨脂的主要药效成分包括补骨脂素、异补骨脂素和补骨脂酚,而这些成分主要存在于醇提部位中[2]。补骨脂及其复方长期超剂量服用存在一定的毒性,包括肝毒性[3]和视网膜毒性[4]。
中药由于其成分复杂,多靶点作用于机体的特性,从而对其药效和毒性机制的研究带来了一定的难度。近代研究表明,代谢组学在中药成分及中药作用机制的研究中显示出优越性[5-6]。本研究采用基于超高效液相色谱/四极杆飞行时间质谱(ultraperformance liquid chromatography/quadrupole-timeof-flight mass spectrometry,UPLC-Q-TOF-MS)代谢组学的方法,研究补骨脂醇提物(ethanol extract of Fructus Psoraleae,EEFP)连续灌胃2周后,对大鼠尿液内源性代谢产物的影响,并寻找潜在生物标志物,为进一步阐释补骨脂的药效和毒效机制提供依据。
1 材料与方法
1.1 药品、试剂与仪器
补骨脂(产于甘肃,批号:133229),经军事医学科学院马百平教授鉴定为Fructus Psoraleae,乙腈(色谱纯,美国Fisher Scientific公司),水(纯净水,中国哇哈哈公司),甲酸(色谱级,德国Mreda Technology公司),羧甲纤维素钠(MCCNa,中国国药集团化学试剂有限公司)。
Acquity UPLC-Synapt MS色谱-质谱联用仪Acquity UPLC HSS T3(2.1 mm×100 mm,1.8 μm,美国 Watrers公司)、冷冻离心机(Heraeus Labofuge 400R,美国Thermo Scientific公司)、旋蒸仪(Basis Hei-VAP ML,德国Heidolph公司)。
1.2 补骨脂醇提物的制备
采用70%乙醇渗漉提取,称取补骨脂药材4.188 kg,置于渗漉筒中,加入2倍量70%乙醇浸泡12 h,以32 mL·min-1的速度渗漉,收集15倍量渗漉液,减压旋转蒸干,得稠浸膏931 g,提取率为22.23%。通过UPLC-Q-TOF-MS获得其指纹图谱并鉴定其主要活性成分。
1.3 动物分组及给药
SD雄性大鼠24只,体质量180~220 g,购于军事医学科学院实验动物中心,许可证号:SCXK-(军)2012-0004。大鼠饲养于军事医学科学院SPF级动物房中,适应1周后,随机分为空白对照组和EEFP 0.54,1.08和1.62 g·kg-1组(分别相当于成人给药剂量的2,4和6倍)。药物用1%CMCC-Na悬浮,给药方式为灌胃,给药体积为5 mL·kg-1,每天ig 1次,连续给药2周。
1.4 尿液采集与处理
末次灌胃后,将大鼠置于代谢笼中,收集12 h尿液,5 353×g离心10 min,分别取1 mL上清液于EP管中,加入20 μL叠氮钠,置于-80℃冰箱中保存。
实验前,取出样品常温下解冻。各取500 μL解冻后的样本,加入100 μL的乙腈,涡旋混匀,静置1 min,4℃下16 060×g离心15 min,取上清液经微孔滤膜滤过后进样。
1.5 质控样品的制备
从所有样品中分别取100 μL混匀,取500 μL混合液按1.4中方法处理即得质控样品(quality control,QC)。QC样品于样品分析前进样1次,然后每隔6个样品进样1次,一共进样5针。
1.6 色谱质谱条件
流动相:0.1%甲酸水溶液(A),0.1%甲酸乙腈溶液(B),流速:0.5 mL·min-1,进样量:5 μL,柱温:30℃,运行20 min,洗脱条件如下:0~1 min(2% B),1~2 min(2%~5%B),2~5 min(5%~12%B),5~10 min(12%~20%B),10~12 min(20%~30% B),12~13 min(30%~50%B),13~15 min(50%~100%B),15~16 min(100%B),16~17 min(100%~2%B),17~20 min(2%B)。
采用电喷雾电离离子源,参数设置如下:毛细管电压为3.0 kV(ES+)、2.9 kV(ES-),脱溶剂温度450℃,脱溶剂气体流速900 L·h-1,锥孔气流量50 L·h-1。通过MassLynx V4.1质谱工作站采集数据和输出数据。
1.7 数据处理
将所得样品数据导入MarkerLynx XS处理,采用无监督模式识别方法即主成分分析法(principal component analysis,PCA)和监督模式识别方法即偏最小二乘判别分析法(partial least squares-discriminant analysis,PLS-DA)分析,通过正交偏最小二乘判别分析法(orthogonal PLS-DA,OPLS-DA)的得分图可形象的观察到空白组与各给药组尿液成分的分布情况及差异,选择变量重要程度(variable importance in the projection,VIP)>3的变量进行t检验,在95%的置信度下变量内空白对照组与给药组具有显著性差异(P<0.5)的变量为有效信号。
1.8 标志物的鉴别
将处理得到的有效信号与自建数据库(由梁乾德博士建立)匹配,过滤掉外源性物质的信息,保留内源性物质的信息,再通过查找HMDB和KEGG在线数据库,比对质荷比、保留时间及质谱图,初步确定可能的生物标志物结构信息。
1.9 统计学分析
2 结果
2.1 补骨脂醇提物指纹图谱及主要成分鉴定
图1 A和B分别为EEFP的全波长紫外(photo diode array,PDA)图及正离子模式下的总离子流图(total ion chromatograms,TIC),4种主要活性成分的一级质谱图如图1C,D,E,F所示,通过与标准品质谱图比对,它们分别为补骨脂素、异补骨脂素、补骨脂乙素和补骨脂酚。
2.2 给EEFP后大鼠尿UPLC-Q-TOF-MS代谢指纹图谱
图2和图3分别为EEFP给药后大鼠尿样正、负离子模式下的TIC。与空白对照组比较,EEFP组代谢指纹图谱均表现出一定的差异,各给药组之间也表现出一定的差异性,其中EEFP 1.08和1.62 g·kg-1组变化较为明显,尤以保留时间11~15 min变化最为显著。
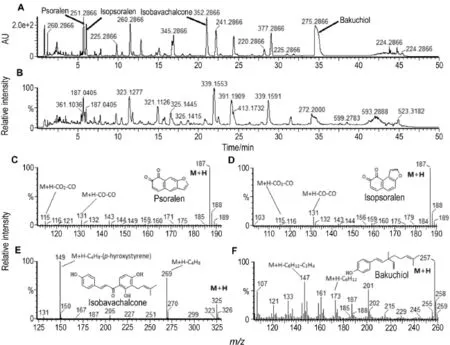
Fig.1 Photo diode array(A)and total ion chromatograms(TlC)fingerprints(B)of the ethanol extract of Fructus Psoraleae(EEFP)in positive ion mode and mass spectra of psoralen(C),isopsoralen(D),isobavachalcone(E)and bakuchiol(F).
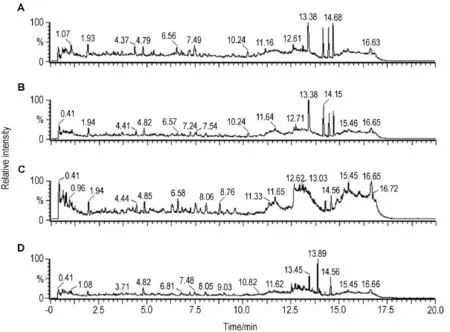
Fig.2 Ultra-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry(UPLC-Q-TOF-MS)TlC profiles of urine samples after rats were ig administered with EEFP for 2 weeks in positive ion mode.A:blank control group;B,C and D:EEFP 0.54,1.08 and 1.62 g·kg-1groups,respectively.
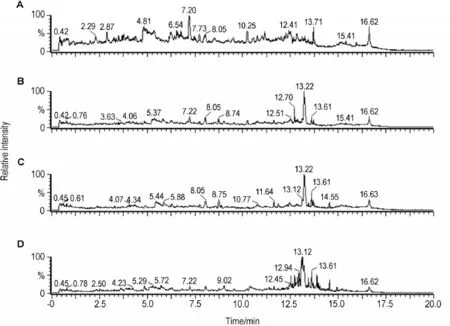
Fig.3 UPLC-Q-TOF-MS TlC profiles of urine samples after rats were ig given EEFP for 2 weeks in negative ion mode.A:blank control group;B,C and D:EEFP 0.54,1.08 and 1.62 g·kg-1groups,respectively.
2.3 方法学验证
如图4所示,正、负离子模式下的QC样品聚成一团;另外分别选择正、负离子模式4个离子,对它们的保留时间和峰面积进行分析,正、负离子模式下保留时间的相对标准偏差分别为0%~0.18%和0%~0.65%,峰面积相对标准偏差分别为0.52%~3.57%和5.15%~6.16%。
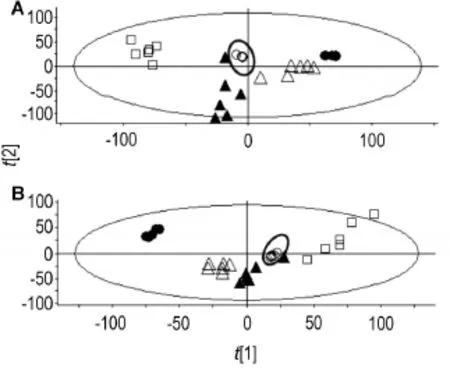
Fig.4 Principal component analysis(PCA) score plots of quanlity control(QC)samples in ES+(A)and ES-(B).○:QC samples;●:blank control group;△:EEFP 0.54 g·kg-1group;▲:EEFP 1.08 g·kg-1group;□:EEFP 1.62 g·kg-1group.
以上结果显示,本实验方法重复性和稳定性良好,可用来进行大批量的代谢组学实验。
2.4 EEFP对大鼠尿内源性代谢产物影响的组学分析
PCA分析法结果见图5(A,B),各组样本点较好地聚合在一起,EEFP 0.54,1.08和1.62 g·kg-1组样本点均与空白对照组样本点完全分离,各给药组样本点与空白对照组样本点的距离随给药浓度的增加而增大,说明给药后大鼠尿液中内源性物质的代谢发生明显的变化,且呈剂量依赖性关系,同时空白对照组和各给药组样本分布较为分散,说明组内差异较大。
PLS-DA分析结果如图5(C,D)所示,各组样本点按照组别差异聚拢,相互靠近,说明PLS-DA分析法能很好地消除组内差异,保留组间差异。
选取EEFP高剂量组和空白对照组进行OPLSDA分析比较,确定主要差异性变量。两组的OPLS-DA得分及变量重要程度(VIP)见图6,每个点代表一个变量,S-Plot图横坐标代表变量的贡献度(协方差),纵坐标代表变量的相关性(可信度),取值在-1~+1。S-Plot图中离原点越远的点,表示其差异性越明显;VIP值越高,表示该变量对模型的贡献度越高。
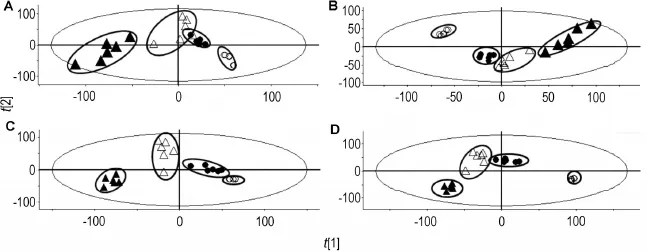
Fig.5 PCA score plots(A,B)and PLS-DA score plots(C,D)about EEFP on endogenous metabolites after rats were ig given EEFP for 2 weeks in ES+(A,C)and ES-(B,D).○:blank control group;●:EEFP(0.54 g·kg-1)group;△:EEFP 1.08 g·kg-1group;▲:EEFP 1.62 g·kg-1group.
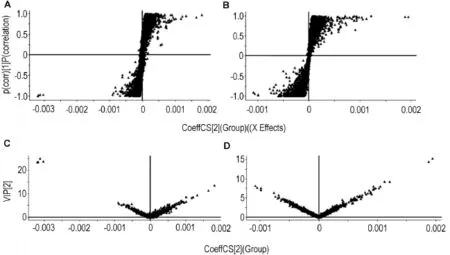
Fig.6 S-plots(A,B)and VlP plots(C,D)associated with theOPLS-DA obtained for the data derived from the blank control group(A,C)and EEFP-treated group(1.62 g·kg-1)after rats were ig given EEFP for 2 weeks in ES+(A,C)and ES-(B,D).
2.5 可能受EEFP影响的大鼠尿内源性物质
选取S-Plot图中横坐标绝对值>0.001,纵坐标绝对值>0.8的变量,通过比对质荷比、保留时间及质谱图,共鉴定出5种物质,其结果见表1,它们分别是D-泛酸-L-半胱氨酸、5-L-谷氨酰基-牛磺酸、葡萄糖酸内酯、半乳糖-β-1.4-木糖和对甲酚葡糖苷酸。
2.6 EEFP对大鼠尿中5种内源性代谢性产物含量的影响
如表2所示,EEFP 0.54,1.08和1.62 g·kg-1组中对甲酚葡糖苷酸和半乳糖-β-1.4-木糖的相对含量明显低于空白对照组(P<0.01);EEFP 1.08和1.62 g·kg-1组中5-L-谷氨酰基-牛磺酸、葡萄糖酸内酯相对含量明显高于空白对照组(P<0.01);EEFP 1.62 g·kg-1组D-泛酸-L-半胱氨酸相对含量明显高于空白对照组(P<0.01);另外,随EEFP给药剂量的增大,大鼠尿液中5-L-谷氨酰基-牛磺酸、葡萄糖酸内酯及D-泛酸-L-半胱氨酸含量呈升高趋势(P<0.01),而半乳糖-β-1.4-木糖和对甲酚葡糖苷酸的含量呈减少趋势(P<0.01)。
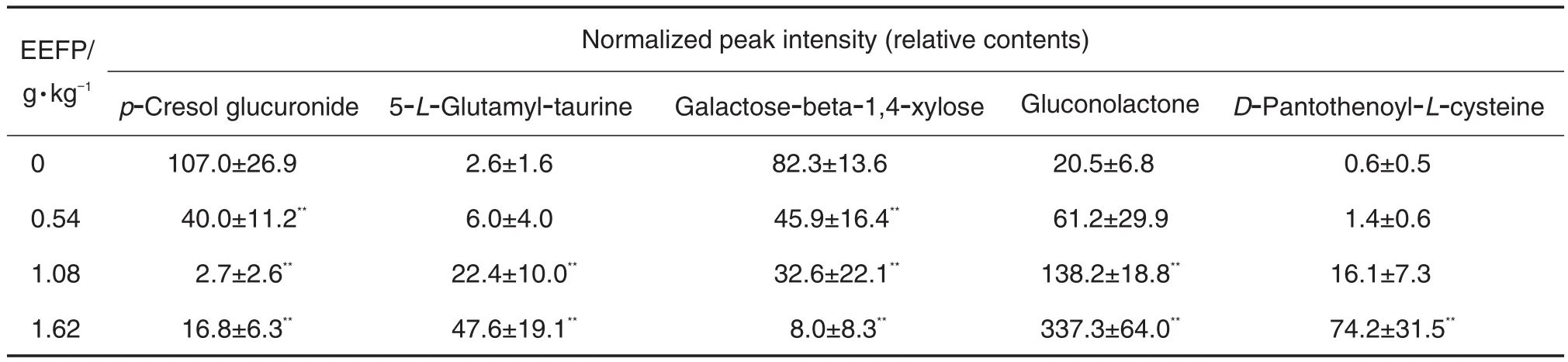
Tab.2 Effect of EEFP on the contents of p-cresol glucuronide,5-L-glutamyl-taurine,galactose-beta-1.4-xylose,gluconolactone and D-pantothenoyl-L-cysteine in urine of rats
3 讨论
本研究结果显示,给药后各组大鼠的代谢轮廓均发生了明显的变化,初步筛选出5种生物标志物,它们分别是D-泛酸-L-半胱氨酸、5-L-谷氨酰基-牛磺酸、葡萄糖酸内酯、半乳糖-β-1,4-木糖和对甲酚葡糖苷酸。
D-泛酸-L-半胱氨酸参与了辅酶A的合成[7],而辅酶A是一种含有泛酸的辅酶,它能激活体内的物质代谢,加强物质在体内的氧化并供给能量[8]。与空白对照组比较,D-泛酸-L-半胱氨酸在各给药组均呈明显的升高趋势,说明了EEFP能促进机体能量代谢。
5-L-谷氨酰基-牛磺酸是牛磺酸和次牛磺酸的中间代谢产物,与空白对照组比较,其在各给药组中呈升高的趋势,说明EEFP能引起体内牛磺酸含量升高。牛磺酸是广泛分布于动物组织细胞内的氨基酸,是机体内含量最丰富的游离氨基酸,牛磺酸在体内的合成是通过半胱亚磺酸脱羧酶的作用,由半胱氨酸而来[9]。研究表明运动可使自由基增加,脂质过氧化反应增强,损伤组织细胞膜,补充牛磺酸能阻抑这种改变,提高运动能力[10]。
葡萄糖酸内酯是葡萄糖氧化生成的一种衍生物,其在各给药组中呈升高的趋势。研究表明,葡萄糖酸内酯能清除氧自由基,保护皮肤免受紫外照射的伤害[11]。另外,半乳糖-β-1,4-木糖和对甲酚葡糖苷酸在各给药组中呈下降趋势,其中对甲酚葡糖苷酸是酪氨酸的代谢产物,酪氨酸在体内代谢生成对甲酚,对甲酚主要以硫酸盐和葡糖苷酸结合形式从肾排出体外。研究表明,对甲酚可作为一个评价肾功能的重要标志物,其在体内蓄积可致肾毒性[12]。半乳糖-β-1,4-木糖属于二糖,是葡糖氨基聚糖类(glycosaminoglycans,GAG)的降解产物,而GAG是蛋白聚糖类的主要物质,蛋白聚糖广泛存在于细胞表面和细胞外基质,在细胞生长和分化方面起着重要的作用。
通过分析上述5种生物标志物,D-泛酸-L-半胱氨酸和5-L-谷氨酰基-牛磺酸与能量代谢有关,这两种物质在给药后呈升高趋势,说明EEFP可促进机体能量代谢,这与邹润等[13]研究发现EEFP具有缓解疲劳的作用具有一致性。葡萄糖酸内酯升高提示糖代谢过程增强,由于其能够清除氧自由基,保护皮肤免受紫外照射的伤害,这可能也是其用于治疗皮肤病的原因所在。对甲酚葡糖苷酸和半乳糖-β-1,4-木糖给药后呈下降趋势,其中对甲酚葡糖苷酸是对甲酚的肾排泄形式,对甲酚葡糖苷酸在尿中含量减少,提示其肾排泄可能遭受障碍;半乳糖-β-1,4-木糖是葡糖氨基聚糖类的降解产物,其在尿中减少,说明机体内细胞的生长和分化受到抑制,而肝是细胞生长和分化最活跃的部位,提示其可能与肝毒性有关。
本研究基于UPLC-Q-TOF-MS的代谢组学方法从整体尿液代谢表型及其相关代谢产物的角度初步探索了EEFP药效和毒效机制,所建立的方法可以为传统中药的药效和毒性评价提供一定的参考。
[1]Qiu RL,Li L,Yue W.Advances in chemical composition and pharmacological action research of Fructus Psoraleae[J].J Chin Med Mater(中药材),2010,33(10):1656-1659.
[2]Cheung WI,Tse ML,Ngan T,Lin J,Lee WK,Poon WT,et al.Liver injury associated with the use of Fructus Psoraleae(Bol-gol-zhee or Bu-gu-zhi)and its related proprietary medicine[J].Clin Toxicol (Phila),2009,47(7):683-685.
[3]Nam SW,Baek JT,Lee DS,Kang SB,Ahn BM,Chung KW.A case of acute cholestatic hepatitis associated with the seeds of Psoralea corylifolia (Boh-Gol-Zhee)[J].Clin Toxicol(Phila),2005,43 (6):589-591.
[4]Shen GQ,Gong CY.A case of blurred vision associated with the long-term use of Fructus Psoraleae[J].Pharm Clin Res(药学与临床研究),2009,17 (3):260.
[5]Yuan PF,Shang MY,Cai SQ.Study on fingerprints of chemical constituents of Ramulus Cinnamomi andCortexCinnamomi[J].ChinaJChin Mater Med(中国中药杂志),2012,37(19):2917-2921.
[6]Wu PP,Huo SX,Gao L,Li JM,Lin J,Cai LM,et al. Pharmacokinetic study on acetoside in rats[J]. China J Chin Mater Med(中国中药杂志),2012,37 (21):3312-3315.
[7] de Villiers M,Barnard L,Koekemoer L,Snoep JL,Strauss E.Variation in pantothenate kinase type determines the pantothenamide mode of action and impacts on coenzyme A salvage biosynthesis [J].FEBS J,2014,281(20):4731-4753.
[8]Shi RF,Yuan HP.The regulation of malonyl-COA in energy metabolism during exercise[J].J Tianjin Inst Phys Educ(天津体育学院学报),2000,15 (3):22-24.
[9]Jin WY.The physiological function of taurine[J]. China Feed Addict(饲料与添加剂),2014,(23):26-27.
[10]Li LM,Wang BB,Wei Y.Effect of exhaustive swimming on serum enzyme activities and free radical metabolisms of various muscle fibers in rats[J]. Life Sci Res(生命科学研究),1997,1(1):60-64.
[11]Bernstein EF,Brown DB,Schwartz MD,Kaidbey K,Ksenzenko SM.The polyhydroxy acid gluconolactone protects against ultraviolet radiation in an in vitro modelofcutaneousphotoaging[J].Dermatol Surg,2004,30(2 Pt 1):189-195,196.
[12]Salmean YA,Segal MS,Palii SP,Dahl WJ.Fiber supplementation lowers plasma p-cresol in chronic kidney disease patients[J].J Ren Nutr,2015,25 (3):316-320.
[13]Zou R,Liang LL,Zhang CF,Yang ZL.Study on alcohol extract and water decoctionof Psoralea corylifolia for anti-fatigue[J].Asia-Pac Tradit Med(亚太传统医药),2014,10(6):17-19.
Corresponding authors:HUANG Xian-ju,Tel:13986035659,E-mail:huangxianju1972@yahoo.cn;GAO Yue,Tel:(010)66931312,E-mail:gaoyue@bmi.ac.cn
(本文编辑:乔 虹)
Effect of ethanol extract of Fructus Psoraleae on urinary endogenous metabolites of rats
HU Chao1,TANG Xiang-lin2,LI Jie2,LIANG Qian-de2,WANG Yu-guang2,MA Zeng-chun2,XIAO Cheng-rong2,TAN Hong-ling2,ZHAO Yong-hong2,HUANG Xian-ju1,GAO Yue2
(1.Department of Physiology and Pharmacology,College of Pharmacy,South Central University for Nationalities,Wuhan 430000,China;2.Institute of Radiation Medicine,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTlVE To study the effect of the ethanol extract of Fructus Psoraleae(EEFP)on endogenous metabolites in rat urine based on metabolomics.METHODS Male SD rats were orally administered with EEFP at the doses of 0.54,1.08 and 1.62 g·kg-1,respectively,once a day for two consecutive weeks.Urine samples were collected for 12 h after the last administration.Data were acquired with the MassLynx software based on ultra-performance liquid chromatography quadrupoletime-of-flight mass spectrometry(UPLC-Q-TOF-MS).The principal component analysis(PCA)and partial least squares-discriminant analysis(PLS-DA)were used to analyze the difference of endogenous metabolites in different groups,then putative biomarkers were found through the orthogonal partial least-squares-discriminant analysis(OPLS-DA),variable importance in the projection(VIP)and t test and their relative intensity were determined.RESULTS The results of PCA showed that samples of each group were clustered,all the groups were separated,and that the distance between the EEFP groups and the blank control group was increased in a dose-dependent manner.The relative contents of p-cresol glucuronide and galactose-beta-1,4-xylose were 40.0±11.2,2.7±2.6,16.8±6.3 and 45.9± 16.4,32.6±22.1,8.0±8.3 in the EEFP 0.54,1.08 and 1.62 g·kg-1groups,respectively,significantly lower than those of the control group,which were 107.0±26.9 and 82.3±13.6(P<0.01),respectively.The relative contents of 5-L-glutamyl-taurine,and gluconolactone were 22.4±10.0,47.6±19.1 and 138.2± 18.8,337.3±64.0 in EEFP 1.08 and 1.62 g·kg-1groups,respectively,significantly higher than those of the blank control group,which were 2.6±1.6 and 20.5±6.8,respectively(P<0.01).The relative content of D-pantothenoyl-L-cysteine was 74.2±31.5 in the EEFP 1.62 g·kg-1group,significantly higher than that in the blank control group(0.6±0.5)(P<0.01).As the dose of EEFP increased,D-pantothenoyl-L-cysteine,5-L-glutamyl-taurine,and gluconolactone had an upward trend(P<0.01),while galactosebeta-1,4-xylose and p-cresol glucuronide had a downward trend(P<0.01).CONCLUSlON The twoweek administration of EEFP has effect on the endogenous metabolites in urine.The substances identified are mainly related to energy metabolism,taurine,tyrosine and glucose metabolism.
ethanol extract of Fructus Psoraleae;metabolomics;biomarkers;urine
The project supported by National Science and Technology Major Project(2014ZX09304307001-003)
R969.1,R285.5
A
1000-3002(2015)06-0931-08
国家科技重大专项(2014ZX09304307001-003)
胡 超,男,硕士,主要从事中药毒理研究,Tel:(010)66930267,E-mail:1054013690@qq.com
黄先菊,E-mail:huangxianju1972@yahoo.cn,Phn:13986035659;高月,E-mail:gaoyue@bmi.ac.cn,Tel:(010)66931312
(2015-04-03接受日期:2015-07-02)
