足叶乙苷为基础的方案在中国复发性肾母细胞瘤极高危组患儿中的应用经验及文献复习
2015-08-28蔡炜嵩马赛男
王 倩,蔡炜嵩,吴 荣,马赛男
0 引言
肾母细胞瘤(Wilms tumor,WT)为儿童泌尿系统中最常见的恶性肿瘤,发病高峰为2~4岁。多数患儿的首发症状为明显的腹部包块、腹痛、恶心、呕吐、精神萎靡、发热及高血压等,肉眼或镜下血尿也较为常见[1-2]。现代手术、放化疗等多种手段综合治疗使儿童WT总生存率(OS)显著提高至 90%[1]。
然而,约10% ~15%的预后良好型及50%的间变型肿瘤仍会复发[3-4]。肿瘤间变,SIOP分级标准中的高风险组及初始治疗中含有阿霉素,染色体1p16q的杂合性缺失多提示复发后预后不良。而复发时间及复发部位的意义相对较小[1,3]。
对于复发性WT中危组及高危组的治疗研究较多,经典药物多为环磷酰胺、异环磷酰胺、顺铂、卡铂及依托泊苷,OS多波动在 24% ~30%[1,5-7]。许多研究热点也集中于高强度化疗(HDT)联合自身造血干细胞移植(HSCR),有关文献报道OS可提高至60%[3,6-7],但其确切疗效仍存在争议。然而,复发性肾母细胞瘤极高危组的治疗仍存在空白,与其本身对单药或联合用药的反应性极差相关。一些新型药物,如紫杉醇、奥沙利铂、塞替哌等的应用仍处在实验阶段,但效果不尽人意。
上世纪80年代,一项Ⅱ期临床试验得出足叶乙苷对复发性或难治性肾母细胞瘤有效。随着对复发性肾母细胞瘤的不断认识及研究,现证明多种以足叶乙苷为基础的方案有效,如足叶乙苷联合顺铂;足叶乙苷联合卡铂;足叶乙苷联合异环磷酰胺;足叶乙苷、卡铂联合异环磷酰胺(ICE);环磷酰胺/足叶乙苷和卡铂/足叶乙苷轮替应用。
本文报道了3例复发性WT极高危组患儿应用足叶乙苷为基础方案的治疗经验,足叶乙苷的剂量为100 mg/(m2·d),d1 ~5,每21 天为1 个周期。3例患儿均不同程度从中获益。
1 病例资料
病例1:患儿,女,8岁。主诉为腹痛,CT提示左肾区肿物。遂行左肾肿物切除术。术后病理提示肾母细胞瘤,胚基为主型(高风险组)-预后不良型。腹部淋巴结转移。头、胸、腹部CT提示无转移病灶,根据国际肾母细胞瘤治疗协会(NWTSG)肿瘤分期为Ⅲ期,遂初始治疗为DD-4A方案联合30 Gy放疗。初次诊断后5个月后疾病进展,曾应用单药伊立替康一线治疗。于初次诊断后10个月再次进展(图1a),遂更换足量足叶乙苷[100 mg/(m2·d),d1 ~5]联合异环磷酰胺[1 800mg/(m2·d),d1 ~5]二线治疗,治疗过程中经历Ⅳ度骨髓抑制,故第2周期减量至原剂量的80%,而后未再经历Ⅲ~Ⅳ级血液学毒性及严重肾小管毒性。第3周期开始前复查腹部CT(图1b),提示肝转移病灶明显缩小,部分不可见,达到PR。为进一步提高生存周期,该患儿转入介入病房行肿瘤射频消融术,最终无病进展期为280 d。
病例2:患儿,男,7岁。以“发现腹部包块3周”为主诉入我院。CT提示右肾巨大占位。结合病史考虑肾母细胞瘤可能性大,遂行肿瘤姑息切除术,术中见肿瘤浸润右肝叶、膈肌、第一肝门以及腔静脉,姑息性切除后,在第一肝门处有残留。术后病理:(右)肾母细胞瘤(混合型)-预后良好型,分期为Ⅳ期。术后行长春新碱、更生霉素、表柔比星化疗联合放射治疗(25.5 Gy)。术后几个月后一线治疗结束。术后11个月,CT发现肝脏巨大占位。分别经历了伊立替康单药、紫杉醇联合卡铂化疗,于初次诊断后17个月疾病再次进展(图2a),因患儿曾经历多线治疗,肝功能受损,故予减量应用足叶乙苷100 mg/(m2·d),d1~4联合异环磷酰胺1 800 mg/(m2·d),d1~4治疗。5个周期后病灶明显缓解(图2b),达PR,在5个周期治疗期间,共经历2次Ⅲ~Ⅳ级血液学毒性,应用集落刺激因子治疗后缓解,未经历严重肾小管毒性。无病进展生存期为324 d。
病例3:患儿,男,4岁。因发现腹部包块1月余完善CT检查时,发现左肾占位伴双肺转移可能性大。姑息性左肾肿物切除术后,术后病理提示左肾母细胞瘤(胚基型)-预后不良型,术后予DD-4A方案化疗,分别于化疗结束后6、7个月完成肺转移癌切除术。初次诊断4年后复查胸部CT(图3a),发现纵隔巨大占位,即开始足量应用顺铂30 mg/(m2·d)d1~5,联合足叶乙苷100 mg/(m2·d)d1~5治疗。2个周期后病灶开始逐渐缩小,第9周期前复查(图3b),提示病灶继续缩小,达PR。10个周期后复查进展,治疗过程中未经历Ⅲ~Ⅳ骨髓抑制及肾小管毒性,无病进展生存期为279 d。见图3。
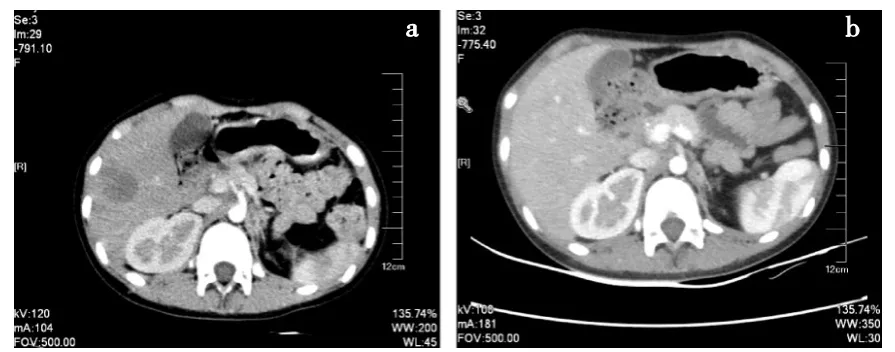
图1 病例1 CT结果
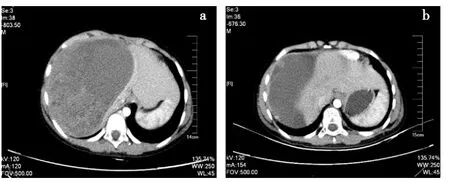
图2 病例2 CT结果
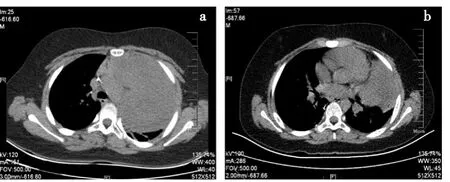
图3 病例3 CT结果
2 讨论
在既往肾母细胞瘤治疗经验中,多按照肿瘤分期/病理类型进行肿瘤危险度分级而指导治疗,越来越多的研究显示,该分级方式不能准确分类所有患者,故需更精确的亚组来指导治疗。美国小儿肿瘤协会(COG)建议的肿瘤危险度分级还包括患儿年龄、肿瘤质量、肿瘤组织是否存在1p16q杂合性缺失(LOH)以及肿瘤对治疗反应速率,具体见表1。根据国际小儿肿瘤研究协会(SIOP)、COG、英国小儿肿瘤协会(UKCCSG)等临床试验结果,一些治疗共识初步达成,现复习如下。
对于Ⅰ期/预后良好型WT患儿,年龄<2岁且肿瘤重量<550 mg的亚组仅需接受术后治疗,而其他亚组术后需接受长春新碱及更生霉素联合化疗(EE-4A方案),根据NWTS-2及NWTS-3试验结果,6个月的用药时长为最有效且毒性最低的方案。而SIOP同样支持上述两种用药,但分别应用于术前术后共8周,且研究表明,术前应用4周新辅助可达最佳疗效。
对于Ⅱ期/预后良好型WT,NWTS-3建议为减少潜在毒性,该组患儿仍然应用长春新碱及更生霉素联合化疗,无需应用阿霉素及术后放疗。而COG最近临床试验建议对于该组应再区分出一个亚组,即1p16q杂合性缺失组,应需加用阿霉素(DD-4A)方案。SIOP93-01试验仍建议新辅助化疗,尤其对于复发高风险组,予术前4周长春新碱联合更生霉素,术后应用4周期长春新碱、更生霉素联合阿霉素方案,对于淋巴结阳性患儿,应加用术后辅助放疗。

表1 COG最新肾母细胞瘤分级
对于Ⅲ期/预后良好型WT,NWTS-3提示以下两种治疗方案预后最好,即①长春新碱、更生霉素及阿霉素(DD-4A)方案联合术后10 Gy放射治疗;②长春新碱及更生霉素联合20 Gy放射治疗。COG近期临床试验AREN0533建议区分出1p16q杂合性缺失组,应用长春新碱、更生霉素、阿霉素、及环磷酰胺和足叶乙苷,共33周,11个周期,即为M方案,并联合放疗。而SIOP对于该组患儿治疗同Ⅱ期/预后良好型,但术后常规行放射治疗。
对于Ⅳ期/预后良好型,COG开展的AREN0533临床试验建议先应用6周DD-4A方案而后评估,若肺部转移灶快速反应(肺转移灶在影像学上完全消失),则继续应用DD-4A方案,反之,更换为M方案。SIOP同样支持该治疗模式。
对于预后不良型WT的治疗仍是一个临床挑战。针对Ⅰ期局部或弥漫间变型WT亚组,患儿在NWTS-5试验中接受长春新碱联合更生霉素共18周治疗,得到4年EFS为69.9%(n=29),该数据不如NWTS-4(加用阿霉素)得到数据(n=21;2年EFS,87.5%或93.8%)。故在COG近期开展的AREN0321试验中对于该亚组患儿应用DD-4A方案。而针对Ⅱ~Ⅳ期/预后不良型亚组,CNR/AIEOP92临床试验加用了异环磷酰胺、足叶乙苷和卡铂作为附加药物,同时联合放疗,得到5年总OS为88%,5年总 EFS为79%,各期5年 OS(EFS)分别为:Ⅰ期 87%(93%),Ⅱ期 81%(93%),Ⅲ期 75%(82%),Ⅳ期 61%(75%)。NWTS-5对局部间变型WT患儿应用Ⅰ方案(长春新碱、更生霉素、环磷酰胺、足叶乙苷)联合10.8 Gy放疗,尽管生存率较NWTS-4相比有所提高,但与个体差异是否相关仍不清楚。在COG开展的AREN0321试验中,Ⅱ~Ⅲ期/局部间变型WT患儿接受 DD-4A方案,而Ⅳ期/局部间变型及Ⅱ~Ⅳ期/弥漫间变型(无可预测疾病者)WT患儿接受30周的UH-1方案(环磷酰胺、卡铂、足叶乙苷,长春新碱、阿霉素、环磷酰胺),若Ⅳ期/弥漫间变型WT患儿同时伴有可预测疾病,则应用2个周期伊立替康/长春新碱后评估病情,再决定是否应用 UH-1 方案[8-12]。
而对于复发性肾母细胞瘤,需要重新分组,多根据病理类型及初始治疗分为以下3组:①中危组:病理类型为预后良好型且初始治疗仅包括长春新碱和/或更生霉素,此组的无进展生存率(EFS)为70% ~80%。②高危组:病理类型为预后良好型且初始治疗应用3种或以上药物。此时EFS为40% ~50%。③极高危组:病理类型为预后不良型;接受过至少4种化疗药物;经历初次复发后进一步进展或复发。该组EFS仅为10%左右[1,3,13]。本文中 3 例患者均属极高危组,无论对单药还是联合用药反应性差,预后差。尽管现有证据可提示环磷酰胺、异环磷酰胺、顺铂、卡铂和足叶乙苷单药或联合用药对复发性WT高危组有效,但普通剂量还是高剂量化疗,是否联合自体干细胞移植仍无定论。且对极高危组仍无高级别用药证据。
足叶乙苷是拓扑异构酶Ⅱ抑制剂,在一些临床前试验中证明对多种肿瘤细胞有效,如白血病、淋巴瘤、生殖细胞瘤和小细胞肺癌[14]。在一项Ⅱ期临床试验中,同样证明其对复发性或难治性WT有效[15]。也有试验证明异环磷酰胺及顺铂对复发性WT有效,且联合应用上述药物有明确的疗效,但最佳联合方式、用药剂量、用药间隔及周期仍需进一步探索。
足叶乙苷联合铂类对多种儿童肿瘤有效,包括髓母细胞瘤、神经母细胞瘤、肾母细胞瘤、生殖细胞肿瘤、横纹肌肉瘤及视神经母细胞瘤[16-21],其可能的分子机制为足叶乙苷可以减弱顺铂引起的DNA损伤修复能力[22],且一些实验已证实足叶乙苷及顺铂有协同细胞毒性作用[23]。同样,以足叶乙苷为基础,联合异环磷酰胺同样为有效方案。Miser等[24]应用异环磷酰胺[1 800 mg/(m2·d),d1~5]联合足叶乙苷[100 mg/(m2·d),d1~5]治疗复发性WT,得到OS为69%,而Pein等[25]应用足叶乙苷[100 mg/(m2·d),d1~5]联合卡铂[160 mg/(m2·d),d1~5]得到 73%的反应率。也有研究提出,轮替应用环磷酰胺/足叶乙苷和卡铂/足叶乙苷可能会提高 EFS。Malogolowkin等[26]报道,4年 EFS 为 42.3%,OS 为 48%;而 Hale等[27]应用上述方案得出OS为66%。
上述方案中最主要的2项不良反应为血液学毒性及肾小管毒性。首先在血液学毒性方面,Miser等[24]应用异环磷酰胺/足叶乙苷,Ⅲ/Ⅳ级中性粒细胞减少发生率较高,可达96%,而血小板减少发生率较低,约为20% ~30%。有报道,卡铂/足叶乙苷方案Ⅲ/Ⅳ级中性粒细胞减少发生率为92%,Ⅳ度血小板减少发生率为100%。其次在肾小管毒性方面,Marina等[28]报道了对于初次诊断肉瘤,联合应用异环磷酰/卡铂发生严重肾小管毒性的几率比单用异环磷酰胺或异环磷酰胺/顺铂高,且迟发性毒性(治疗1年后发生)更常见。
目前,对ICE(异环磷酰胺、卡铂、足叶乙苷)方案研究越来越多,Abu-Gosh等[29]应用该方案治疗了11例患儿,这些患儿之前经历了手术,放疗或其他化疗药物等多种治疗手段,最终的3年EFS和OS为63.6% ±14.5%,但剂量限制性Ⅲ~Ⅳ度血小板减少症较常见。Kung等[30]及 Daw 等[31]均报道该方案致范科尼综合征的发生率为29%,高于应用异环磷酰胺/足叶乙苷该不良反应的发生率(20%)[25]。但并不是所有研究都能得出此结果,可能与个体差异相关。但无论如何,上述报道均可证实足叶乙苷为基础的方案对于复发性肾母细胞瘤是有效的,至于两药及三药联合在疗效及不良反应方面的差异,以及最好的用药方案仍需进一步对比研究。
本研究中,足叶乙苷的治疗剂量为100 mg/(m2·d),d1~4或d1~5。每21天为1个周期。3例患儿中,1例对足量耐受性较好,而其他2例因经历多线化疗,剂量减至原来的80%。患者均从中获益,肿瘤体积不同程度减小,未经历致死性骨髓抑制及严重的肾小管毒性。
目前我们的治疗目标是最大可能延长生存期,并使发生并发症的可能性降至最低。在本文中,尽管2例患儿化疗减量,但疗效同样较好,且未发生严重不良反应。目前尚不清楚足量与减量在OS与远期并发症上是否有区别,在不影响疗效的前提下最大程度地减少药物用量,可减轻相关不良反应,对于极高组复发性肾母细胞瘤患儿来说会是巨大福音,因为他们对药物反应性差,复发及进展风险高,注定会经历多线多种药物治疗,若上述设想可达成,至少在生存质量上会有很大提高。总之,足叶乙苷为基础的方案对复发性肾母细胞瘤有效,我们希望开展更多的临床实验探索最佳的组合方式、用药剂量及给药周期,能使更多高危组及极高危复发性肾母细胞瘤患儿从中获益,生存质量得到提高。
:
[1]Ha TC,Spreafico F,Graf N,et al.An international strategy to determine the role of high dose therapy in recurrent Wilms’tumour[J].Eur J Cancer,2013,49(1):194-210.
[2]Buckley KS.Pediatric genitourinary tumors[J].Current Opinion in Oncology,2012,24(3):291-296.
[3]Spreafico F,Pritchard Jones K,Maloqolowkin MH,et al.Treatment of relapsed Wilms tumors:lessons learned[J].Anticancer Ther,2009,9(12):1807-1815.
[4]Campbell AD,Cohn SL,Reynolds M,et al.Treatment of relapsed Wilms’tumor with high-dose therapy and autologous hematopoietic stem-cell rescue:the experience at children’s memorial hospital[J].Journal of Clinical Oncology,2004,22(14):2885-2890.
[5]Kullendorff CM.Relapses in Wilms tumor[J].Pediatric Surgery International,2003,19(9-10):635-638.
[6]Kaste SC,Dome JS,Babyn PS,et al.Wilm’s tumour:prognostic factors,staging,therapy and late effects[J].Pediatr Radiol,2008,38(1):2-17.
[7]Dome JS,Liu TB,Krasin M.Improved Survival for Patients With Recurrent Wilms Tumor:The Experience at St.Jude Children’s Research Hospital[J].Journal of Pediatric Hema-tology/Oncology,2002,24(3):192-198.
[8]Dome JS,Cotton CA,Perlman EJ,et al.Treatment of anaplastic histology Wilms'tumor:results from the fifth National Wilms'Tumor Study[J].Journal of Clinical Oncology,2006,24(15):2352-2358.
[9]Tongaonkar HB,Qureshi SS,Kurkure PA,et al.Wilms'tumor:An update[J].Indian Journal of Urology,2007,23(4):458-466.
[10]Spreafico F,Bellani FF.Wilms'tumor:past,present and(possibly)future[J].Expert Rev Anticancer Ther,2006,6(2):249-258.
[11]Green DM.The treatment of stagesⅠ–Ⅳ favorable histology Wilms’tumor[J].Journal of Clinical Oncology,2004,22(8):1366-1372.
[12]Andrew M,Davidoff.Wilms Tumor[J].Advance In Pediatrics,2012,59(1):247-267.
[13]Dome JS,Fernandez CV,Mullen EA,et al.Children's Oncology Group's 2013 blueprint for research:Renal tumors[J].Pediatric Blood & Cancer,2013,60(6):994-1000.
[14]O’Dwyer PJ,Leyland-Jones B,Alonso MT,et al.Etoposide(VP-16-213).Current status of an active anticancer drug[J].N Engl J Med,1985,312(11):692-700.
[15]Pein F,Pinkerton R,Tournade MF,et al.Etoposide in relapsed or refractory Wilms’tumor:a phase II study by the French Society of Pediatric Oncology and the United Kingdom Children’s CancerStudy Group[J].Clin Oncol,1993,11(8):1478-1481.
[16]Heideman RL,Kovnar EH,Kellie SJ,et al.Preirradiation chemotherapy with carboplatin and etoposide in newly diagnosed embryonal pediatric CNS tumors[J].Clin Oncol,1995,13(9):2247-2254.
[17]Alvarado CS,Kretschmar C,Joshi VV,et al.Chemotherapy for patients with recurrent or refractory neuroblastoma:a POG Phase II study[J].Pediatr Hematol Oncol,1997,19(1):62-67.
[18]Pein F,Tournade MF,Zucker JM,et al.Etoposide and carboplatin:a highly effective combination in relapsed or refractory Wilms'tumor--a phase II study by the French Society of Pediatric Oncology[J].Clin Oncol,1994,12(5):931-936.
[19]Bosl GJ,Bajorin DF.Etoposide plus carboplatin or cisplatin in good-risk patients with germ cell tumors:a randomized comparison[J].Semin Oncol,1994,21(5 Suppl 12):61-64.
[20]Klingebiel T,Pertl U,Hess CF,et al.Treatment of children with relapsed soft tissue sarcoma:report of the German CESS/CWS REZ 91 trial[J].Med Pediatr Oncol,1998,30(5):269-275.
[21]Doz F,Neuenschwander S,Plantaz D,et al.Etoposide and carboplatin in extraocular retinoblastoma:a study by the Societe Francaise d'Oncologie Pediatrique[J].Clin Oncol,1995,13(4):902-909.
[22]Ali-Osman F,Berger MS,Rajagopal S,et al.Topoisomerase II inhibition and altered kinetics of formation and repair of nitrosourea and cisplatininduced DNA interstrand cross-links and cytotoxicity in human glioblastoma cells[J].Cancer Res,1993,53(23):5663-5668.
[23]Durand RE,Goldie JH.Interaction of etoposide and cisplatin in an in vitro tumor model[J].Cancer Treat Rep,1987,71(7-8):673-679.
[24]Miser J,Krailo M,Hammond GD.The combination of ifosfamide(IFOS),etoposide(VP16),and mesna(M):a very active regimen inthe treatment of recurrent Wilms’tumor(WT)[J].Proc Am Soc Clin Oncol,1993,12:417.
[25]Pein F,Tournade MF,Zucker JM,et al.Etoposide and carboplatin:a highly effective combination in relapsed or refractory Wilms’tumor—a phase II study by the French Society of Pediatric Oncology[J].Clin Oncol,1994,12(5):931-936.
[26]Malogolowkin M,Cotton CA,Green DM,et al.Treatment of Wilms tumor relapsing after initial treatment with vincristine,actinomycin D,and doxorubicin.A report from the National Wilms Tumor Study Group[J].Pediatr Blood Cancer,2008,50(2):236-241.
[27]Hale J,Hobson R,Moroz V,et al.Results of UK Children’s Cancer and Leukemia Group(CCLG)protocol for relapsed Wilms tumor(UKWR):unified relapse strategy improves outcome[J].Proceeding of the 40th Meeting of International Society of Paediatric Oncology,2008.
[28]Marina NM,Poquette CA,Cain AM,et al.Comparative renal tubulartoxicity of chemotherapy regimens including ifosfamide in patientswith newly diagnosed sarcomas[J].Pediatr Hematol Oncol,2000,22(2):112-118.
[29]Abu-Ghosh AM,Krailo MD,Goldman SC,et al.Ifosfamide,carboplatin and etoposide in children with poor-risk relapsed Wilms’tumor:a Children’s Cancer Group report[J].Annals of Oncology,2002,13(3):460-469.
[30]Kung FH,Bernstein ML,Camitta BM,et al.Ifosfamide/carboplatin/etoposide(ICE)in the treatment of advanced,recurrent Wilms’tumor[J].Proc Am Soc Clin Oncol,1999,18:559.
[31]Daw N,Jones D,Gregornik D,et al.Renal function after ifosfamide,carboplatin and etoposide(ICE),nephrectomy,and radiation inchildren with high risk Wilms’tumor[J].Eur J Cancer,2009,45(1):99-106.
