亚基交换在小分子热休克蛋白AgsA发挥类分子伴侣活性中扮演着重要的角色
2015-08-25石小东徐州医学院麻醉学重点实验室江苏徐州221004
石小东(徐州医学院麻醉学重点实验室,江苏徐州 221004)
亚基交换在小分子热休克蛋白AgsA发挥类分子伴侣活性中扮演着重要的角色
石小东
(徐州医学院麻醉学重点实验室,江苏徐州 221004)
为了研究鼠伤寒沙门氏菌小分子热休克蛋白AgsA的亚基交换在其发挥类分子伴侣活性中的作用,本文通过将野生型AgsA和在C末端添加His-tag标签的AgsA在不同条件下与Ni-NTA Agarose混合,最后检测pull down下来的蛋白来分析目标蛋白的亚基交换情况。凝胶排阻层析和类分子伴侣活性测定结果显示,在C末端添加His-tag标签并不影响AgsA的寡聚状态和类分子伴侣活性。Pull down的研究结果表明,AgsA的亚基交换速率随着温度的升高而升高,而且,部分变性底物的存在也加速了AgsA的亚基交换速率。由于AgsA的类分子伴侣活性是随着温度的升高而升高的,由此可以推测,亚基交换在AgsA发挥类分子伴侣活性中扮演着重要的角色。
小分子热休克蛋白 AgsA 类分子伴侣活性 亚基交换
【Abstract】In order to study the role of subunit exchange in the chaperone-like activity of small heat shock protein AgsA from Salmonella enterica serovar Typhimurium,wild type AgsA and the AgsA with a His-tag added on the C terminus were mixed with Ni-NTA Agarose under different conditions,then the proteins pulled down were detected to analyse the subunit exchange of AgsA. The results of the gel exclusion chromatography analysis and chaperone-like activity assay showed that the added His-tag neither affected the oligomeric state of AgsA,nor the chaperone-like activity of AgsA. The results of the pull down assay showed that subunit exchange of AgsA occurred faster upon temperature increasing,and the presence of partial denatured substrate also accelerate the subunit exchange rate of AgsA. Since the chaperone-like activity of AgsA enhanced as temperature increased,it could be speculated that subunit exchange may play an important role in the chaperone-like activity of AgsA.
【Key words】small heat shock protein,AgsA,chaperone-like activity,subunit exchange
小分子热休克蛋白是一类普遍存在的应激蛋白,分子量在12-43 kDa之间,具有保守的、大约100多个氨基酸残基组成的a-crystallin结构域[1-2]。通常,小分子热休克蛋白在体外以多个亚基组成的球状寡聚体形式存在,这种寡聚体是一种动态的结构,在寡聚体之间发生着快速的亚基交换[3-4],尽管关于该过程的机制和动力学都还知之甚少,越来越多的证据都表明亚基交换是小分子热休克蛋白发挥类分子伴侣活性必不可少的[5-9]。为了确定这种关系是否也存在于鼠伤寒沙门氏菌小分子热休克蛋白AgsA中,本文采用His-tag pull down法对该蛋白在不同条件下的亚基交换情况进行了研究。结果发现,AgsA的亚基交换速率随着温度的升高而升高,而且部分变性底物的存在也加速了AgsA的亚基交换,表明亚基交换在AgsA的类分子伴侣活性的发挥中也扮演着重要的角色。
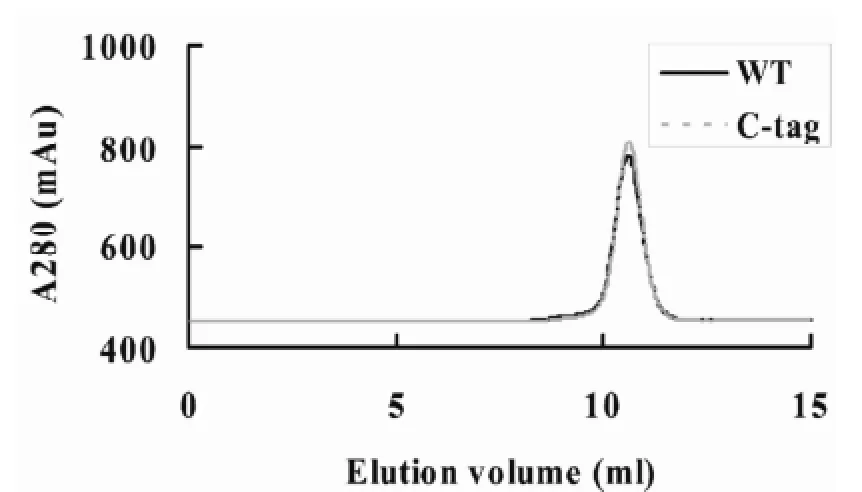
图1 凝胶排阻层析分析AgsA和AgsA-His6在室温下的寡聚状态

图2 AgsA和AgsA-His6类分子伴侣活性的测量
1 材料和方法
1.1材料
E. coli DH5α用于分子克隆操作,E. col BL21(DE3)用于目标蛋白的表达和纯化,pET21a-agsA质粒受赠于北京大学生命科学学院蛋白质科学实验室。Ni-NTA Agarose购自北京百汇中源有限公司。Insulin、DTT(dithiothreitol)购自Sigma公司。其他所有化学试剂均为分析纯量级。

图3 His-tag pull down方法研究AgsA在不同条件下的亚基交换情况
1.2方法
(1)重组质粒的构建。为了表达在C末端带有His-tag标签的AgsA,以质粒pET21a-agsA作为模板进行PCR扩增,所得DNA片段用限制性内切酶NdeⅠ和XhoⅠ双酶切后,插入到质粒pET21a中,获得的重组质粒pET21a-agsA-his6转化到E. coli BL21(DE3)感受态细胞进行目的蛋白的表达。
(2)AgsA的表达与纯化。将含有重组载体的E. coli BL21(DE3)菌株小量培养过夜,转接至新鲜LB培养基中于37℃,200 rpm条件下大量培养,当细菌长至OD600约为0.6时,加入1 mM的IPTG,继续培养约6 h。5000 rpm离心10 min收获菌体,去离子水洗涤后冻存于-20℃过夜。不带His-tag标签的AgsA的纯化方法参考Shi等人的操作步骤[10]。对于带有His-tag标签的AgsA,冻存菌体在冰上缓慢融化之后,用含有1 mM蛋白酶抑制剂PMSF的缓冲液A(50 mM Na3PO4,50 mM NaCl,20 mM咪唑,pH 7.5)重悬后进行超声破碎。细胞裂解液于15000 g离心40 min,收集上清上样于Ni-NTA柱,随后用缓冲液B(50 mM Na3PO4,1 M NaCl,20 mM咪唑,pH 7.5)洗脱杂蛋白,最后用缓冲液C(50 mM Na3PO4,50 mM NaCl,250 mM咪唑,pH 7.5)进行目的蛋白的洗脱。采用BCA法对纯化所得蛋白进行浓度测定。
(3)凝胶排阻层析。采用凝胶排阻层析柱Superdex200,每次上样量为100 μl,AgsA浓度为3.5 mg/ml,洗脱液为50 mM Na3PO4(含50 mM NaCl,pH 7.5),流速为0.5 ml/min。样品在上样前15000 g离心10 min。
(4)类分子伴侣活性的测量。以Insulin作为底物来测定AgsA的类分子伴侣活性。类分子伴侣活性的测量在UV-8500分光光度计(上海,Techcorp)上进行,检测波长为360 nm。
(5)His-tag pull down试验。于1.5 ml eppendorf管中加入500 μl Ni-NTA Agarose,2000 g离心1 min,弃上清;用去离子水洗5次之后用缓冲液A再洗5次;加入在特定温度下孵育10 min的目标蛋白(200 μl野生型AgsA和/或200 μl C端带有His-tag标签的AgsA)计400 μl,旋转混合5 min,2000 g离心1 min,取50 μ l上清液为不和Ni-NTA Agarose结合的蛋白组分,余下上清弃掉;加入缓冲液C 250 μl,旋转混合1 h,2000 g离心1 min,取50 μl上清液为和Ni-NTA Agarose结合不紧密的蛋白组分,余下上清弃掉;加入1×SDS loading buffer 250 μl,置于沸水中加热5 min,2000 g离心1 min,取50 μl上清液为和Ni-NTA Agarose紧密结合的蛋白组分;所有样品经过SDS-PAGE电泳分离,用考马斯亮蓝染色。对于变性底物诱导试验,目标蛋白除了200 μl野生型AgsA 和200 μl C端带有His-tag标签的AgsA之外,还加入100 μl insulin(5mg/ml)和20 μl DTT(1 M),在30oC孵育10 min,其余操作同上。
2 结果
2.1在AgsA的C末端添加His-tag标签不会影响其寡聚状态
AgsA在体外形成大的寡聚体结构[11],其在室温条件下的洗脱曲线只呈现单一的洗脱峰(图1)。凝胶排阻层析对AgsA-His6的分析结果显示,在C末端添加His-tag标签未明显改变AgsA在室温条件下的洗脱曲线(图1),表明在AgsA的C末端添加His-tag标签并不会影响其寡聚状态。
2.2在AgsA的C末端添加His-tag标签不会影响其类分子伴侣活性
以Insulin作为底物测定AgsA的类分子伴侣活性的试验结果表明,AgsA可以在室温条件下阻止DTT诱导的Insulin B链的聚集(图2)。采用同样方法测定AgsA-His6对Insulin B链聚集的保护情况,结果发现,在C末端添加His-tag标签都几乎不影响AgsA在室温条件下的类分子伴侣活性(图2)。
在室温条件下,用UV-8500分光光度计分别检测不同浓度的AgsA和AgsA-His6对DTT诱导的Insulin B链聚集的保护,检测波长为360nm,DTT的终浓度为20 mM。WT:野生型AgsA;C-tag:C末端带有His-tag标签的AgsA。
2.3AgsA的亚基交换速率受温度和底物的影响
在确定添加His-tag对AgsA的寡聚状态和类分子伴侣活性无影响之后,首先通过比较AgsA和AgsA-His6与Ni-NTA Agarose的结合能力来检验本实验室所建立的His-tag pull down体系。如图3A所示,AgsA因为不结合Ni-NTA Agarose,主要出现在lane 2,而AgsA-His6结合Ni-NTA Agarose,主要出现在lane 4。当把AgsA 和AgsA-His6等量混合进行上述实验,如果发生亚基交换,从lane 2 到lane 4中则均可检测出两种蛋白的存在,二者的比例体现的是亚基交换能力的差异。本文分别在4WT:野生型AgsA;N-tag;C-tag:C末端带有His-tag标签的4℃、30℃、60℃以及部分变性底物存在的条件下对AgsA的亚基交换情况进行了研究。试验结果表明,在4℃,AgsA基本不发生亚基交换,随着温度的升高,从30℃到60℃,伴随着AgsA的亚基交换速率增加。此外,部分变性底物Insulin的存在也加快了AgsA的亚基交换速率(见图3B)。
3 讨论
在我们之前的研究中发现,AgsA的类分子伴侣活性是温度依赖的[10]。为了探究亚基交换在AgsA类分子伴侣活性发挥中的作用,本文对该蛋白在不同温度下的亚基交换速率进行了比较。荧光能量共振转移(FRET)通常被用来研究小分子热休克蛋白的亚基交换,该方法需要对蛋白进行标记[4,5],而本文则采用了免标记的His-tag pull down法。研究结果显示,AgsA的亚基交换也是温度依赖的,随着温度的升高,亚基交换速率增加,这与Hsp16.3、Hsp16.5以及αA-crystallin的亚基交换受温度影响的趋势是一致的[4,5,12]。除了温度可以加速AgsA的亚基交换速率,我们还发现部分变性的底物也可以在一定程度上促进AgsA的亚基交换。由此可见,亚基交换在AgsA类分子伴侣活性的发挥中起着重要的作用。小分子热休克蛋白发挥类分子伴侣活性的机制普遍被认为是通过寡聚体先发生解聚,然后去识别并结合去折叠且暴露出疏水表面的部分变性蛋白中间体,通过抑制其疏水面暴露而引起的聚集,达到抑制底物蛋白聚集的效果,亚基交换速率的加快则有助于AgsA更有效地提供解聚的寡聚体,更有效地结合部分变性的底物蛋白,发挥其类分子伴侣活性。
[1]Kappe,G.,Leunissen,J.A.,and de Jong,W.W. (2002). Evolution and diversity of prokaryotic small heat shock proteins. Prog Mol Subcell Biol 28,1-17.
[2]Haslbeck,M.,Franzmann,T.,Weinfurtner,D.,and Buchner,J. (2005). Some like it hot: the structure and function of small heat-shock proteins. Nat Struct Mol Biol 12,842-846.
[3]Bova,M.P.,McHaourab,H.S.,Han,Y.,and Fung,B.K. (2000). Subunit exchange of small heat shock proteins. Analysis of oligomer formation of alphaA-crystallin and Hsp27 by fluorescence resonance energy transfer and site-directed truncations. J Biol Chem 275,1035-1042.
……
……
[4]Bova,M.P.,Ding,L.L.,Horwitz,J.,and Fung,B.K. (1997). Subunit exchange of alphaA-crystallin. J Biol Chem 272,29511-29517.
[5]Bova,M.P.,Huang,Q.,Ding,L.,and Horwitz,J. (2002). Subunit exchange,conformational stability,and chaperone-like function of the small heat shock protein 16.5 from Methanococcus jannaschii. J Biol Chem 277,38468-38475.
[6]Gu,L.,Abulimiti,A.,Li,W.,and Chang,Z. (2002). Monodisperse Hsp16.3 nonamer exhibits dynamic dissociation and reassociation,with the nonamer dissociation prerequisite for chaperone-like activity. J Mol Biol 319,517-526.
[7]Fu,X.,Liu,C.,Liu,Y.,Feng,X.,Gu,L.,Chen,X.,and Chang,Z. (2003). Small heat shock protein Hsp16.3 modulates its chaperone activity by adjusting the rate of oligomeric dissociation. Biochem Biophys Res Commun 310,412-420.
[8]Jiao,W.,Qian,M.,Li,P.,Zhao,L.,and Chang,Z. (2005). The essential role of the flexible termini in the temperatureresponsiveness of the oligomeric state and chaperone-like activity for the polydisperse small heat shock protein IbpB from Escherichia coli. J Mol Biol 347,871-884.
[9]Usui,K.,Hatipoglu,O.F.,Ishii,N.,and Yohda,M. (2004). Role of the N-terminal region of the crenarchaeal sHsp,StHsp14.0,in thermal-induced disassembly of the complex and molecular chaperone activity. Biochem Biophys Res Commun 315,113-118.
[10]Shi,X.,Wang,Z.,Yan,L.,Ezemaduka,A.N.,Fan,G.,Wang,R.,Fu,X.,Yin,C.,and Chang,Z. (2011). Small heat shock protein AgsA forms dynamic fibrils. FEBS Lett 585,3396-3402.
[11]Tomoyasu,T.,Tabata,A.,and Nagamune,H. (2010). Investigation of the chaperone function of the small heat shock protein-AgsA. BMC Biochem 11,27.
[12]Fu,X.,and Chang,Z. (2004). Temperature-dependent subunit exchange and chaperone-like activities of Hsp16.3,a small heat shock protein from Mycobacterium tuberculosis. Biochem Biophys Res Commun 316,291-299.
国家自然科学基金(81300930);江苏省自然科学基金(BK20130232)
★石小东
