苏云金芽胞杆菌6618杀虫菌株的分离和鉴定*
2015-08-24陆秀青谢俊雁丁学知夏立秋孙运军
张 晨,黄 菲,陆秀青,谢俊雁,丁学知,夏立秋,孙运军
(湖南师范大学生命科学学院,湖南长沙410081)
苏云金芽胞杆菌6618杀虫菌株的分离和鉴定*
张晨,黄菲,陆秀青,谢俊雁,丁学知,夏立秋,孙运军*
(湖南师范大学生命科学学院,湖南长沙410081)
从我国不同地区采集118份土样,利用温度筛选法分离获得一株苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)6618,镜检观察发现该菌株能产生典型的菱形晶体,PCR分析表明其含有cry1类杀虫基因。采用SDS-PAGE和质谱分析发现该菌株主要产生130 kD原毒素,其组分由Cry1Ae和Cry1Ac原毒素组成。基因序列分析表明该菌株的cry1Ac基因为已知的cry1Ac1,而cry1Ae为新型杀虫基因。毒力生测表明该菌株对棉铃虫(Helicoverpa armigera)幼虫具有显著的杀虫效果。筛选获得的高毒力Bt菌株6618为丰富我国苏云金芽胞杆菌储备和研发新型高效生物杀虫剂提供了菌株资源。
苏云金芽胞杆菌;菌株筛选;cry基因;质谱分析;杀虫活性
doi:10.3969/j.issn.1007-7146.2015.04.013
苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)具有高效特异的杀虫活性和环境安全性,目前已发展为世界上产量最大的微生物杀虫剂,在害虫的综合治理中具有非常重要的作用。Bt菌株在土壤、虫尸和植物叶片等介质中具有非常广泛的分布[1,2]。随着Bt杀虫剂的广泛应用,其存在的问题也逐渐表现出来,例如杀虫谱较窄、成本较高以及诱发害虫抗性等问题。因此筛选新型Bt菌株和发掘新的杀虫基因,对扩大Bt杀虫谱及延缓害虫抗性的产生具有非常重要的意义。
土壤是苏云金芽胞杆菌生存的良好介质。由于土壤生态环境的多样性,土壤的类型、pH值、腐殖质等特性的不同,都会影响Bt菌株的分离效率率。目前经常使用的分离方法主要有[3-6]:温度筛选法、醋酸钠选择性筛选法、抗生素选择性筛选法、醋酸钠-抗生素筛选法。此外,随着分子生物学技术的发展,越来越多的Bt杀虫晶体蛋白基因得到鉴定,目前杀虫基因鉴定方法主要有PCR-RFLP鉴定法、简并引物鉴定法、多重PCR鉴定法、Exclusive PCR鉴定法、分子杂交鉴定法等[7-10]。研究发现,cry基因类型不同,其编码的杀虫晶体蛋白对不同种类昆虫的杀虫活性也会不同[11]。cry1、cry2、cry9基因编码的毒素蛋白一般对鳞翅目害虫具有特异杀虫活性;cry3、cry7、cry8、cry18基因编码的毒素蛋白通常对鞘翅目害虫有特异毒性;cry2、cry4、cry10、cry11基因能编码对双翅目害虫有特异毒性的毒素蛋白;另外,对线虫有活性的特异性毒素通常由cry5、cry6、cry12基因编码。本研究利用温度筛选法,从土壤中筛选分离Bt新菌株,并对其杀虫活性及杀虫基因进行分析。
1 材料和方法
1.1材料
1.1.1培养基与培养条件 用到的培养基如下: BPA培养基(牛肉膏0.5%,蛋白胨1%,乙酸钠3.4%,pH7.2-7.4)、BP培养基(牛肉膏0.3%,蛋白胨0.5%,NaCl 0.5%,琼脂2%)、LB培养基(酵母提取物0.5%,氯化钠1%,胰蛋白胨1%)、GYS培养基((NH4)2SO40.2%,酵母提取物0.2%,K2HPO40.05%,葡萄糖0.1%,CaCl20.008%,MnSO40.005%,MgSO40.02%)。苏云金芽胞杆菌培养温度为30℃,大肠杆菌培养温度为37℃。
1.1.2试剂、抗生素及使用浓度 PCR相关试剂购自南京诺唯赞生物科技有限公司,限制性内切酶购自TaKaRa公司,其它生化试剂购自中国国药集团。PCR引物合成与基因测序由英潍捷基(上海)贸易有限公司完成。氨苄青霉素购自Sigma公司,使用终浓度为100 μg/mL。
1.2方法
1.2.1苏云金芽胞杆菌的分离筛选 将块状土样粉碎均匀,称重1 g加入100 mL无菌水中溶解,强烈振荡5 min使土壤中的菌体充分释放出来。取1 mL上层悬浮液原液,通过加入无菌水进行梯度稀释,使原液稀释至10-3至10-7。取各稀释度的样品液0.5 mL加入4.5 mL BPA培养基,在30℃摇床中振荡培养24 h。然后置于75℃水浴中加热20 min,杀死非芽胞杆菌类微生物。待其冷却后,取100 μL样品液涂布于BP平板,30℃恒温箱中倒置培养,挑取类似Bt单菌落接种于LB平板,镜检观察其菌体形态。
1.2.2苏云金芽胞杆菌的SDS-PAGE检测 将Bt菌株接种于GYS液体培养基中,在恒温摇床中振荡培养(30℃,180 r/min)约60 h,直到菌体裂解并释放晶体。提取芽胞晶体混合物进行SDS-PAGE检测,考马斯亮蓝R-250染色后脱色,用蛋白胶扫描仪扫描结果并进行分析。
1.2.3苏云金芽胞杆菌原毒素的质谱分析 切取SDS-PAGE胶块上的目的蛋白条带,对其进行胶内酶解,将酶解所得的肽段混合物复溶在40 μL 0.1%的甲酸溶液中,离心后取30 μL溶液到样品瓶中,采用LTQ XL质谱仪(Thermo Fisher Scientific,USA)进行LC-MS/MS分析[12]。
1.2.4苏云金芽胞杆菌的16S rRNA鉴定 提取Bt菌株基因组DNA,通过PCR扩增获得该菌株16S rRNA的编码序列,回收PCR产物后克隆pMD18-T载体并进行序列测定。
1.2.5苏云金芽胞杆菌的杀虫基因鉴定 提取Bt菌株的基因组作为PCR模板,采用cry1类基因通用引物[13]对其进行基因型鉴定。在此基础上,用cry1Ac和cry1Ae基因的特异性引物扩增Bt菌株中的靶标基因,回收PCR产物并克隆至pMD18-T载体中,测序后进行序列比对分析。
1.2.6苏云金芽胞杆菌的杀虫毒力测定 Bt菌株培养60 h后,离心收集芽胞晶体混合物,生理盐水悬浮后进行超声波处理,蒸馏水洗涤后对芽胞晶体混合物进行冷冻干燥,称重后加入无菌超纯水制成适当浓度梯度的悬浮液,再与生测饲料充分混匀添加至24孔生测板,向每孔中加入1条棉铃虫(Helicoverpa armigera)初孵幼虫,每个浓度重复2次。将生测板置于28℃、60%湿度的光照培养箱中,记录幼虫死亡率,并用SPSS软件计算半致死浓度LC50。
2 结果与分析
2.1苏云金芽胞杆菌的筛选与16S rRNA序列分析
从全国各地不同土壤类型采集118份土样,利用温度筛选法分离纯化苏云金芽胞杆菌,其中一株被命名为Bt 6618菌株。镜检观察显示该菌株产生菱形伴胞晶体(图1)。

图1 Bt 6618菌株的晶体形态(箭头所示为伴胞晶体)Fig.1 The shape of parasporal crystal produced by Bacillus thuringiensis strain 6618(The parasporal crystal was indicated by arrow)
扩增Bt 6618菌株的16S rRNA基因,克隆至pMD18-T载体后进行测序。在NCBI上对Bt 6618菌株的16S rRNA基因进行序列比对分析,结果表明与其同源性最高的是苏云金芽胞杆菌Bt407,同源性为99%,Max score值为2 782,有3个碱基存在差异。
2.2苏云金芽胞杆菌原毒素类型鉴定及相关基因分析
提取Bt 6618菌株芽胞晶体混合物并进行SDSPAGE电泳分析,结果显示该菌株表达产生一条约130 kD的蛋白主带,对照菌株HD-1产生130 kD和65 kD的蛋白主带(图2)。

图2 Bt6618菌株芽胞晶体混合物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of crystal-spore mixture from Bt 6618
切取SDS-PAGE胶块上Bt 6618菌株产生的130 kD蛋白条带,蛋白经胶内酶解后进行质谱检测,利用SEQUEST搜库软件和芽胞杆菌蛋白质数据库对质谱数据进行分析,发现该菌株的原毒素主要组分为Cry1Ac和Cry1Ae。其中鉴定到Cry1Ac原毒素有47个特异肽段,序列覆盖率达67.66%,Cry1Ae原毒素鉴定到2个高可信的特异性肽段,序列覆盖率为23.96%。表1列出了2D-LC-MS/MS技术鉴定的Bt 6618菌株的伴胞晶体原毒素及其相关信息。
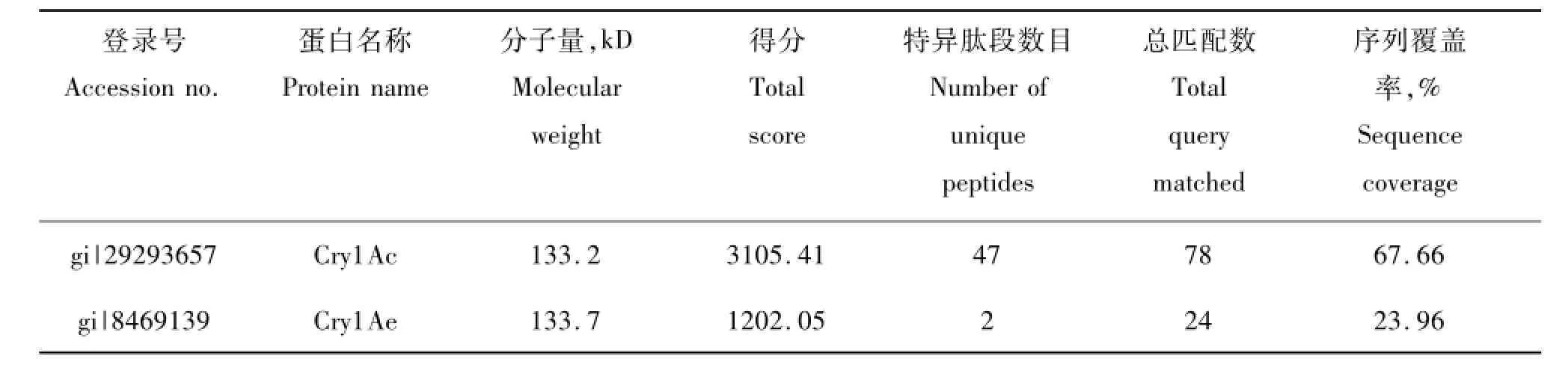
表1 Bt 6618菌株伴胞晶体中原毒素组分的质谱鉴定Tab.1 Identification of protoxins produced by Bt 6618 through mass spectrometry analysis
根据原毒素的质谱分析结果,采用Cry1类原毒素编码基因的通用检测引物对Bt 6618菌株进行基因检测。用cry1-Un1(d)/cry1-Un1(r)通用引物分析发现,Bt 6618菌株的确含有预期的cry1类基因。采用特异引物扩增发现,该菌株所含的cry1Ac基因序列与已经公布的cry1Ac1序列一致,而其cry1Ae基因与目前公布的cry1Ae基因序列不同,为新型cry1Ae基因。
2.3Bt 6618菌株的杀虫毒力测定
提取Bt 6618菌株的芽胞晶体混合物并进行冷冻干燥,分析其对棉铃虫初孵幼虫的毒力。72 h统计致死率后计算LC50值为5.50 μg/mL,95%置信区间为3.83-5.97 μg/mL。这表明Bt 6618菌株对棉铃虫初孵幼虫具有良好的杀虫效果,目前该菌株已在中国典型培养物保藏中心进行保藏(保藏编号: CCTCC NO:M2014451)。
3 讨论
苏云金芽胞杆菌在土壤中分布非常广泛,根据统计,来自土壤的Bt菌株占到总数的70.4%。而Bt的分布也受到多方面因素的制约,例如气候、植被、土壤腐殖质含量、土壤类型、pH值等理化特性等,这些都会显著影响Bt在土壤中的分布数量。本研究从全国不同地区采集了118份土样分离苏云金芽胞杆菌,获得了多株Bt菌株,说明利用温度筛选法从土壤中筛选Bt菌株具有较好的出菌率。
在筛选获得的Bt菌株中,Bt 6618菌株产生非常典型的菱形伴胞晶体,其大小比其它菌株的晶体要大,且杀虫毒力相对较高。Bt 6618菌株能同时表达Cry1Ac和Cry1Ae原毒素,目前所报道的来自Bt菌株的cry1Ae基因只有一个,而其它类型的cry基因则有很多种,例如cry1Ac基因目前已经有38个亚类。在后续研究中,我们将对Bt 6618菌株中的cry1Ae基因进行异源表达和功能分析,这将为构建杀虫工程菌及培育抗虫转基因植物提供高毒力的候选基因。
[1] JARA S,MADUELL P,ORDUZ S.Diversity of Bacillus thuringiensis strains in the maize and bean phylloplane and their respective soils in Colombia[J].J Appl Microbiol,2006,101(1):117-124.
[2]ALVAREZ A,VIRLA E G,PERA L M,et al.Characterization of native Bacillus thuringiensis strains and selection of an isolate active against Spodoptera frugiperda and Peridroma saucia[J].Biotechnol Lett,2009,31(12):1899-1903.
[3]李建洪,万秋英,王沫,等.韩国土壤中苏云金芽孢杆菌菌株的分离和鉴定[J].湖南农业大学学报,2000,26(4): 293-295. LI Jianhong,WAN Qiuying,WANG Mo,et al.Isolation and identification of Bacillus thuringensis from soil of Korea[J]. Journal of Hunan Agricultural University,2000,26(4): 293-295.
[4]杨自文,吴宏文,王开梅,等.从土壤中高效分离苏云金杆菌的方法[J].中国生物防治,2000,16(l):26-30. YANG Ziwen,WU Hongwen,WANG Kaimei,et al.Method for highly efficient isolation of Bacillus thuringiensis from soil[J]. Chinese Journal of Biological Control,2000,16(l):26-30.
[5]何献君,宗浩,郑鸽,等.一株苏云金芽孢杆菌(Bacillus thuringiensis)的分离与鉴定[J].四川师范大学学报(自然科学版),2002,25(3):301-303. HE Xianjun,ZONG Hao,ZHENG Ge,et al.The isolation and characterization about Bacillus thuringiensis[J].Journal of Sichuan Normal University(Natural Science),2002,25(3): 301-303.
[6]SANTANA M A,MOCCIA-V C C,GILLIS A E.Bacillus thuringiensis improved isolation methodology from soil samples[J].J Microbiol Methods,2008,75(2):357-358.
[7]BERÓN C M,CURATTI L,SALERNO G L.New strategy for identification of novel cry-type genes from Bacillus thuringiensis strains[J].Appl Environ Microbiol,2005,71(2):761-765.
[8] BEN-DOV E,MANASHEROB R,ZARITSKY A,et al.PCR analysis of cry7 genes in Bacillus thuringiensis by the five conserved blocks of toxins[J].Curr Microbiol,2001,42(2):96-99.
[9]MASSON L,ERLANDSON M,PUZSTAI-CAREY M,et al.A holistic approach for determining the entomopathogenic potential of Bacillus thuringiensis strains[J].Appl Environ Microbiol,1998,64(12):4782-4788.
[10] BEARD C E,RANASINGHE C,AKHURST R J.Screening for novel cry genes by hybridization[J].Lett Appl Microbiol,2001,33(3):241-245.
[11]SCHNEPF E,CRICKMORE N,VAN RIE J,et al.Bacillus thuringiensis and its pesticidal crystal proteins[J].Microbiol Mol Biol Rev,1998,62(3):775-806.
[12]SUN Y,ZHAO Q,XIA L,et al.Identification and characterization of three previously undescribed crystal proteins from Bacillus thuringiensis subsp.jegathesan[J].Appl Environ Microbiol,2013,79(11):3364-3370.
[13]SUN Y,FU Z,DING X,et al.Evaluating the insecticidal genes and their expressed products in Bacillus thuringiensis strains by combining PCR with mass spectrometry[J].Appl Environ Microbiol,2008,74(21):6811-6813.
Isolation and Characterization of an Insecticidal Bacillus thuringiensis Strain 6618
ZHANG Chen,HUANG Fei,LU Xiuqing,XIE Junyan,DING Xuezhi,XIA Liqiu,SUN Yunjun*
(College of Life Science,Hunan Normal University,Changsha 410081,Hunan,China)
118 soil samples were collected from different parts of our country and a new Bacillus thuringiensis strain 6618 was isolated by temperature screening method.This strain could produce typical bipyramidal crystal under microscope observation.PCR analysis showed that it contained cry1-type gene.SDS-PAGE analysis indicated that this strain expressed a major protein band about 130 kD,which was verified by mass spectrometry analysis to be the products of Cry1Ae and Cry1Ac protoxins.Sequence analysis showed that the cry1Ac gene in this strain was identical to the published cry1Ac1 gene,while the cry1Ae gene was found to be different from the known gene.The crystal-spore mixture of the strain 6618 exhibited high toxicity towards the larvae of Helicoverpa armigera.The isolated Bacillus thuringiensis strain 6618 with high toxicity will not only enrich the reserve of Bacillus thuringiensis strains of our country,but also provide resource for the development of new efficient biological pesticide.
Bacillus thuringiensis;strain screening;cry gene;mass spectrometry;insecticidal activity
Q939.1
A
1007-7146(2015)04-0373-04
2015-04-28;
2015-08-10
湖南省教育厅高校创新平台开放基金项目(14K058);湖南师范大学青年优秀人才培养计划项目(ET13105)
张晨(1988-),女,湖南岳阳人,硕士研究生,主要从事杀虫微生物的应用研究。(手机)15116309018;(电子邮箱)596377120@qq.com
孙运军(1975-),男,汉族,湖南常德人,湖南师范大学副教授,博士,主要从事农业微生物的基础与应用研究。(电话)0731-88872905;(电子邮箱)sunyj@hunnu.edu.cn
