传统发酵酸驼乳中酵母菌的分离与鉴定
2015-08-24刘玉华孟晶山新疆克拉玛依绿成农业开发有限责任公司乳品厂新疆克拉玛依834000
刘玉华,孟晶山(新疆克拉玛依绿成农业开发有限责任公司乳品厂,新疆克拉玛依 834000)
传统发酵酸驼乳中酵母菌的分离与鉴定
刘玉华,孟晶山
(新疆克拉玛依绿成农业开发有限责任公司乳品厂,新疆克拉玛依 834000)
为了了解塔城和丰地区的酵母菌特征,分离该传统发酵酸驼乳中的3株酵母菌,采用形态学观察,生理生化试验和ITS间区PCR扩增结合的方法,将T-1酵母菌鉴定为Issatchenkia orientails(东方伊萨酵母),T-2鉴定为Issatchenkia orientails(东方伊萨酵母),T-3鉴定为Saccharomyces unisporus(单孢酵母)。为酵母菌的进一步开发利用和自然菌种的保藏提供基础。
酸驼乳;酵母菌;分离;鉴定
世界上许多国家将驼乳视为上等的营养性食品。驼乳除了含有与牛乳相似的营养成分外,还具有很多的生物活性成分,即驼乳中含有大量的诸如溶菌酶、乳铁蛋白和免疫球蛋白等抗微生物因子,在机体抗病机制方面起着重要作用[1]。酸驼乳(Hogormag)是由鲜驼乳经乳酸菌和酵母菌等微生物自然发酵制成的酸性低酒精含量乳饮品。驼乳及酸驼乳已经在哈萨克斯坦等许多国家的民间医院和诊所用于治疗胃肠道溃疡、慢性肝炎等感染性疾病[2]。新疆医科大学古丽孜亚·卡克巴依等(2007)研究证明,发酵驼乳具有抗炎作用和免疫调节作用,其机制与抑制炎性因子的渗出,降低CRP含量及消除自由基,抑制脂质过氧化有关[3]。Alhadrami等也报道酸驼乳还可用来治疗结核病和其他一些胃肠道疾病[4]。
乳制品中酵母的鉴定主要是使用常规的生理生化方法,包括形态上的、生理学上的、生物化学上的和某些生态学上的性质,这些技术需要丰富的经验。传统菌株鉴定方法一般要经过形态观察、生理生化试验,最后查检索表来确定所测菌株的种属[5]。同时,还可以采用新方法,以简化酵母的鉴定,其中包括分子生物技术的应用,商业中成套机器的使用以及计算机的分析。
为了全面了解酵母菌生物学特性及为其以后的开发利用提供基础数据,本试验主要使用传统的生理生化方法和对ITS间区进行PCR扩增相结合的方法对酵母菌进行鉴定。
1 材料与方法
1.1 材料
1.1.1 样品来源
酸驼乳样品采集于塔城和丰牧民家发酵缸中, 是牧民利用自然发酵法制作成的。
1.1.2 标准菌株来源
102:酿酒酵母(Saccharomyces cerevisiae);
2.1549:马克斯克鲁维酵母 (Kluyveromyces marxian us);
2.68:汉逊酵母(Hansenula)。
1.1.3 培养基及试剂
分离使用PDA(Potato Dextrose Agar)合成培养基,常规培养使用YPD(Yeast extract Peptone Dextrose)培养基,生理生化试验使用氮源基础培养基、碳源基础培养基、无维生素基础培养基、糖发酵基础培养基、Gorodkowa培养基和脲酶培养基。
1.1.4 仪器设备
HVE-50高压蒸汽灭菌器(日本HIRAYAMA);
ZHJH-1214B垂直流超净工作台(上海智城分析仪器制造有限公司);JT102N电子天平(上海精天电子仪器有限公司);PL303/01电子精密天平(梅特勒-托利多仪器上海有限公司);Motic/AE31EFINV图像处理倒置荧光显微镜(OLYMPUS日本公司);HQ-60-Ⅱ漩涡混合器(北方同正);BCD-276W海尔电冰箱(海尔集团青岛海尔电冰箱股份有限公司);
LHR-250生化培养箱(上海一恒科学仪器有限公司);水浴锅(SIBATA,日本)。
1.2 方法
1.2.1 酵母菌的分离
将样品稀释涂布于酸化PDA培养基,培养2d后选取单个菌落观察、编号、划线纯化并保存。
1.2.2 菌株的活化及菌悬液制备
先将试验菌株和标准菌株接种于YPD固体斜面培养基活化培养3代,经染色镜检为纯培养物后,用无菌生理盐水洗涤离心2次,制成菌悬液,调整细胞浓度,使悬液至半透光。
1.2.3 菌落特征观察
用平板划线法将菌从固体斜面接种到固体平板上,25℃培养24h。观察菌落的颜色、凸起、透明度、光滑度、形状、边缘。
1.2.4 菌株形态学观察
用接种环蘸取1或2环菌液涂于载玻片上,涂抹均匀后,火焰固定。然后,用结晶紫染色1min,洗去染色液,滴香柏油,于显微镜油镜上观察菌株的大小、形态等特征。
1.2.5 酵母菌生理生化试验
待测菌株活化3代后,制成106cfu/mL左右的供试菌悬液,进行生理生化试验。
(1)碳水化合物发酵试验。碳水化合物发酵试验采用杜氏管(Durham tube)法,测试6种糖,包括:葡萄糖、半乳糖、蔗糖、麦芽糖、乳糖。配制浓度为2%,其中麦芽糖需滤菌处理,其它均高压灭菌。
将制成的细胞悬液,以每管0.1mL的量接种于准备好的发酵试管内,摇匀,25℃下培养14d,第3,7,14d观察杜氏管内是否有气体积存及其积存量。
(2)碳源同化试验。碳源同化试验采用液体法,选用17种碳源作为同化试验对象,用氮基础液配制成0.5%(棉籽糖1%)的溶液,主要包括以下方面。六碳糖:半乳糖,葡萄糖;双糖:蔗糖,麦芽糖,纤维二糖,乳糖,蜜二糖;三糖:棉子糖,松三糖;五碳糖:D-阿拉伯糖;醇类:赤藓糖醇,D-甘露醇,乙醇;有机酸:琥珀酸,柠檬酸,D-乳酸;其他:柠檬酸三铵。其中,麦芽糖、D-阿拉伯糖需滤菌处理,琥珀酸、D-乳酸调pH值至5.7。
将制成的细胞悬液用无菌吸管滴入准备好的试管内,每管一滴(约为40~50μL),25℃下培养14d,于第3、7、14d观察,并记录结果。
(3)氮源同化试验。酵母菌可以利用很多含氮化合物作为氮源,但对硝酸盐、亚硝酸盐、盐酸乙胺、二盐酸尸胺、L-赖氨酸等的同化利用最有分类价值,日常鉴定酵母中需测以下氮源的同化反应:
硫酸铵 0.5%
硝酸钾 0.78%
亚硝酸钠 0.032 5% 调pH值6.5过滤除菌
尸胺 0.085% 过滤除菌
赖氨酸 0.07% 过滤除菌
将制成的细胞悬液用无菌吸管滴入准备好的同化管内,每管一滴(约为40~50μL),25℃下培养14d,于第3、7、14d观察,并记录结果。
(4)维生素需要情况试验。测试无维生素、无硫胺素、无吡哆素、无烟酸培养基中生长状况。接种方法,培养条件及结果记录与碳源化合物的同化试验相同。
(5)放线菌酮抗性试验。配制成含放线菌酮100ppm和1 000ppm浓度液体培养基(滤菌),接种、培养、结果记录与判定方法与碳源同化试验相同。
(6)温度试验。在液体培养基中生长:与葡萄糖同化试验相同,接种后于30、37、42℃下培养14d后以同样方式记录结果。
(7)尿素酶试验。固体培养基法:把活化后的测试菌株接种于脲酶培养基上,25℃培养7d,其间每天观察一次,出现深粉红色者为阳性反应。
1.2.6 酵母菌ITS间区PCR扩增
(1)酵母DNA提取。提取方法为改良氯化苄法。预处理的菌泥悬浮于0.5mL提取液A,用长嘴吸管吸打数次,充分混匀;依次加入100μL 10%SDS 和300μL氯化苄,漩涡高速震荡5min;50℃保温1h,间隔5~10min震混一次;加0.3ml 3M醋酸钠(pH5.2)冰浴30min;12 000g离心10min,取上清,加入2μL 10mg/mL RNase溶液,37℃温育1h;加入450μLTE;加500μL酚氯仿异戊醇,颠倒混匀,12 000g离心6min;取上清400μL,加等体积的氯仿异戊醇,12 000g离心6min;取上清350μL,加入30μL醋酸钠和340μL预冷的异丙醇,再12 000g离心6min;70%乙醇洗两次;自然干燥1h,用30μL TE回溶;-20℃保存。
(2)ITS间区PCR扩增。扩增引物使用酵 母ITS1/4通 用引物。 引 物序列 为:ITS1:5-T C C G T A G G T G A A C C T G C G-3;I T S 4:5-TCCTCCGCTTATTGATATGC-3。 扩 增 条 件:采用25μL反应体系进行PCR扩增。扩增循环参数:95℃5min变性;94℃1min,58℃2min;72℃1min,30个循环;72℃延伸10min。
取2μL产物用1.2%琼脂糖凝胶电泳检测。通过对酵母菌ITS区间进行PCR扩增,得到不同大小的扩增片段,与参考菌株对比以鉴定酵母菌。
2 结果与分析
2.1 分离结果
从采集于塔城和丰地区的酸驼乳中共分离出3株酵母菌,编号为T-1、T-2、T-3。
2.2 酵母菌的形态学观察结果
3株酵母菌显微镜观察结果见图1、图2、图3。
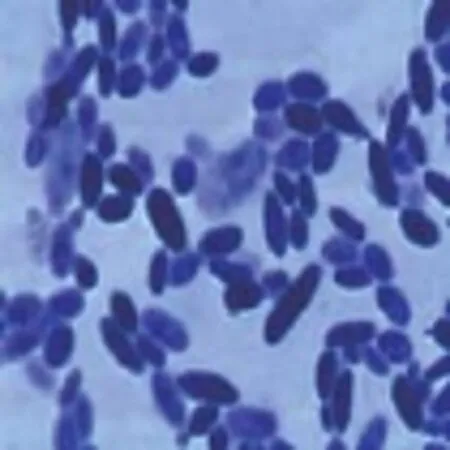
图1 T-1
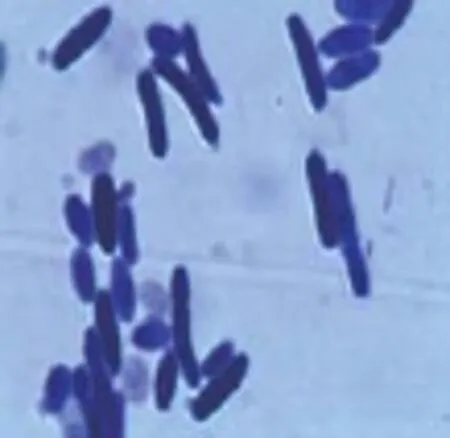
图2 T-2
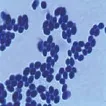
图3 T-3
由上图可知,T-1、T-2酵母菌为椭圆和腊肠状,T-3为卵圆形。
2.3 酵母菌菌落特征观察结果
株酵母菌菌落特征。

表1 酵母菌菌落特征观察结果
3株酵母菌的菌落均为乳白色,有凸起,边缘整齐,T-3无透明度,T-2不光滑且形状不规则。
2.4 酵母菌生理生化试验结果
于接菌后第3d、第7d、第14d各观察一次,分别记录。综合三次记录结果,并主要以第14d记录结果为准,第3d、第7d的实验结果记录可作为参考,结果见表2和表3。
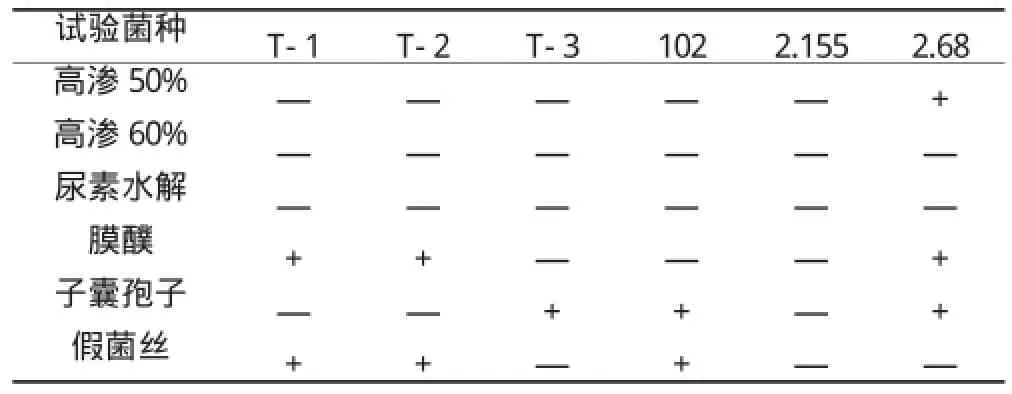
表2 酵母菌生理生化试验结果(一)

表3 酵母菌生理生化试验结果(二)
根据表2和3,T-1和T-2的各项生理生化指标基本一致,均不利用硝酸盐、半乳糖,无耐放线菌酮的能力,有膜醭,产假菌丝。T-3的生长对维生素要求全面,能较好地利用和发酵半乳糖,有耐放线菌酮的能力,无膜醭,产子囊孢子,不产假菌丝。
2.5 酵母菌的检索结果
根据生理生化的各项指标,通过表5的检索表来确定实验结果:与食品有关的酵母菌检索表;与软饮料有关的普通酵母菌检索表;与果酒和果酒制造有关的酵母菌检索表;与酿造有关的酵母菌检索表。

表4 标准菌株检索结果

表5 待测菌株检索结果
标准菌株检索结果与原菌株归属一致,检出率为100%。说明试验结果可靠,并得出待测菌株的检索结果:T-1菌株为膜醭毕赤氏酵母/东方伊萨酵母,T-2为膜醭毕赤氏酵母/东方伊萨酵母,T-3为单孢酵母。
2.6 ITS间区PCR扩增结果
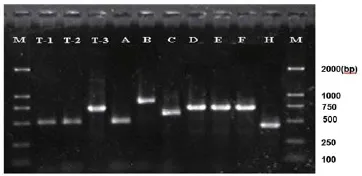
图4 ITS间区PCR扩增产物的电泳结果
如图4所示,T-1,T-2的条带大约为500bp,与A(东方伊萨酵母)在同一水平线上,可初步判断T-1 和T-2为东方伊萨酵母。T-3与D(乳酸克鲁维酵母)、E(马克斯克鲁维酵母)、F(单孢酵母)的片段大小相同,约为750bp,初步判断T-3为乳酸克鲁维酵母/马克斯克鲁维酵母/单孢酵母。
3 结论
从采自塔城和丰的酸驼乳中分离出3株酵母菌,通过形态学观察、传统生理生化试验和对ITS间区进行PCR扩增相结合的方法成功将其鉴定到种。其中,T-1,T-2均为东方伊萨酵母,T-3为单孢酵母。通过本次试验,说明通过对ITS间区进行PCR扩增,可初步对酵母菌进行归属,再结合传统生理生化试验可将酵母菌准确鉴定到种。
[1] Elagamy E I.Effect of Heat Treatment on Camel Milk Proteins with Respect to Antimicrobial Factors: a Comparison with Cows and Buffalo Milk Protein[J]. Food Chemistry,2000(68):227-232.
[2] Saitmuratova O Kh, Sulaimanova G I, Sadykov A A.Camel’s Milk and Shubat from Aral Region[J]. Chemistry of Natural Compounds, 2001(6):566-568.
[3] 古丽孜亚·卡克巴依,新华·拉比.新疆哈萨克族传统发酵驼乳抗炎作用的初步研究[J].中国乳品工业,2007(9):8-10.
[4] Alhadrami G A.Camel[A]//Roginski H, Fuquay J W,Fox P F. Encyclopedia of Dairy Sciences[M].UK:Academic Press,2003:616-622.
[5] 周春艳,张秀玲,王冠蕾.酵母菌的5种鉴定方法[J].中国酿造,2006(8):51-54.
Separation and Identification of Traditional Fermented Camel milk Yeasts
LIU Yu-hua,MENG Jing-shan
(Karamay Green into Agricultural Development Co., Ltd. dairy,Xinjiang Karamay 834000)
An area isolated from Tacheng abundance of traditional fermented camel milk in three yeast, using morphological, physiological and biochemical tests and between ITS region PCR amplification method of combining the T-1 was identified as yeast Issatchenkia orientails (East Issa yeast), T-2 was identified as Issatchenkia orientails (East Issa yeast), T-3 was identified as Saccharomyces unisporus (single spore yeast). In order to understand the area of yeast acid camel milk,Yeast provide a basis for further development and preservation of natural species.
Sour camel milk; Yeast; Isolation; Identification
TS252.56
A
2096-0387(2015)01-0032-03
刘玉华(1984-),女,新疆,博士,工程师,研究方向:食品检测。
