二氧化硅标准溶液的配制及其不确定度评定
2015-08-23段嫚雷上海市计量测试技术研究院
白 静 段嫚雷 夏 娃 丁 敏 / 上海市计量测试技术研究院
二氧化硅标准溶液的配制及其不确定度评定
白 静段嫚雷夏 娃丁 敏 / 上海市计量测试技术研究院
介绍了三种方法配制二氧化硅标准溶液,使用硅钼蓝分光光度法进行结果比对,对影响标准溶液浓度的因素进行了分析,全面评定了配制过程产生的不确定度。实验结果表明,在实际配制中,通过筛选原料的纯度,严格控制操作步骤,可以有效减小标准溶液标称值的不确定度,提高检测结果的准确度。
二氧化硅;不确定度;标准溶液;分光光度法
0 引言
硅是自然界中一种常见的元素,极少以单质的形式存在,主要以硅酸盐和二氧化硅的形式广泛存在于岩石、砂砾和尘土之中。在现代工业水质监测中,硅酸盐的含量是一个重要的监测项目,通常要求硅酸根的含量在几十个微克每升以下,否则会严重影响仪器的正常运行和产品的质量。例如,火力发电厂中的锅炉水和循环水中二氧化硅的含量不得高于250 μg/L[1],其中蒸汽水中二氧化硅的含量不得高于25 μg/L[2]。如果硅酸根含量过高,就会在热负荷很高的炉管内形成硅酸盐水垢,导致炉管鼓泡、爆漏,极易造成安全事故。同时,硅酸根含量过高会导致蒸汽中硅酸根溶解量增加、过热器再生器及汽轮机低压缸中二氧化硅沉淀析出,直接影响锅炉的热效率及发电机组热力设备的安全运行,因此准确地监控硅酸根的含量是现代水质分析的一个重要课题。
为了保证测量结果的准确可靠以及评价分析方法的合理可行,必须配制量值准确的标准溶液。二氧化硅标准溶液是硅酸根测量量值溯源的载体,对保证量值准确和等效一致具有重要作用。本文通过三种方法制备了质量浓度为1 g/L的水中二氧化硅标准溶液。所配制的标准溶液与有证标准物质进行比对,验证了方法的可靠性。此标准溶液可用于水中二氧化硅的分析质量控制,也可用于分析方法的验证和实验室分析能力的考核。本文通过对配制过程不确定度的分析评定,探讨不同的配制方法对标准溶液定值的影响。
1 实验部分
1.1主要试剂和设备
二氧化硅(高纯),碳酸钠(分析纯),氟硅酸钠(分析纯),硅酸钠(优级纯),硫酸(优级纯),氢氟酸(优级纯)均购自国药集团化学试剂有限公司。水中二氧化硅标准物质GBW(E)080272购自中国计量科学研究院。
铂金坩埚约30 g,马弗炉,容量瓶2 000 mL(A级),移液管100 mL,15 mL (A级),移液枪(1 000 μL),紫外-可见分光光度计(美国瓦里安公司):1 cm比色皿,波长640 nm。AE 200型电子天平(感量:0.1 mg,瑞士梅特勒-托利多公司)。AG 245型电子天平(感量:0.01 mg,瑞士梅特勒-托利多公司)。
1.2标准溶液的配制
1.2.1方法一
以准确称量的高纯二氧化硅和过量的碳酸钠为原料,经1 000 ℃高温熔融,熔解后转移至2 000 mL容量瓶中,配制成1 g/L的二氧化硅标准溶液。二氧化硅在配制前需进行纯度检验,检验方法参照灼烧减量、二氧化硅含量的测定[8]。
1.2.2方法二
采用分析纯氟硅酸钠作为原料,通过溶解、加热洗涤及重结晶等步骤进行提纯,用滴定法[3]进行纯度检验,纯度高于99.5 %可用于标准溶液的配制。准确称取6.259 72 g氟硅酸钠,溶于500 mL高纯水中,定容至2 000 mL容量瓶中,配制成1 g/L的溶液。此溶液应完全透明,如有混浊应重新配制。
1.2.3方法三
采用分析纯硅酸钠配制。首先配制高浓度二氧化硅溶液,参考氟化氢灼烧减量法[4]定值。用移液管准确移取30 mL溶液,加入20 mL硫酸溶液(1∶1体积比),加热蒸发至干。用定量滤纸过滤后将滤纸放入铂金坩锅中,于1 000 ℃马弗炉中灼烧2 h,冷却后称重m1。加入氢氟酸后质量的减少量Δm = m1-m2为溶液中二氧化硅的含量,浓度值由下式计算:
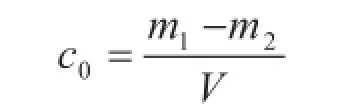
其次,利用高浓度溶液准确稀释可得到1 g/L的二氧化硅标准溶液。
1.3标准溶液的比对验证
参照硅钼蓝分光光度法[5],将三种二氧化硅标准溶液稀释到100 mg/L,评定稀释后溶液浓度的不确定度,并与国家二级标准物质GBW(E)080272进行比对,以验证方法的可靠性。
2 三种标准溶液浓度的不确定度评定
2.1方法一
由于该溶液采用高纯二氧化硅经天平定值,其量值直接溯源到天平称量值和定容体积,因此其不确定度来源有三个方面,分别为质量、纯度、体积。不确定度评定方法参照JJF 1059.1-2012[6],数值修约参考GB/T 8170-2008[7]。
A类不确定度:分别对二氧化硅重复测量10次,其结果分别为1.999 96 g,2.000 04 g,1.999 98 g,2.000 00 g,2.000 05 g,2.000 05 g,2.000 03 g,1.999 96 g,1.999 95 g,2.000 03 g,通过贝塞尔公式计算标准偏差为

B类不确定度:实验使用的电子天平经上海市计量测试技术研究院校准,其最大允许误差为±0.05 mg,服从均匀分布,取。则天平引入的不确定度
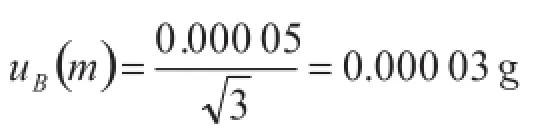
合成相对标准不确定度:将称量的A类、B类不确定度合成为质量标准不确定度,,则其相对标准不确定度为
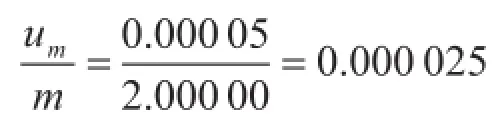
体积引入的不确定度主要包括容量瓶体积不准确和温度变化引入的不确定度。2 000 mL A级容量瓶的最大允许误差为±0.6 mL,服从三角分布,则容量瓶引入的不确定度为0.24 mL。实验室的温度控制为(20±2) ℃,水的体积膨胀系数为2.1×10-4℃-1,由温度效应导致的体积变化为2 000 ×2×2.1×10-4= 0.84 mL。服从均匀分布,标准不确定度为0.49 mL,将体积引入的不确定度进行合成,得出

则相对标准不确定度为
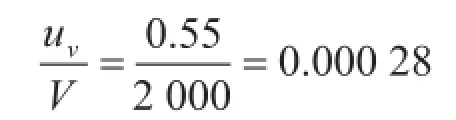
经检验高纯二氧化硅的纯度为(100.00 ±0.05)%,假设纯度引起的不确定度为均匀分布,则标准不确定度
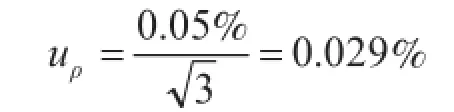
相对标准不确定度

将以上分析的相对标准不确定度代入公式:
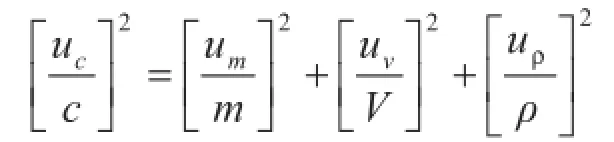
得到合成标准不确定度uc= 0.000 4 g/L,则定值结果为
2.2方法二
溶液的浓度标准值由下式计算:

式中:
c — 标准溶液的浓度值;
m — 氟硅酸钠的质量;
V — 配制体积;
ρ — 氟硅酸钠的纯度;
因此其不确定度来源有四个方面,分别为质量、纯度、体积和摩尔质量。以纯度为99.5%氟硅酸钠为例,假定式中各量是彼此独立的,则有
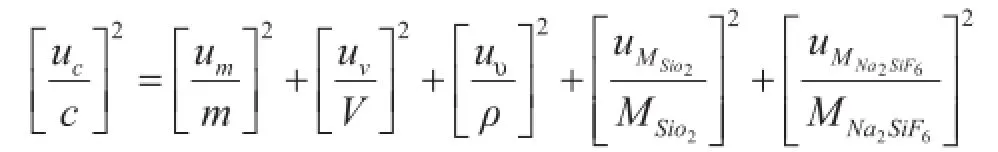
式中各量的值列于表1中。
则定值结果为 c = 0.995 g/L,U = 0.006 g/L,k = 2。

表1 方法二 二氧化硅标准溶液不确定度分量表
2.3方法三
配制二氧化硅标准溶液分两步进行,因此溶液浓度的不确定度包括高浓度溶液浓度的不确定度和稀释过程产生的不确定度。
2.3.1高浓度溶液浓度的标准不确定度uc0
测量重复性产生的不确定度为A类不确定度,可由统计学方法得出。在相同条件下重复测量10次,高浓度溶液的浓度值分别为19.846 7 g/L,19.926 7 g/L,19.946 7 g/L,19.893 3 g/L,19.860 0 g/L,19.906 7 g/L,19.933 3 g/L,19.886 7 g/L,19.853 3 g/L,19.873 3 g/L,则浓度平均值为19.892 7 g/L,根据贝塞尔公式计算,标准偏差为0.035 06 g/L,标准不确定度即为三次测量平均值的标准偏差,则
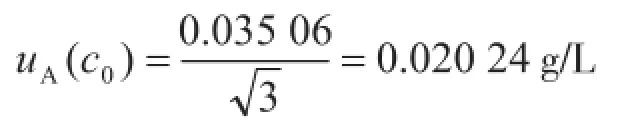
相对标准不确定度
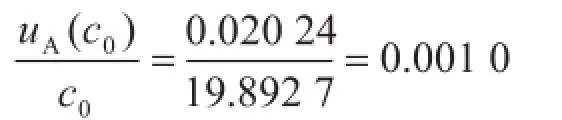
B类不确定度各分量结果见表2。假定式中各量是彼此独立的,则有
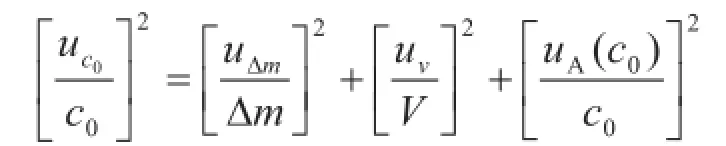
2.3.2稀释过程产生的不确定度
由氢氟酸灼烧减量法得到高浓度溶液的浓度为19.892 7 g/L,则配制2 000 mL (V2) 1 g/L标准溶液需移取100.539 mL (V1)高浓度溶液。二氧化硅标准溶液的合成标准不确定度结果见表3。则定值结果为c = 1.000 g/L,U = 0.004 g/L,k = 2。
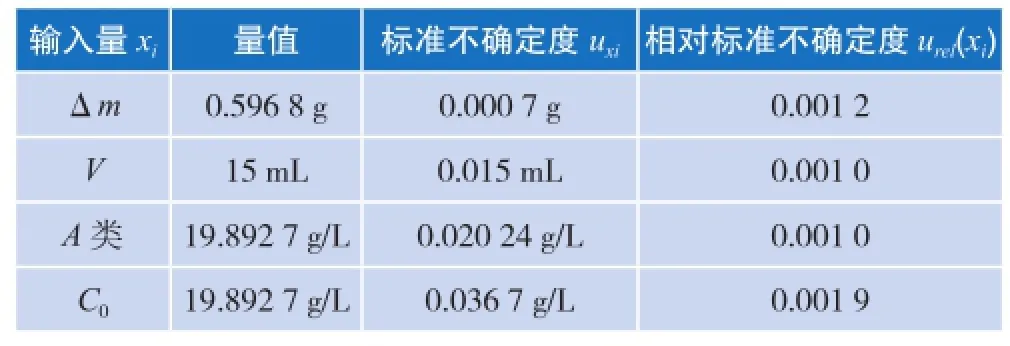
表2 方法三 高浓度二氧化硅溶液不确定度分量表
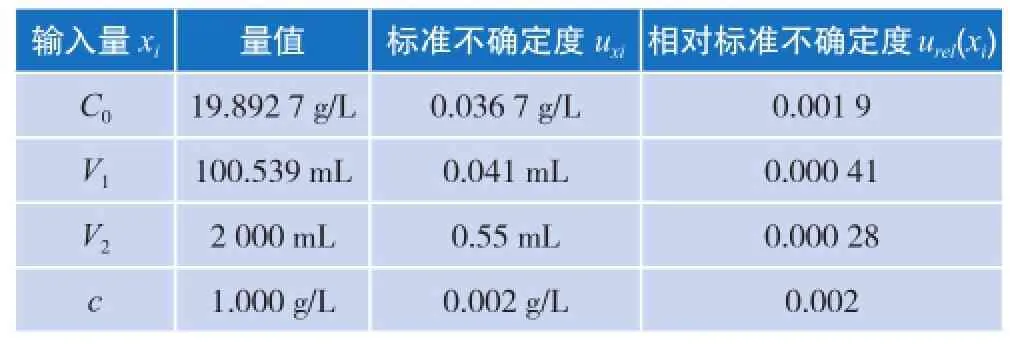
表3 方法三 二氧化硅标准溶液不确定度分量表
3 分析
本文使用三种方法配制了浓度为1 g/L二氧化硅标准溶液,与国家二级标准物质GBW(E)080272进行验证比对,结果见表4。
通过比较可知,三种方法的不确定度与同类型国家二级标准物质的不确定度水平相当。参照硅钼蓝分光光度法[8],与有证标准物质进行比对,结果符合下式
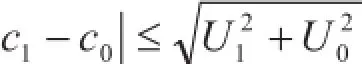
式中:c1— 标准溶液的测量值;
c0— 有证标准物质的测量值;
U1— 标准溶液稀释后的扩展不确定度(k = 2);
U0— 有证标准物质的扩展不确定度(k = 2)
结果表明,三种方法配制的二氧化硅标准溶液与有证标准物质结果一致,方法可靠。
其中方法一准确度最高,不确定度最小。该方法中,高纯度的二氧化硅易于制得,性质稳定易于保存,配制过程操作较为简单。此方法配制的关键是,加入过量的碳酸钠提高熔融反应的转化率,且熔融物需在热水中完全溶解后定容。该方法配制的不确定度主要来自于称量质量和定容体积引入的不确定度,通过改变称样量和定容体积可以减小不确定度。该方法配制的二氧化硅标准溶液均匀性、稳定性良好,可用于水体中硅含量的检测和硅酸根分析仪的校准等。方法二使用氟硅酸钠配制,氟硅酸钠呈粉末状易潮解,中等毒性有刺激性,且纯度低、含量复杂,因此在配制前需进行提纯和检验。配制过程与方法一相比更为简单,周期较短。此方法配制的不确定度主要来自于氟硅酸钠纯度引入的不确定度,因此准确度较低,不确定度较大。但配制过程简单,能现用现配,可用于准确度要求较低的分析检测,有效提高分析检测的周期和效率。方法三采用硅酸钠配制,该方法操作复杂,配制周期较长,需要两次定值,重复性引入的不确定度较大,与上述两种方法相比,应用较少。

表4 二氧化硅标准溶液比对验证
4 结语
经过以上分析可知,通过严格筛选原料纯度,控制操作步骤,使用经过法定计量检定部门检定校准的计量器具,可以有效保证标准溶液配制的重复性和准确性,对于提高测量的准确性和有效性具有重要意义。
[1] 西安热工研究所.SD 163-85 [S].北京:1985.
[2] 中国电力企业联合会.GB 12145-2008[S]. 北京:中国标准出版社,2008.
[3] 全国化学标准化技术委员会无机化工分会全国化学标准化技术委员会无机化工分会.HG/T 3252-2000 [S]. 北京:中国标准出版社,2000.
[4] 全国化学标准化技术委员会.GB/T 20020-2005 [S]. 北京:中国标准出版社,2005.
[5] 全国化学标准化技术委员会水处理剂分会.GB/T 12149-2007 [S].北京:中国标准出版社,2007.
[6] 全国法制计量技术委员会.JJF 1059.1-2012 [S].北京:中国计量出版社,2012.
[7] 全国统计方法应用标准化技术委员会.GB/T 8170-2008 [S]. 北京:中国标准出版社,2008.
Uncertainty evaluation of the preparation of the silicon dioxide standard solution
Bai Jing, Duan Manlei, Xia Wa, Ding Min
(Shanghai Institute of Measurement and Testing Technology)
Three methods of preparation of silicon dioxide standard solution were introduced and silicomolybdate blue spectrophotometric method was used to compare results. The factors of uncertainty were analyzed and the uncertainty evaluation was performed finally. The concentrations of silicon dioxide in three solutions were as following: 1.000 0±0.000 8,0.995±0.006,1.000±0.004(g/L, k=2). The results indicate that by screening purity of raw materials and simplifying operation steps, the uncertainty of standard solution can be effectively reduced and the accuracy of test results could be enhanced.
silicon dioxide; uncertainty; standard solution;spectrophotometric method
