间歇低氧合并肺气肿大鼠模型肝脏氧化应激及凝血功能的研究
2015-08-22马懿江何庆胡志东冯靖
马懿江,何庆,胡志东△,冯靖
间歇低氧合并肺气肿大鼠模型肝脏氧化应激及凝血功能的研究
马懿江1,何庆2△,胡志东1△,冯靖3
目的建立肺气肿合并间歇低氧(IH)的重叠综合征(OS)大鼠模型,探讨OS大鼠肝脏炎性损伤及其凝血功能的变化。方法将60只雄性Wistar大鼠随机分成正常组(A组)、IH组(B组)、肺气肿组(C组)和IH合并肺气肿组(D组)。通过对大鼠进行16周的熏烟暴露造成大鼠肺气肿;从13周开始,同时施加程控预制的间歇低氧/再氧合(IH/ROX)处理对大鼠进行IH暴露4周。暴露结束后取各组大鼠肺和肝脏组织于光镜下观察并计算肝脏炎性损伤病理评分。取肝组织匀浆采用ELISA方法测定其超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性和丙二醛(MDA)浓度。检测血浆纤维蛋白原(FIB),血浆因子FⅧ促凝活性(FⅧ:C)、血管性血友病因子抗原(vWF:Ag)和抗凝血酶活性(AT:A)水平。结果D组肝脏炎性损伤病理评分和凝血因子FIB、FⅧ:C、vWF:Ag水平均高于A、B、C组,而SOD和CAT活性以及AT:A水平低于其他3组(均P<0.05)。FIB、vWF:Ag、FⅧ:C、AT:A与SOD呈明显相关(r分别为-0.905、-0.941、-0.946和0.817,均P<0.01)。结论OS动物模型下IH和肺气肿在导致氧化应激和高凝状态上具有一定叠加效应,可引起更强的肝脏炎症反应和血栓前状态。
肺气肿;间歇低氧;氧化应激;超氧化物歧化酶;过氧化氢酶;丙二醛;凝血因子
阻塞性睡眠呼吸暂停(OSA)以上气道周期性部分或全部关闭为主要特征,通常伴氧饱和度下降和睡眠反复觉醒[1],发病率为2%~25%,且患病率呈逐年上升趋势[2]。慢性阻塞性肺疾病(COPD)的病理改变主要表现为慢性支气管炎和肺气肿,后者通常引起更严重的低氧、肺动脉压升高以及更高的病死率。COPD和OSA共存称为重叠综合征(OS),在成年人群中发病率约为1%[3]。OS患者相对单纯OSA 或COPD常伴有更显著的肺炎性损伤及血管内皮系统激活状态,导致卒中、急性冠脉综合征等一系列事件的发生[4]。目前认为COPD和OSA均属于慢性系统性炎症的组成部分。间歇低氧(IH)可造成线粒体电子传递链的功能障碍,导致活性氧(ROS)的释放,而再氧合(ROX)进一步激化此过程[5],因此IH/ROX引起的氧化应激成为COPD和OSA联系的关键[6]。研究发现低氧造成的高凝状态使COPD患者更容易出现静脉血栓栓塞[7]。因此,本研究通过建立肺气肿合并睡眠IH动物模型,以探讨其肝脏氧化应激及凝血功能变化的特点及其相关机制。
1 材料与方法
1.1材料
1.1.1实验动物及分组健康雄性4周龄Wistar大鼠60只,体质量120~150 g,购自中国医学科学院放射医学研究所实验动物中心。按随机数字表法将大鼠分为4组,每组15只:正常组(A组),IH组(B组),肺气肿组(C组),肺气肿合并IH组(D组)。
1.1.2试剂和仪器大前门香烟(天津卷烟厂);混合气体(天津六方气体公司);HE染液、ELISA试剂盒(南京建成生物科技公司)。熏烟箱和密封箱为储物箱和密封盒改制;组织匀浆器、37℃烤箱由天津医科大学内分泌研究所提供;氧浓度检测仪(瑞士夏美顿公司);血气分析仪(瑞士罗氏AVL 995);凝血分析仪(美国贝克曼ACL9000);日本Olympus光学显微镜及图像采集系统;北京航空航天大学彩色病理图像分析系统。
1.2方法
1.2.1OS大鼠模型的建立通过熏烟暴露造成大鼠肺气肿,在此基础上进行IH暴露,方法与本组既往研究一致[8]:A组:正常饲养;B组:从13~16周IH暴露:大鼠每天于睡眠时段(9:00~17:00)置于自制IH舱内,向舱内循环充入N2和空气,每一循环包括N230 s(使舱内最低氧浓度达到5%)和空气90 s(使舱内氧浓度恢复至21%);C组:常氧状态,持续烟熏暴露16周,于非睡眠阶段将大鼠置于自制熏箱内熏吸香烟,2次/d,30 min/次;D组:IH暴露13~16周,持续烟熏暴露16周。
1.2.2脑电图监测和动脉血气分析暴露前1周随机抽取5只大鼠监测各期睡眠脑电波。暴露结束前2 d,取此5只大鼠右股动脉血测量其动脉血pH值、二氧化碳分压[p(CO2)]、氧分压[p(O2)]和氧饱和度(SaO2)。
1.2.3血液指标测定暴露结束后收集每组剩余10只大鼠的静脉血8 mL,检测白细胞(WBC)计数、淋巴细胞(LYM)分类、红细胞(RBC)计数、血红蛋白(HGB)浓度和血小板(PLT)计数。经枸橼酸钠抗凝检测血浆抗凝血酶活性(AT:A)、纤维蛋白原(FIB)、血浆因子FⅧ促凝活性(FⅧ:C)和血管性血友病因子抗原(vWF:Ag)。
1.2.4标本处理取大鼠肺、肝脏组织各1 g,以4%甲醛溶液固定、石蜡包埋、切片、HE染色,光镜下观察。另取肝组织1 g研磨制成匀浆,采用ELISA方法检测超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性和丙二醛(MDA)浓度[9]。
1.2.5肝脏炎性损伤病理评分方法观察指标:炎细胞浸润程度和范围,肝细胞水肿程度和范围,肝细胞点状坏死范围。每项均按正常0分,较轻1分,轻度2分,中度3分,较重4分,重度5分进行评分,满分5分。每项指标表示为实际得分占最高预计分数的百分比。
1.3统计学方法采用SPSS 18.0软件处理数据。计量资料以±s表示,多组间均数比较采用单因素方差分析(One-Way ANOVA),组间多重比较采用Bonferroni法,相关性分析采用Pearson法。以P<0.05为差异有统计学意义。
2 结果
2.1动脉血气分析A组结果基本符合正常生理状态;C组p(O2)轻度降低,符合大鼠肺气肿特点;B组和D组p(O2)<60 mmHg,符合大鼠间歇低氧的状态,见表1。
Tab.1 Blood gas analysis between all four groups表1 动脉血气分析结果 (n=5,±s)

Tab.1 Blood gas analysis between all four groups表1 动脉血气分析结果 (n=5,±s)
1 mmHg=0.133 kPa
组别A组B组C组D组p(O2)(mmHg)94.30±2.61 51.52±1.18 73.02±2.18 45.36±2.33 p(CO2)(mmHg)41.86±2.34 37.02±0.91 48.86±2.89 42.34±3.15 SaO20.971±0.003 0.869±0.018 0.918±0.006 0.837±0.028 pH值7.41±0.01 7.42±0.01 7.36±0.01 7.41±0.01
2.2肺组织光镜特征C、D组大鼠肺气肿病理特征显著,表现为肺组织间质增厚和薄壁组织炎症,其中D组伴有炎细胞大量浸润,肺泡平均截距增高和平均肺泡数下降,见图1。
2.3肝脏组织光镜特征A组动物肝脏病理基本正常,B组有轻微炎症,而C、D组可见明显炎细胞浸润、肝细胞肿胀和气球样变,提示其肝脏炎性损伤严重,见图2。
2.4肝脏病理损伤和氧化应激水平肝脏炎性损伤病理评分和MDA浓度为D组>C组>B组>A组(均P<0.05),SOD和CAT活性为D组<C组<B组<A组(均P<0.05),见表2。
2.5血常规检查结果WBC、LYM、RBC、HGB和PLT水平均是D组>C组>B组>A组(均P<0.05),见表3。
Tab.2 Comparison of hepatic histological scores and indicators of oxidative stress among four groups表2 4组的肝脏炎性损伤病理评分和氧化应激指标比较 (n=10,±s)

Tab.2 Comparison of hepatic histological scores and indicators of oxidative stress among four groups表2 4组的肝脏炎性损伤病理评分和氧化应激指标比较 (n=10,±s)
*P<0.05;a与A组比较,b与B组比较,c与C组比较,P<0.05
组别A组B组C组D组F肝脏炎性损伤病理评分(%)8.00±1.49 13.60±2.95a58.00±4.62ab80.00±6.33abc672.494*SOD (U/mg protein)88.30±4.51 79.17±2.63a73.97±2.24ab63.86±3.73abc90.206*CAT (U/mg protein)113.82±6.31 92.46±5.31a79.03±5.06ab49.85±3.62abc270.257*MDA (nmol/mg protein)0.74±0.10 1.71±0.15a3.31±0.36ab6.73±1.47abc118.267*
Tab.3 Hematologic analysis表3 4组血常规指标比较 (n=10,±s)

Tab.3 Hematologic analysis表3 4组血常规指标比较 (n=10,±s)
*P<0.05;a与A组比较,b与B组比较,c与C组比较,P<0.05
组别A组B组C组D组F WBC(×109/L)3.34±0.21 3.52±0.26a4.64±0.55ab6.48±0.61abc106.16*LYM 0.425±0.029 0.577±0.055a0.649±0.030ab0.837±0.045abc169.03*组别A组B组C组D组F RBC(×1012/L)7.01±0.09 7.46±0.07a8.04±0.29ab8.60±0.21abc134.38*HGB(g/L)122.20±6.25 136.30±5.06a145.90±5.80ab157.20±8.07abc53.91*PLT(×109/L)829.80±23.90 974.40±30.46a1 134.80±73.78ab1 352.60±92.35abc130.02*
2.6凝血/抗凝因子检测凝血因子FIB、vWF:Ag 和FⅧ:C为D组>C组>B组>A组,而AT:A则为D组<C组<B组<A组(均P<0.05),见表4。
Tab.4 Comparision of coagulant/anticoagulant factors between all groups表4 各组大鼠凝血/抗凝因子水平比较 (n=10,±s)
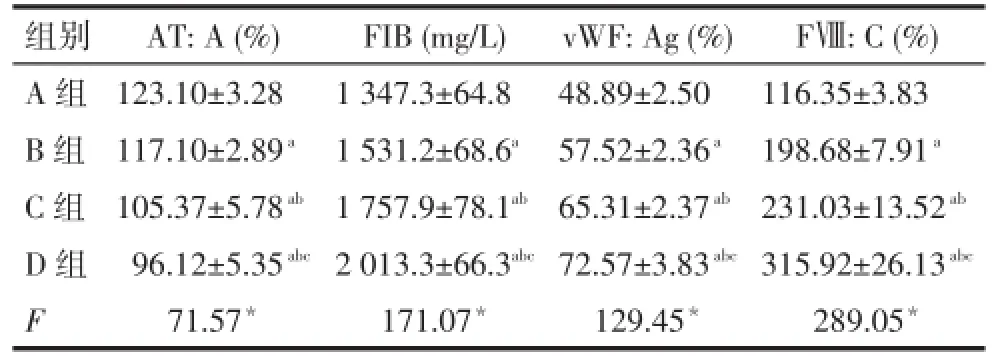
Tab.4 Comparision of coagulant/anticoagulant factors between all groups表4 各组大鼠凝血/抗凝因子水平比较 (n=10,±s)
*P<0.05;a与A组比较,b与B组比较,c与C组比较,P<0.05
组别A组B组C组D组F AT:A(%)123.10±3.28 117.10±2.89a105.37±5.78ab96.12±5.35abc71.57*FIB(mg/L)1 347.3±64.8 1 531.2±68.6a1 757.9±78.1ab2 013.3±66.3abc171.07*vWF:Ag(%)48.89±2.50 57.52±2.36a65.31±2.37ab72.57±3.83abc129.45*FⅧ:C(%)116.35±3.83 198.68±7.91a231.03±13.52ab315.92±26.13abc289.05*
2.7相关性分析SOD与FIB、vWF:Ag和FⅧ:C水平呈负相关,与AT:A呈正相关;CAT与FIB、vWF: Ag和FⅧ:C水平呈负相关,与AT:A呈正相关;MDA 与FIB、vWF:Ag和FⅧ:C水平呈正相关,与AT:A呈负相关,见表5。

Tab.5 Correlations between inflammatory parameters and coagulant/anticoagulant factors表5 肝脏氧化应激指标和凝血因子的相关系数
3 讨论
本实验通过对大鼠进行烟熏和IH暴露,成功建立了肺气肿合并睡眠IH的动物模型。在IH模型中,低氧与再氧合重复进行,细胞内氧急剧降低,产生大量ROS引起机体氧化应激及炎性损伤,且主要发生在再氧合阶段[10]。其中脂质过氧化产物MDA可间接反映细胞氧化应激水平;SOD及时清除超氧阴离子自由基,其活性可间接反映细胞清除氧自由基的能力;CAT催化分解过氧化氢,可保护细胞免受ROS造成的氧化应激损伤。本研究中,D组SOD和CAT活性均为最低,MDA浓度为最高,提示肝脏炎症可能由氧化应激始动的级联放大反应而引起。据文献报道,将高脂饮食小鼠暴露于IH环境中,出现比非暴露小鼠更严重的肝脏炎症,且伴有丙氨酸转氨酶(ALT)水平升高[11]。Barnes等[12]也证实,肝细胞经过低氧/再氧合的刺激之后,胞内ROS累积明显增加。因此,可能存在某种共同途径调节氧化应激和炎症反应,促使OS的抗氧化应激失衡。
本实验中C组和D组动物经同等程度的熏烟暴露,而后者炎细胞浸润和平均肺泡数下降程度均更为严重,推断IH可能加重肺气肿的程度。同时D组肝脏炎性损伤程度高于B、C组,提示IH和肺气肿在导致肝脏炎症上可能产生一定的叠加效应。肝脏反复的低氧/再氧合以及儿茶酚胺介导的系统性代谢异常使肝脏代谢向低氧性线粒体呼吸转变[13]。并且,肺组织所产生的炎症介质可能通过循环系统播散到全身各处,并激活肝脏释放更多炎性因子,对其他靶器官造成损害,最后引起系统性炎症[14]。
D组的WBC、LYM水平高于其余3组,提示外周血中白细胞尤其是淋巴细胞在系统性炎症中的重要作用。在炎症之初,激活的淋巴细胞通过释放ROS和蛋白酶导致炎性损伤和肺气肿的进展。D组升高的RBC和HGB水平还提示IH可加重由肺气肿引起的红细胞增多症和血液高黏滞状态。在低氧环境中,HGB的自身氧化更易进行,结果产生更多超氧自由基。由此可见,OS可能通过炎症和氧化应激的途径加强高凝状态,从而促使毛细血管内血栓的形成。
血液中FⅧ通过共价键与vWF形成复合物,当凝血酶被激活后,FⅧ与复合物解离,在作用于因子IXa之后被迅速清除。本实验中,建立了肺气肿的组别(C、D组)凝血因子水平显著升高,而抗凝因子则明显抑制。所以同单纯IH组相比,烟熏暴露导致的肺气肿(不论是否合并IH)不但可造成炎症前状态,还能导致较强程度的血栓前状态和高凝状态,使血管事件的风险增高,同既往研究相一致[15]。Bendz等[16]首次提出低氧可能是静脉血栓风险升高的原因之一,并证明低氧能直接调节微循环的内皮系统、屏障系统和凝血功能。据尸检研究报道,死于COPD恶化的患者有30%存在肺血栓栓塞[17]。
本研究证实,肝脏氧化应激指标(SOD、CAT、MDA)同凝血因子和抗凝因子具有相关性。既往有报道称炎症和凝血过程受某种共同的激活途径和反馈调节的控制[18]。一方面炎症可影响血栓的形成过程,另一方面凝血亢进和纤溶抑制可导致更严重的炎性反应,如此恶性循环。提示IH和肺气肿在导致氧化应激损伤和破坏凝血功能两方面呈现出叠加效应[19-20]。
(图1、2见插页)
[1]Harding SM.Complications and consequences of obstructive sleep apnea[J].Curr Opin Pulm Med,2000,6(6):485-489.
[2]Li X,Li YP,Wu HJ,et al.What is the most important factor affecting the cognitive function of obstructive sleep apnea syndrome patients: a single center study[J].Chinese Journal of Contemporary Neurolo⁃gy and Neurosurgery,2013,13(5):416-422.[李想,李雁鹏,吴惠涓,等.阻塞性睡眠呼吸暂停综合征患者认知功能评价及影响因素分析[J].中国现代神经疾病杂志,2013,13(5):416-422].doi:10.3969/j.issn.1672⁃6731.2013.05.012.
[3]Ioachimescu OC,Teodorescu M.Integrating the overlap of obstruc⁃tive lung disease and obstructive sleep apnoea:OLDOSA syndrome [J].Respirology,2013,18(3):421-431.
[4]Verbraecken J,McNicholas WT.Respiratory mechanics and ventila⁃tory control in overlap syndrome and obesity hypoventilation[J]. Respir Res,2013,14:132.
[5]van Eeden SF,Sin DD.Chronic obstructive pulmonary disease:a chronic systemic inflammatory disease[J].Respiration,2008,75(2): 224-238.
[6]Thomsen M,Dahl M,Lange P,et al.Inflammatory biomarkers and comorbidities in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2012,186(10):982-988.
[7]Rizkallah J,Man SF,Sin DD.Prevalence of pulmonary embolism in acute exacerbations of COPD:a systematic review and meta analysis [J].Chest,2009,135(3):786-793.
[8]Wang Y,Cao J,Yang QC,et al.Systematic and endothelial inflam⁃mation status and endothelial progenitor cell levels in peripheral blood in intermittent hypoxia and emphysema rat model[J].Tianjin Medical Journal,2014,42(5):427-431.[王彦,曹洁,杨庆婵,等.间歇低氧合并肺气肿大鼠系统与内皮炎症状态及外周血内皮祖细胞水平研究[J].天津医药,2014,42(5):427-431].
[9]Feng J,Chiang AA,Wu Q,et al.Sleep-related hypoxemia aggra⁃vates systematic inflammation in emphysematous rats[J].Chin Med J(Engl),2010,123(17):2392-2399.
[10]Lavie L.Obstructive sleep apnoea syndrome--an oxidative stress disorder[J].Sleep Med Rev,2003,7(1):35-51.
[11]Polotsky VY,Patil SP,Savransky V,et al.Obstructive sleep apnea,insulin resistance,and steatohepatitis in severe obesity[J].Am J Respir Crit Care Med,2009,179(3):228-234.
[12]Barnes PJ.Chronic obstructive pulmonary disease:effects beyond the lungs[J].PLoS Med,2010,7(3):e1000220.
[13]Sookoian S,Rosselli MS,Gemma C,et al.Epigenetic regulation of insulin resistance in nonalcoholic fatty liver disease:impact of liver methylation of the peroxisome proliferator-activated receptor gam⁃ma coactivator 1alpha promoter[J].Hepatology,2010,52(6):1992-2000.
[14]Sundaram SS,Sokol RJ,Capocelli KE,et al.Obstructive sleep ap⁃nea and hypoxemia are associated with advanced liver histology in pediatric nonalcoholic fatty liver disease[J].J Pediatr,2014,164(4): 699-706 e1.
[15]Eid AA,Ionescu AA,Nixon LS,et al.Inflammatory response and body composition in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2001;164(8 Pt 1):1414-8.
[16]Bendz B,Rostrup M,Sevre K,Andersen TO,Sandset PM.Associa⁃tion between acute hypobaric hypoxia and activation of coagulation in human beings[J].Lancet,2000;356(9242):1657-8.
[17]Sabit R,Thomas P,Shale DJ,et al.The effects of hypoxia on mark⁃ers of coagulation and systemic inflammation in patients with COPD [J].Chest,2010,138(1):47-51.
[18]Poredos P,Jezovnik MK.The role of inflammation in venous throm⁃boembolism and the link between arterial and venous thrombosis[J]. Int Angiol,2007,26(4):306-311.
[19]Feng J,Wang QS,Chiang A,et al.The effects of sleep hypoxia on co⁃agulant factors and hepatic inflammation in emphysematous rats[J]. PloS One,2010;5(10):e13201.
[20]Liu YM,Gao ML,Cao J,et al.Hepatic oxidative stress and inflam⁃mation in emphysema and intermittent hypoxia rat model[J].Tianjin Medical Journal,2014,42(2):147-150.[刘亚萌,高梦丽,曹洁,等.肺气肿合并间歇低氧大鼠模型肝脏的氧化应激及炎症损伤[J].天津医药,2014,42(2):147-150].
(2014-10-01收稿2014-10-31修回)
(本文编辑闫娟)
Hepatic oxidative stress and coagulation status in rat model of pulmonary emphysema combined with intermittent hypoxia
MA Yijiang1,HE Qing2△,HU Zhidong1△,FENG Jing3
1 Department of Laboratory,2 Department of Endocrinology,3 Department of Pneumology,General Hospital of Tianjin Medical University,Tianjin 300052,China
ObjectiveTo establish the rat overlap syndrome(OS)model of intermittent hypoxia(IH)combined with pulmonary emphysema and to explore its connection with hepatic oxidative stress,inflammatory status in the live and coagu⁃lation profile.MethodsMale Wistar rats(n=60)were randomly divided into four groups:control group(A),IH group(B),pulmonary emphysema group(C)and OS group(D).The rat model of pulmonary emphysema was established by exposing rats in smoke for 16 weeks.From the 13thweek,pre-programmed intermittent hypoxia/re-oxygenation(IH/ROX)exposure was given in the meantime of smoke exposure in OS group.Liver tissues were sectioned or triturated for pathological scoring or for detecting expression levels of superoxide dismutase(SOD),catalase(CAT)and malondialdehyde(MDA)respectively.Se⁃rum levels of coagulant/anticoagulant factors such as antithrombin(AT),fibrinogen(FIB),von Willebrand factor(vWF)and FactorⅧ(FⅧ)were also evaluated using biochemistry analysis.ResultsThe levels of pathological scores and coagulant factors(FIB,FⅧ:C and vWF:Ag)were significantly higher in group D than those in group A,B and C.The values of SOD,CAT and AT were significantly lower in group D than those in other three groups.Serum levels of FIB,vWF:Ag,FⅧ:C and AT:A correlated with SOD(r equal to-0.905、-0.941、-0.946 and 0.817 respective,P<0.01).ConclusionIn rat overlap syndrome when IH combined with pulmonary emphysema,hepatic inflammation and coagulability present mutual promotion effect and produce a more significant liver-derivative inflammatory and prothrombotic status.
pulmonary emphysema;intermittent hypoxia;oxidative stress;superoxide dismutase;catalase;malondialde⁃hyde;blood coagulation factors
R563.3
ADOI:10.11958/j.issn.0253-9896.2015.02.002
国家自然科学基金资助(81270144,30800507,81170071)
1天津医科大学总医院检验科(邮编300052),2内分泌科,3呼吸科
马懿江(1987),女,硕士在读,主要从事睡眠低氧性疾病研究
△E-mail:hech69@hotmail.com;huzhidong27@163.com
