间歇低氧对大鼠肺组织RhoA/ROCK通路及肺血管新生肌化的影响
2015-08-22杨晓琨高梦丽刘亚萌李彩丽曹洁冯靖
杨晓琨,高梦丽,刘亚萌,李彩丽,曹洁,冯靖
间歇低氧对大鼠肺组织RhoA/ROCK通路及肺血管新生肌化的影响
杨晓琨,高梦丽,刘亚萌,李彩丽,曹洁△,冯靖△
目的探讨间歇低氧(IH)对大鼠肺组织RhoA/ROCK通路及肺血管新生肌化的影响。方法将40只Wistar雄性大鼠随机分为对照组和IH组各20只,对照组:间歇正常氧暴露(21%O2);IH组:IH暴露(5%~21%O2),持续4周。暴露结束后,2组均采用Real-time PCR和Western blot检测肺组织RhoA、ROCK mRNA和蛋白表达情况,免疫组化法测定肺组织和肺动脉的增殖细胞核抗原(PCNA)及α-平滑肌肌动蛋白(SM-α-actin)的表达情况。结果IH组肺组织RhoA mRNA(0.463±0.067 vs 0.182±0.040)、ROCK mRNA(0.384±0.062 vs 0.192±0.052)、RhoA蛋白(0.827±0.065 vs 0.424±0.075)及ROCK蛋白(0.488±0.088 vs 0.336±0.102)表达水平均高于对照组(均P<0.05);IH组肺组织PCNA[(54.67±1.80)%vs(9.14±0.91)%]、肺动脉PCNA[(49.40±1.21)%vs(8.38±1.13)%]、肺组织SM-α-actin[(42.66±1.63)%vs(35.44±1.41)%]与肺动脉SM-α-actin[(62.62±2.53)%vs(45.54±2.58)%]表达水平均明显高于对照组(均P<0.05)。结论RhoA/ROCK传导通路在IH所致肺动脉高压发病机制中可能起着重要作用;IH可通过促进肺动脉的新生肌化进一步促进肺动脉压力升高。
缺氧;高血压,肺性;增殖细胞核抗原;肌动蛋白类;间歇低氧;肺动脉高压;RhoA/ROCK
阻塞性睡眠呼吸暂停(OSA)是一种常见的睡眠呼吸疾病,特征为反复发生上气道塌陷而导致慢性间歇低氧(IH)[1]。而肺动脉高压(PH)是一类以肺动脉压力增高,伴有或不伴有肺小动脉病变的恶性肺血管疾病。有研究发现OSA是PH产生的独立危险因素之一[2]。RhoA/ROCK信号通路是近年的研究热点,在低氧性肺血管收缩与重构中发挥重要作用。近期有文献报道,在PH中新生肌化是肺动脉压力增加的最主要来源[3]。但目前对IH影响PH中肺组织RhoA/ROCK通路表达及肺血管新生肌化的系统性研究较少,本研究通过建立IH的大鼠模型以模拟OSA,研究大鼠肺组织RhoA/ROCK通路相关基因和蛋白的表达及肺血管新生肌化情况,探讨其在PH发病过程中的作用。
1 材料与方法
1.1材料
1.1.1实验动物健康雄性Wistar大鼠40只,4周龄,体质量120~150 g,购自中国科学院放射医学研究所实验动物中心(许可证号:SCXK津2010-0002)。
1.1.2主要仪器和试剂氧浓度监测仪(瑞士夏美顿公司);低流量流速表(余姚工业自动化仪表厂);氧气减压器(天津减压器厂);血气分析仪(瑞士罗氏AVL995);光学显微镜(日本OLYMPUS BX4.0);数码相机(日本佳能3301);RhoA、Rho激酶引物序列(北京华大引物公司);梯度PCR仪(Bio-Rad公司);Real-time PCR仪(Lightcycle Roche公司);RNA浓度测定仪(环亚生物科技有限公司);电泳仪(美国PowerPac Ba⁃sic Bio-Rad公司);石蜡切片机(德国Leica公司);RhoA抗体、ROCK抗体(美国Cell Signaling公司);GAPDH羊抗兔多克隆抗体(美国EarthOx公司);兔抗鼠PCNA多克隆抗体、兔抗鼠SM-α-actin多克隆抗体(EPIT MICS公司);即用型SP免疫组化通用试剂盒(天津市津脉基因测绘技术有限公司);羊抗兔多克隆抗体(EARTHOX公司);二氨基联胺苯(DAB)试剂盒(北京中杉金桥公司)。
1.2方法
1.2.1睡眠间歇低氧大鼠模型的建立将40只大鼠分为2组:对照组(20只),通过自行研制模拟OSA模式间歇低氧/再氧合(IH/ROX)气体环境系统,向间歇低氧舱内脉冲式冲入空气,氧浓度为21%。IH组(20只),向舱内循环充入氮气和空气,每个循环120 s,即30 s充入氮气,90 s充入空气。以上处理均在大鼠睡眠时间(每天9:00~17:00)进行,持续4周。
1.2.2预实验血气值测定[4]暴露结束后,每组各取5只大鼠测定动脉血pH值、二氧化碳分压[p(CO2)]、氧分压[p(O2)]和动脉血氧饱和度(SaO2)。
1.2.3实验标本的留取各组剩余大鼠均用腹主动脉放血法处死,迅速取出大鼠肺组织,并将右肺下叶少血部位切成1 cm×0.5 cm组织块,液氮速冻后转入-80℃冰箱保存备用。
1.2.4Real time-PCR检测肺组织RhoA、ROCK mRNA表达水平引物设计见表1。PCR循环参数:95℃预变性5 min,然后95℃10 s,60℃1 min,72℃20 s,进行39个循环,最后72℃延伸10 min。以GAPDH为内参来校正目的基因的表达量,结果以目的基因表达量/GAPDH基因表达量来表示,重复3次取平均值。
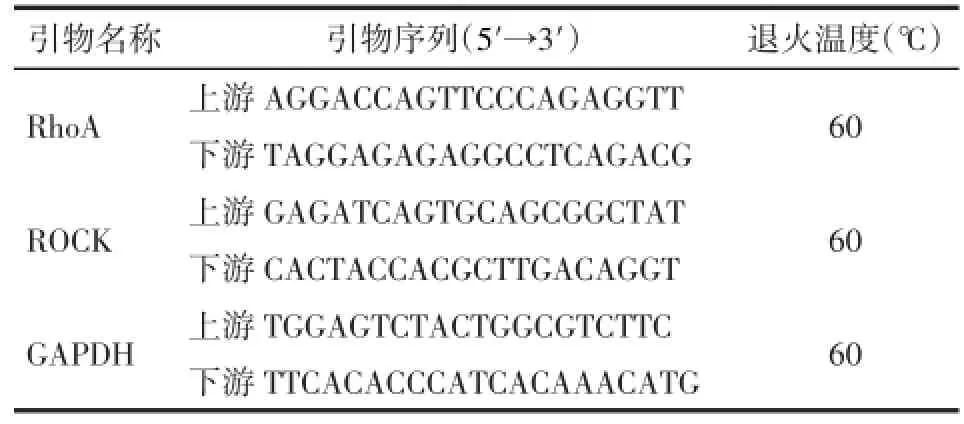
Tab.1 Primers used for real-time-PCR表 1Real-time-PCR引物
1.2.5Western blot法检测肺组织RhoA、ROCK蛋白表达水平取解冻后肺组织(约0.2 g)加入1.5 mL细胞裂解液,匀浆、低温离心(3 000 r/min),取上清液用BCA法蛋白定量后将蛋白变性备用。SDS-PAGE蛋白电泳获得图像后用Im⁃age J软件进行灰度值分析,计算目标条带蛋白与GAPDH表达的灰度值的比值。
1.2.6免疫组化法检测肺组织和肺动脉中增殖细胞核抗原(PCNA)及α-平滑肌肌动蛋白(SM-α-actin)的表达取解冻肺组织放入4%的多聚甲醛中固定72 h,免疫组化染色操作按SP试剂盒说明书进行,并用DAB显色,SM-α-actin稀释比例为1∶1 000,PCNA稀释比例为1∶100,以磷酸盐缓冲液(PBS)代替一抗作阴性对照。(1)PCNA表达结果判读:以细胞核中出现棕黄色颗粒作为阳性细胞。每张切片任意选择5个高倍镜视野(×400),测量每个视野下阳性细胞的百分比后取均值。(2)SM-α-actin表达结果判读:阳性表达为胞浆内有细丝状棕黄色着色。肺血管重构时肌化的程度以完全肌化的血管数目占肺小血管总数的百分比来表示。
1.3统计学方法采用SPSS18.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1预实验血气分析结果2组大鼠动脉血pH值均在正常范围,IH组低氧结束后SaO2低于0.9,p(O2)下降至(50.00±2.74)mm Hg,表明IH模型建立成功,见表2。
Tab.2 The values of arterial blood gas in two groups表2 2组动脉血气分析结果 (n=5,±s)

Tab.2 The values of arterial blood gas in two groups表2 2组动脉血气分析结果 (n=5,±s)
1 mmHg=0.133 kPa
组别对照组IH组pH值7.410±0.012 7.406±0.011 p(CO2)(mmHg)39.20±2.39 34.60±0.89 p(O2)(mmHg)109.00±3.81 50.00±2.74 SaO20.992±0.005 0.864±0.018
2.2肺组织RhoA、ROCK mRNA和蛋白表达水平IH组肺组织RhoA、ROCK的mRNA和蛋白表达水平均明显高于对照组(均P<0.05),见表3。
Tab.3 RhoA/ROCK pathway in two groups表3 2组RhoA/ROCK表达水平比较 (n=5,±s)

Tab.3 RhoA/ROCK pathway in two groups表3 2组RhoA/ROCK表达水平比较 (n=5,±s)
*P<0.05
组别对照组IH组t mRNA RhoA 0.182±0.040 0.463±0.067 7.200*ROCK 0.192±0.052 0.384±0.062 4.751*蛋白RhoA 0.424±0.075 0.827±0.065 11.427*ROCK 0.336±0.102 0.488±0.088 3.195*
2.3肺组织和肺动脉中PCNA及SM-α-actin表达水平比较IH组肺组织和肺动脉的PCNA及SM-α-actin表达水平明显高于对照组(均P<0.05),见表4。
Tab.4 The SM-α-actin and PCNA expression in lung and pulmonary artery in two groups表4 2组肺组织和肺动脉中PCNA及SM-α-actin表达水平比较 (n=5,±s)
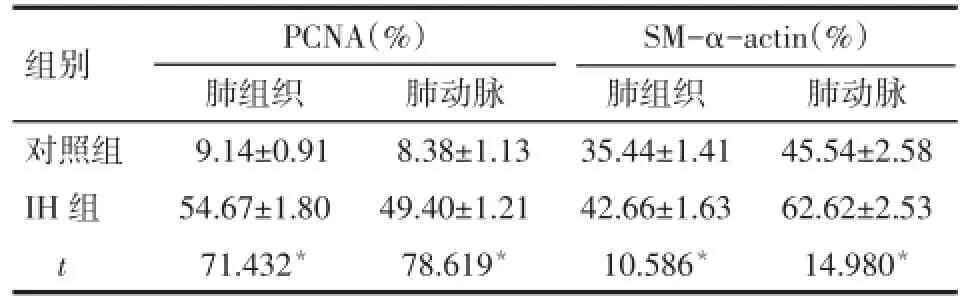
Tab.4 The SM-α-actin and PCNA expression in lung and pulmonary artery in two groups表4 2组肺组织和肺动脉中PCNA及SM-α-actin表达水平比较 (n=5,±s)
*P<0.05
组别对照组IH组t PCNA(%)肺组织9.14±0.91 54.67±1.80 71.432*肺动脉8.38±1.13 49.40±1.21 78.619*SM-α-actin(%)肺组织35.44±1.41 42.66±1.63 10.586*肺动脉45.54±2.58 62.62±2.53 14.980*
3 讨论
PH是指肺内循环系统发生的高血压,OSA的肺高压属于第3大类与呼吸系统疾病或缺氧相关的PH[3]。研究发现PH的病理学改变包括内皮细胞的损伤、增殖、肺血管平滑肌细胞的高反应性增生及炎症细胞的迁移和黏附[5]。目前认为低氧和CO2潴留所诱导的肺血管收缩、血管内皮功能下降及呼吸暂停期间的气管内负压增加是OSA患者形成PH的主要原因[6]。本研究中预实验血气分析结果显示,IH组大鼠p(O2)和SaO2均周期性降低及恢复正常,可模拟OSA模式IH暴露环境。
RhoA/ROCK通路的关键信号分子包括Rho蛋白、ROCK和肌球蛋白磷酸酶(MLC)。Xu等[7]研究发现ROCK特异性的抑制剂Y-27632可显著降低缺氧所导致的新生小鼠的右心室肥厚,逆转动脉血管壁的重建,同时减少缩血管物质内皮素-1(ET-1)和内皮素-A(ET-A)的受体。RhoA/ROCK的作用是复杂的,缺血再灌注损伤后ROCK活性增加,并且促进白细胞浸润,从而参与早期炎症反应[8],ROCK抑制剂法舒地尔可显著减轻内皮损伤,并促进肺血管重建及阻止慢性低氧介导的肺动脉压力增高[9];还有研究认为Rho抑制剂C3胞外酶可显著减弱内皮祖细胞(EPC)迁移、黏附等功能,并降低体外血管形成的能力[10]。低氧可以诱导RhoA/ROCK通路的活化,而RhoA/ROCK通路异常活化又为PH发生的重要起始环节之一[11]。RhoA/ROCK通路还可通过破坏内皮型一氧化氮合酶(eNOS)mRNA的稳定性导致一氧化氮(NO)合成减少,从而增强肺血管收缩,最终导致肺动脉压的升高[12]。RhoA/ROCK通路可能就是通过这些机制在OSA患者PH的形成中发挥重要作用。本研究显示在IH大鼠模型中肺组织RhoA、ROCK mRNA和蛋白的表达水平明显高于对照组,与有关研究结果一致[13],由此笔者推测,缺氧是IH暴露导致PH的重要因素,而在缺氧引起的肺血管收缩和重建中,Rho/ROCK通路表达可能发挥重要作用,近期还有研究发现血循环中中性粒细胞RhoA/ROCK通路表达活性可以作为判断早期PH的指标[14]。
PH主要的病理生理改变为肺血管的收缩和重塑(包括平滑肌的增生及小动脉的新生等)[3]。而血管的新生肌化主要表现为原位平滑肌细胞(SMC)的增殖和迁徙、干细胞的分化、纤维细胞或内皮细胞获得平滑肌细胞的表型等。PCNA是一种仅在增殖细胞中合成或表达的核内多肽,是一种可靠的评价细胞增殖状态的指标[15]。有研究发现IH大鼠肺血管细胞中PCNA的表达显著增加,PCNA的表达量与SMC的增殖活力呈正相关[16]。近年来研究发现PC⁃NA还可以调节细胞的凋亡及自然杀伤细胞的激活。SM-α-actin是干细胞向初始SMC分化的标志,SM-α-actin基因的表达高低与SMC的分化程度密切相关[17]。由此笔者推测测定肺血管PCNA及SM-α-actin的表达可有效反映肺血管平滑肌的增殖、收缩及肺血管的新生肌化情况,而肺血管的收缩及新生肌化又是肺动脉压力升高的主要原因。因此测定肺血管PCNA及SM-α-actin的表达可在一定程度上反映肺动脉压力的变化。
Sajkov等[2]研究发现IH可导致动脉平滑肌细胞的增殖,经过数周IH的大鼠可出现明显的肺动脉重构。de Fruto等[18]进一步发现IH增加平滑肌细胞SM-α-actin表达,进而增加动脉壁厚度引起动脉重建。而PCNA可能通过促进细胞增殖,导致血管壁肥厚及管腔狭窄,进而引起动脉压力的升高。这些均与肺动脉新生肌化导致肺动脉压力增高密切相关。本研究通过测定模型大鼠肺组织和肺动脉中PCNA及SM-α-actin表达情况来反映肺动脉压力的升高情况,结果发现IH组大鼠肺组织及肺动脉的PCNA及SM-α-actin表达水平均明显高于对照组,推测IH可引起大鼠肺血管平滑肌的增殖、肺血管新生肌化及收缩能力的增强。
综上,RhoA/ROCK通路可能在低氧性血管收缩及肺血管重构中发挥重要作用,若能及早抑制RhoA/ROCK通路激活,从而减轻低氧血管收缩及肺血管重构,减缓PH的进展,可为预防和控制OSA并发PH提供新思路。
[1]Chen BY,He QY.Obstructive sleep apnea syndrome and multiple systems consequences[J],Zhonghua Yi Xue Za Zhi,2012,92(18): 1225-7.[陈宝元,何权瀛.阻塞性睡眠呼吸暂停综合征的系统性损害[J].中华医学杂志,2012,92(18):1225-1227].
[2]Sajkov D,Mcevoy RD.Obstructive sleep apnea and pulmonary hy⁃pertension[J].Prog Cardiovasc Dis,2009,51:363-370.doi: 10.1016/j.pcad.2008.06.001.
[3]Montani D,Günther S,Dorfmüller P,et al.Pulmonary arterial hyper⁃tension[J].Orphanet J Rare Dis,2013,8(1):97.doi:10.1186/1750-1172-8-97.
[4]Wang Y,Cao J,Yang QC,et al.Systematic and endothelial inflam⁃mation status and endothelial progenitor cell levels in peripheral blood in intermittent hypoxia and emphysema rat model[J],Tianjin Med J,2014,42(5):427-431.[王彦,曹洁,杨庆婵,等.间歇低氧合并肺气肿大鼠系统与内皮炎症状态及外周血内皮祖细胞水平研究[J].天津医药,2014,42(5):427-431].
[5]Rubin LJ.Pulmonary arterial hypertension[J].Proc Am Thorac Soc,2006,3(1):111-115.
[6]Leung RS,Bradley TD.Sleep apnea and cardiovascular disease[J]. Am J Respir Crit Care Med,2001,164(12):2147-65.Review.
[7]Xu ZE,Kantores C,lvanovska J,et al.Rescue treatment with a Rhokinase inhibitor normalizes fight ventricular function and reverses remodeling in juvenfle rats with chronic pulmonary hypertension[J]. Am J Physiol Heart Circ Physiol,2010,299(6);H1854-864.doi: 10.1152/ajpheart.00595.2010.
[8]Wang QM,Stalker TJ,Gong Y,et al.Inhibition of Rho-kinase atten⁃ uates endothelial-leukocyte interaction during ischemia-reperfu⁃sion injury[J].Vasc Med,2012,17(6):379-385.doi:10.1177/ 1358863X12459790.
[9]Mouchaers KT,Schalij I,de Boer MA,et al.Fasudil reduces mono⁃crotaline-induced pulmonary arterial hypertension:comparison with bosentan and sildenafil[J].Eur Respir J,2010,36(4):800-7. doi:10.1183/09031936.00130209.
[10]Yang JX,Chen B,Pan YY,et al.Zoledronate attenuates angiogenic effects of angiotensin II-stimulated endothelial progenitor cells via RhoA and MAPK signaling[J].PLoS One,2012,7(10):e46511.doi: 10.1371/journal.pone.0046511.
[11]Fukumoto Y,Tawara S,Shimokawa H.Recent progress in the treat⁃ment of pulmonary arterial hypertension:expectation for rho-kinase inhibitors[J].Tohoku J Exp Med,2007,211(4):309-20.
[12]Gien J,Seedorf GJ,Balasubramaniam V,et al.Chronic intrauterine pulmonary hypertension increases endothelial cell Rho kinase activ⁃ity and impairs angiogenesis in vitro[J].Am J Physiol Lung Cell Mol Physiol,2008,295(4):L680-7.doi:10.1152/ajplung.00516.2007.
[13]Guilluy C,Eddahibi S,Agard C,et al.RhoA and Rho kinase activa⁃tion in human pulmonary hypertension:role of 5-HT signaling[J]. Am J Respir Crit Care Med,2009,179(12):1151-1158.doi: 10.1164/rccm.200805-691OC.
[14]Do e Z,Fukumoto Y,Takaki A,et al.Evidence for Rho-kinase acti⁃vation in patients with pulmonary arterial hypertension[J].Circ J,2009,73(9):1731-1739.
[15]Liu HW,Iwai M,Takeda-Matsubara Y,et al.Effect of estrogen and AT1 receptor blocker on neointima formation[J].Hypertension,2002,40(4):451-457;discussion 448-450.
[16]Reinke C,Bevans-Fonti S,Grigoryev DN,et al.Chronic intermit⁃tent hypoxia induces lung growth in adult mice[J].Am J Physiol Lung Cell Mol Physiol,2011,300(2):L266-73.doi:10.1152/aj⁃plung.00239.2010.
[17]Hu B,Dobson J,El Haj AJ.Control of smooth muscle α-actin (SMA)up-regulation in HBMSCs using remote magnetic particle mechano-activation[J].Nanomedicine,2014,10(1):45-55.doi: 10.1016/j.nano.2013.06.014.
[18]de Fruto S,Caldwell E,Nitta CH,et al.NFATc3 contributes to in⁃termittent hypoxia-induced arterial remodeling in mice[J].Am J Physiol Heart Circ Physiol,2010,299(2):H356-63.doi:10.1152/ ajpheart.00341.2010.
(2014-09-29收稿2014-10-20修回)
(本文编辑闫娟)
Effect of intermittent hypoxia on RhoA/ROCK pathway in lung and on the muscularization in pulmonary vascular in rat model
YANG Xiaokun,GAO Mengli,LIU Yameng,LI Caili,CAO Jie△,FENG Jing△
Department of respiratory,Tianjin Medical University General Hospital,Tianjin 300052,China
△Corresponding AuthorE-mail:tjcaojie@sina.com;zyyhxkfj@126.com
ObjectiveTo explore the effect of intermittent hypoxia(IH)on RhoA/ROCK pathway in lung and on the muscularization in pulmonary vascular in rat model.MethodsWistar rats(n=40)were randomly divided into two groups: the normal oxygen control group(n=20)and the IH group(n=20).For 4 weeks,rats in control group and IH group were ex⁃posed to intermittent normal oxygen(21%O2)or IH(5%-21%O2)respectively.Then,mRNA transcription and protein trans⁃lation levels of RhoA/ROCK were examined by Real-time PCR and Western blot.Expression of proliferation cell nuclear an⁃tigen(PCNA)and α-smooth muscle actin(SM-α-actin)of lung and pulmonary artery were detected by immunohistochemis⁃try.ResultsRhoA mRNA transcription level(0.463±0.067 vs 0.182±0.040),ROCK mRNA transcription level(0.384± 0.062 vs 0.192±0.052),RhoA protein expression level(0.827±0.065 vs 0.424±0.075)and ROCK protein expression level (0.488±0.088 vs 0.336±0.102)were higher in IH group than those in control group(P<0.05);Levels of PCNA in lung tissue[(54.67±1.80)%vs(9.14±0.91)%],PCNA in pulmonary artery[(49.40±1.21)%vs(8.38±1.13)%],SM-α-actin in lung tis⁃sue[(42.66±1.63)%vs(35.44±1.41)%]and SM-α-actin in pulmonary artery[(62.62±2.53)%vs(45.54±2.58)%]were also higher in IH group than those in control group(P<0.05).ConclusionRho/ROCK pathway may play an important role in developing pulmonary hypertension(PH)associated with IH;and IH can promote the muscularization in pulmonary vascular to accelerate PH.
anoxia;hypertension,pulmonary;proliferating cell nuclear antigen;actins;intermittent hypoxia;pulmonary hypertension;RhoA/ROCK
R56
ADOI:10.11958/j.issn.0253-9896.2015.02.001
国家自然科学基金资助项目(81270144,30800507,81170071)
天津医科大学总医院呼吸科(邮编300052)
杨晓琨(1988),女,硕士在读,主要从事睡眠低氧性疾病研究
△E-mail:tjcaojie@sina.com;zyyhxkfj@126.com
