间充质干细胞移植减轻大鼠肺气肿及氧化应激的探讨
2015-08-22金志贤毕虹周开华杜俊毅陈敏王清潘兴华
金志贤,毕虹,周开华,杜俊毅,陈敏,王清△,潘兴华
间充质干细胞移植减轻大鼠肺气肿及氧化应激的探讨
金志贤1,毕虹1,周开华1,杜俊毅1,陈敏1,王清1△,潘兴华2△
目的研究间充质干细胞(MSCs)移植在肺气肿大鼠氧化应激和肺气肿发展过程中的作用。方法26只雌性SD大鼠随机分为对照组(A组,n=8),肺气肿组(B组,n=8),肺气肿+MSCs移植组(C组,n=10),将B与C组大鼠在香烟烟雾中暴露14周,制作肺气肿大鼠模型,C组大鼠予MSCs移植。完成4次MSCs移植后的2、4周分别处死C组大鼠各1只,观察MSCs在肺气肿大鼠肺部的定植情况;MSCs移植8周后同时处死各组大鼠,观察大鼠肺组织病理形态,并进行定量分析;用硫代戊巴比妥法测定血清和肺组织匀浆中丙二醛(MDA)的水平,用WST-1法测定各组血清和肺组织匀浆中超氧化物歧化酶(SOD)的水平。结果MSCs移植后2周及4周,C组大鼠肺组织内均可见标记过的MSCs,随着时间的推移,肺组织内MSCs比例逐渐减少。B组和C组大鼠的肺组织呈现肺气肿样改变,B组和C组大鼠肺组织的平均内衬间隔(MLI)高于A组,平均肺泡数(MAN)明显低于A组,B组大鼠肺组织的MLI高于C组,MAN低于C组(P<0.05)。B组和C组大鼠血清及肺组织中MDA高于A组,SOD低于A组,B组血清及肺组织中MDA高于C组,SOD低于C组(P<0.05)。结论MSCs移植可能通过降低氧化应激水平对大鼠肺气肿发挥治疗作用。
肺气肿;间质干细胞;氧化性应激;间质干细胞移植
慢性阻塞性肺疾病(COPD)是患病率及死亡率均较高的最常见的慢性呼吸系统疾病。COPD的病理改变包括小气道炎症及肺气肿。肺气肿是COPD非常关键的病理改变,以肺泡壁缺失及终末细支气管远端的空腔永久性扩大为特征。肺气肿的形成是一个不可逆的病理过程,目前尚无治愈肺气肿的有效方法。间充质干细胞(MSCs)是未分化的细胞,可从骨髓或其他器官动员到损伤组织,分化成不同的细胞表型,以发挥修复功能,有研究表明MSCs对肺纤维化[1]、肺高压[2]及急性肺损伤[3]有治疗作用。关于MSCs治疗肺气肿的研究很少,本研究通过分析MSCs移植对大鼠肺气肿的治疗效果,从氧化应激方面探讨MSCs治疗肺气肿的可能机制。
1 材料与方法
1.1实验动物及材料SPF级健康雌性SD大鼠26只(昆明医科大学实验动物中心),动物质量合格证号:SCXK(滇)2011-0004,鼠龄6周,体质量(150±10)g;红梅烤烟型香烟(红塔烟草有限责任公司);胎牛血清(Bi以色列);DMEM/ F12,0.25%Trypsin-EDTA(Hyclone);Anti-Rat CD45 FITC、an⁃ti-Rat/mouse CD90-FITC、Anti-Rat CD44H PE及FITC、FE同型对照(eBioscience),anti-mouse CD34 FITC(Santa Cruz);4,6-二乙酰基-2-苯基吲哚(DAPI,北京中杉金桥生物技术有限公司);MDA试剂盒、SOD试剂盒均购自南京建成生物研究所)。
1.2实验动物分组及动物模型的建立将大鼠随机分为3组,对照组(A组)、肺气肿组(B组)每组各8只,肺气肿+ MSCs移植组(C组)10只。参照文献[4]自制大鼠实验性被动吸烟装置,复制肺气肿模型,方法稍有改变。将B组和C组大鼠置于自制的烟雾暴露箱中(熏烟箱体积0.6 m3,可于每侧箱壁钻5个通风孔,每孔1 cm×1 cm,以防止CO中毒),采用红梅烤烟型香烟(焦油量11 mg,烟气烟碱量1.0 mg,烟气CO量:12 mg)放入箱内自然燃烧。点燃时,每次熏烟15支,以5 支-5支-5支方式连续点燃(即5支同时点燃,至香烟燃烧完全、烟雾基本消失,再点燃下5支),共约45 min,此期间,舱内烟雾体积百分比约为15%(V/V)[5]。取出大鼠,清洗烟雾暴露箱。4 h后重复上述烟雾暴露。每天烟雾暴露2次,每周5 d,持续14周。A组大鼠在常氧下饲养14周,除不予烟雾暴露外,其他饲养条件相同。
1.3MSCs的分离、培养将6周鼠龄SD大鼠脱臼处死后,无菌条件下取大鼠股骨,用咬骨钳将股骨两端剪去,PBS反复冲洗骨髓腔获取骨髓细胞悬液,1 000 r/min离心5 min,弃上清,DMEM/F12(10%FBS)重悬细胞后接种于培养瓶,37℃、5%CO2培养箱培养。待细胞生长密度达80%~90%时进行消化,以1∶2比例进行传代扩增培养,通过多次传代对细胞进行纯化,取第3代MSCs进行鉴定、标记和体内干预实验。
1.4MSCs的表型鉴定取第3代细胞经胰酶消化、PBS洗涤l~2遍后,离心收集细胞。取1×106个细胞,加入350 μL流式细胞染色洗涤液,混匀后以50 μL/管加入7个流式管中。分别加入2 μL荧光标记的单抗CD34-FITC、CD45-FITC、CD90-FITC、CD44-PE、同型对照FITC及PE,设1管空白对照,每管加入48 μL PBS,室温避光孵育30 min。然后每管加入400 μL 1%的多聚甲醛。应用流式细胞仪检测细胞表面抗原表达。
1.5MSCs的标记与肺气肿大鼠MSCs移植于移植当天,取第3代大鼠MSCs,加入无菌的DAPI至终浓度为50 g/L。在37℃孵育30 min,标记完成后,0.25%胰酶-0.1%EDTA液常规消化获得细胞悬液。离心后PBS反复洗涤以去除未结合的DAPI,离心收集细胞,稀释至1×107/mL,放于冰浴中。1 h内将细胞通过尾静脉注入C组大鼠体内,细胞数约5× 106/只,每周1次,连续4次。A组及B组注入等体积PBS。
1.6观察MSCs在肺气肿大鼠肺及其他组织的定植情况在完成4次MSCs移植后的2周、4周分别处死C组大鼠各1只,取新鲜组织行冰冻切片,荧光显微镜下观察大鼠肺组织及心、肝、胰、脾、肾中DAPI标记细胞(即MSCs)的定植、分布情况。
1.7血清和肺组织的留取MSCs移植8周后处死剩余所有大鼠。戊巴比妥钠(5 mg/kg)腹腔内注射麻醉大鼠。腹主动脉部穿刺抽血,以促凝采血管采血至约5~7 mL,可放血处死大鼠,将采血管在室温下充分静置后,3 000 r/min离心15 min,用移液管吸取上清,以2 mL EP管分装成两管,标记封口后保存于-70℃冰箱备用。切断肋骨入胸,暴露气管、肺脏和心脏,切断主支气管,用弯钳将其提起,沿背部脊柱前方分离,将心脏和肺脏一起分离下来,剪去心脏。结扎右主支气管,右肺放-70℃冰箱保存备用。再以持续25 cmH2O (1 cmH2O=0.098 kPa)的压力向气管内注入4%多聚甲醛至左肺膨胀,左肺叶浸泡于4%多聚甲醛液中固定2 h,将左肺作常规石蜡包埋、切片。
1.8大鼠肺组织病理切片形态定量分析每只大鼠各取左肺最大横径处肺组织,常规石蜡包埋、切片,行苏木精-伊红(HE)染色作常规病理学检查。每例标本选2张切片,按Robbesom等[6]的方法,在光学显微镜下(×100)观察,每切片取5个视野(避开大血管和支气管),在每个视野正中心划十字交叉线,计算与交叉线相交的肺泡隔数(NS)和每个视野内肺泡数(Na),同时测出十字线总长(L)和每个视野面积(S),按公式平均内衬间隔(MLI)=L/NS,其数值反映肺泡平均直径。按公式平均肺泡数(MAN)=Na/S,计算平均肺泡数,其数值反映肺泡的密度。
1.9测定肺组织匀浆与血清中超氧化物歧化酶(SOD)和丙二醛(MDA)的水平制备肺组织匀浆,按照试剂盒说明书要求操作,用硫代戊巴比妥法测定血清和肺组织匀浆中MDA的水平,用WST-1法测定各组血清和肺组织匀浆中SOD的水平。
1.10统计学方法应用SPSS 17.0软件进行统计学分析。计量资料采用±s表示,多组比较采用方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1MSCs的鉴定第3代MSCs高表达CD44 (97.2%)、CD90(97.7%),而不表达造血细胞标志抗原CD34(0.4%)及CD45(0.5%),证实本实验培养的细胞为MSCs,见图1。

Fig.1 Immunophenotyping of MSCs图1 MSCs细胞表面分子标志鉴定
2.2DAPI标记MSCsDAPI标记30 min后,MSCs细胞核在荧光显微镜下全部标记上并显示蓝色荧光,标记率达100%。
2.3肺及其他组织中MSCs检测DAPI标记后的MSCs可以看见蓝色的细胞核。荧光显微镜下隐约可见肺泡轮廓,MSCs移植后2周、4周,肺组织内均可见到蓝色荧光表达,随着时间的推移,肺内阳性细胞比例逐渐减少。而心、肝、胰、脾、肾等组织均未见到蓝色荧光表达,见图2。
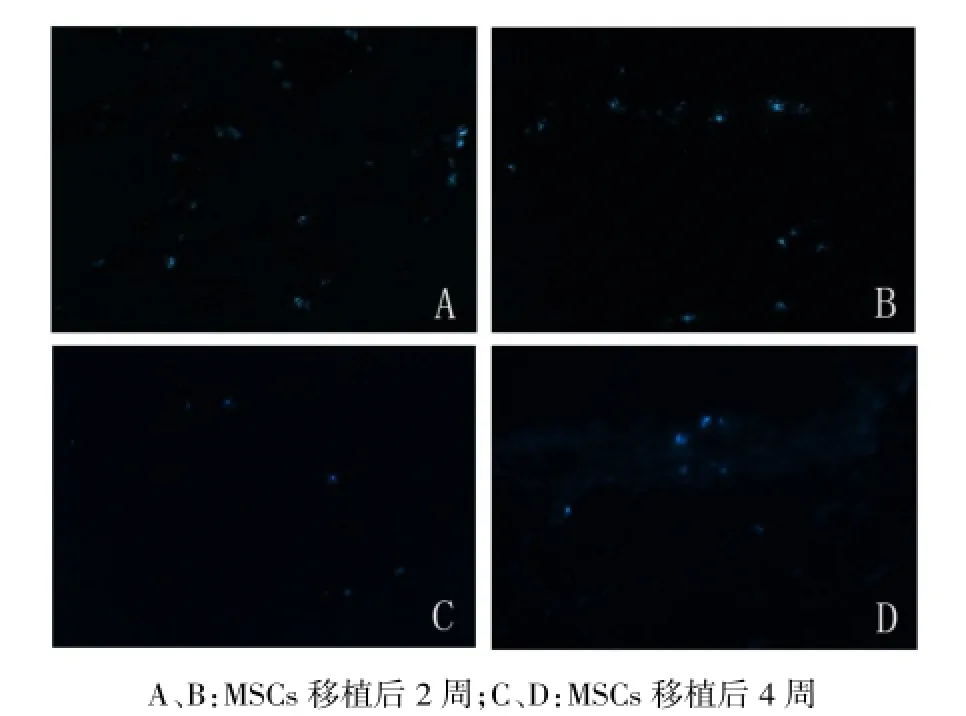
Fig.2 Implantations of MSCs in lungs under a fluorescence microscope(×100)图2 荧光显微镜下肺组织中的MSCs(×100)
2.4肺组织病理学观察A组大鼠肺组织肺泡大小均匀,肺泡数目较多,肺泡间隔较厚。B组和C组大鼠的肺组织呈现肺气肿样改变,肺泡大小不一,肺泡腔扩大,肺泡数目明显减少,肺泡间隔变窄,并有不同程度的断裂。C组肺气肿样改变较B组明显减轻,见图3。B组和C组大鼠肺组织的MLI高于A组,MAN低于A组,B组大鼠肺组织的MLI高于C组,MAN低于C组(P<0.05),见表1。
Tab.1 Comparison of MLI and MAN between three groups表1 各组大鼠平均内衬间隔与平均肺泡数比较 (±s)

Tab.1 Comparison of MLI and MAN between three groups表1 各组大鼠平均内衬间隔与平均肺泡数比较 (±s)
**P<0.01;a与A组比较,b与B组比较,P<0.05
组别A组B组C组F n 80 80 80 MLI(μm)74.48±10.25 111.40±23.01a90.33±14.59ab97.13**MAN(个/mm2)158.64±21.62 93.72±21.88a125.47±15.18ab214.98**
2.5SOD和MDA水平的测定B组和C组大鼠血清及肺组织中MDA高于A组,SOD低于A组,B组血清及肺组织中MDA高于C组,SOD低于C组(P<0.05),见表2。
Tab.2 The levels of MDA and SOD in serum and lungbetween three groups表2 各组血清与肺组织匀浆中MDA及SOD水平比较 (n=8,±s)
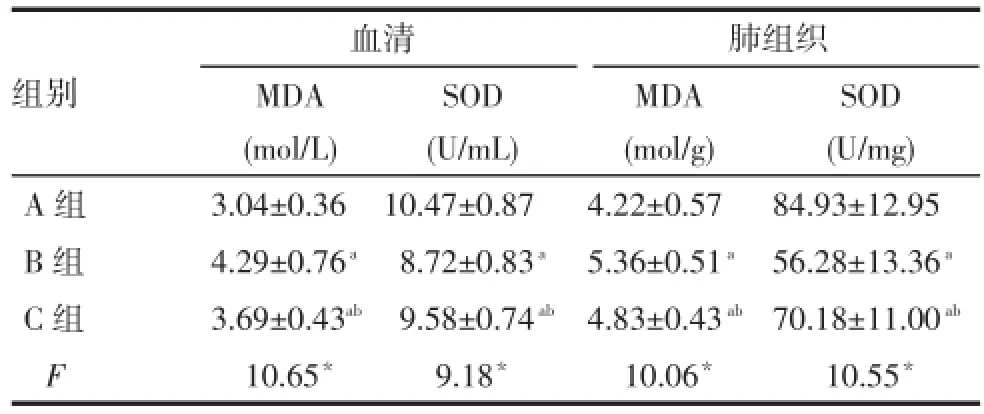
Tab.2 The levels of MDA and SOD in serum and lungbetween three groups表2 各组血清与肺组织匀浆中MDA及SOD水平比较 (n=8,±s)
*P<0.05;a与A组比较,b与B组比较,P<0.05
组别A组B组C组F血清MDA (mol/L)3.04±0.36 4.29±0.76a3.69±0.43ab10.65*SOD (U/mL)10.47±0.87 8.72±0.83a9.58±0.74ab9.18*肺组织MDA (mol/g)4.22±0.57 5.36±0.51a4.83±0.43ab10.06*SOD (U/mg)84.93±12.95 56.28±13.36a70.18±11.00ab10.55*
3 讨论
吸烟是COPD发病最重要的危险因素。本研究使大鼠被动吸烟发生肺气肿,以模拟人类COPD的发病过程。慢性炎症、蛋白酶/抗蛋白酶失衡、细胞凋亡及氧化应激参与吸烟导致COPD的发病过程,氧化应激在其中起枢纽作用。机体可以通过内源性与外源性途径产生氧化剂(如活性氧族),同时肺拥有广大的细胞内外抗氧化防御系统,正常情况下机体氧化剂的损害作用及抗氧化剂的保护作用处于动态平衡状态。吸烟使氧化剂产生过多,使抗氧化剂产生不足或功能受损,从而发生氧化应激。活性氧主要攻击细胞膜多不饱和脂肪酸产生脂质过氧化物(如MDA),与非吸烟健康者相比,COPD患者及吸烟者的痰液、肺组织及血清中MDA水平增加,且与COPD严重程度相关[7-8]。氧化应激可上调氧化还原敏感性转录因子(如核因子-κB)及活化蛋白-1(AP-1),激活其下游信号传导通路,调控多种炎症基因表达,从而放大慢性炎症反应;氧化应激可以促进蛋白酶的产生、激活,导致蛋白酶/抗蛋白酶失衡;氧化应激可以通过抑制血管内皮生长因子(VEGF)、激活核因子-κB及直接损伤DNA等途径诱发肺泡细胞凋亡;从而导致肺泡结构泡坏,肺泡腔扩大,形成肺气肿,促进COPD的进展。故戒烟及抗氧化应激是预防COPD进展最重要、最有效的方法[9]。但有研究报道,在戒烟之后,炎症反应及氧化应激等仍在继续[10-11]。
MSCs移植作为一种生物治疗手段,具有易分离、培养,可大量扩增,具有多分化潜能及具有免疫抑制属性等多种特性,对多种呼吸系统疾病,如肺气肿、急性肺损伤及肺纤维化等具有治疗作用[12]。MSCs在调节氧化还原环境中的作用是目前研究的热点。血红素氧化酶-1(HO-1)具有很强的抗氧化应激及细胞保护作用[13]。在脂多糖诱导的肺损伤模型中,MSCs移植可以明显增加肺组织HO-1的水平而降低过氧化物MDA水平[14]。另一项研究表明,在自发性脑卒中模型中,MSCs移植可以降低脑组织中氧化应激的水平[15]。
本研究结果显示,MSCs移植可以减轻吸烟所致的大鼠肺气肿:肺气肿组和肺气肿+MSCs移植组大鼠的肺组织呈现肺气肿样改变,肺泡大小不一,肺泡腔扩大,肺泡数目明显减少,肺泡间隔变窄,并有不同程度的断裂。肺气肿+MSCs移植组的肺气肿样改变较肺气肿组明显减轻,提示MSCs可以减轻吸烟所致的肺气肿。肺气肿+MSCs移植组与肺气肿组比较,血清及肺组织中MDA的水平下降;而SOD的水平升高。提示MSCs可以降低肺气肿大鼠氧化应激水平。由于氧化应激是肺气肿发病过程的中心环节,故MSCs可能通过降低氧化应激水平对肺气肿发挥治疗作用。MSCs对肺气肿发病过程中氧化应激的影响及其抗氧化应激机制有待于进一步研究。
(图3见插页)
[1]Huang K,Wu XM,Wang XY,et al.The effect of marrow mesenchy⁃mal stem cell transplantation on pulmonary fibrosis in rats[J].Zhong hua Jie He He Hu Xi Za Zhi,2012,35(9):659-664.
[2]Tian HJ,Yang JP,Wang XX.The effect of bone marrow mesenchy⁃mal stem cell transplantation on hypoxic pulmonary hypertension in rats[J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2014,30(3):233-236.
[3]Gupta N,Su X,Popov B,et al.Intrapulmonary delivery of bone mar⁃row-derived mesenchymal stem cells improves survival and attenu⁃ates endotoxin-induced acute lung injury in mice[J].J Immunol,2007,179(3):1855-1863.
[4]Feng J,Chiang AA,Wu Q,et al.Sleep-related hypoxemia aggra⁃vates systematic inflammation in emphysematous rats[J].Chin Med J(Engl),2010,123(17):2392-2399.
[5]Lee JH,Lee DS,Kim EK,et al.Simvastatin inhibits cigarette smok⁃ing-induced emphysema and pulmonary hypertension in rat lungs [J].Am J Respir Crit Care Med,2005,172(8):987-993.
[6]Robbesom AA,Versteeg EM,Veerkamp JH,et al.Morphological quantification of emphysema in small human lung specimens:com⁃parison of methods and relation with clinical data[J].Mod Pathol,2003,16(1):1-7.
[7]Antus B,Harnasi G,Drozdovszky O,et al.Monitoring oxidative stress during chronic obstructive pulmonary disease exacerbations using malondialdehyde[J].Respirology,2014,19(1):74-79.
[8]Cristóvão C,Cristóvão L,Nogueira F,et al.Evaluation of the oxi⁃dant and antioxidant balance in the pathogenesis of chronic obstruc⁃tive pulmonary disease[J].Rev Port Pneumol,2013,19(2):70-75.
[9]Yao H,Rahman I.Current concepts on oxidative/carbonyl stress,in⁃flammation and epigenetics in pathogenesis of chronic obstructive pulmonary disease[J].Toxicol Appl Pharmacol,2011,254(2):72-85.
[10]Gamble E,Grootendorst DC,Hattotuwa K,et al.Airway mucosal in⁃flammation in COPD is similar in smokers and ex-smokers:a pooled analysis[J].Eur Respir J,2007,30(3):467-471.
[11]Louhelainen N,Rytila P,Haahtela T,et al.Persistence of oxidant and protease burden in the airways after smoking cessation[J]. BMC Pulm Med,2009,9:25.
[12]Zhao KY,Wang HS,Hou MX,et al.Therapeutic effect of mesenchy⁃mal stem cells transplantation on pulmonary hypertension model rats [J].Med J Chin PLA,2013,38(10):830-833.[赵科研,王辉山,侯明晓,等.骨髓间充质干细胞移植对肺动脉高压模型大鼠的作用[J].解放军医学杂志,2013,38(10):830-833].
[13]Fredenburgh LE,Perrella MA,Mitsialis SA.The role of heme oxy⁃genase-1 in pulmonary disease[J].Am J Respir Cell Mol Biol,2007,36(2):158-165.
[14]Li J,Li D,Liu X,et al.Human umbilical cord mesenchymal stem cells reduce systemic inflammation and attenuate LPS-induced acute lung injury in rats[J].J Inflamm(Lond),2012,9(1):33.
[15]Calió ML,Marinho DS,Ko GM,et al.Transplantation of bone mar⁃row mesenchymal stem cells decreases oxidative stress,apoptosis,and hippocampal damage in brain of a spontaneous stroke model [J].Free Radic Biol Med,2014,70:141-154.
(2014-09-26收稿2014-11-05修回)
(本文编辑闫娟)
Mesenchymal stem cells transplantation alleviates pulmonary emphysema and oxidative stress in rat
JIN Zhixian1,BI Hong1,ZHOU Kaihua1,DU Junyi1,CHEN Min1,WANG Qing1△,PAN Xinghua2
1 Respiratory Department Two of The First People's Hospital of Kunming,Kunming 650000,China;2 Stem Cell Engineering Laboratory of Yunnan Province,Kunming General Hospital of Chengdu Military Command
△Corresponding AuthorE-mail:wangqing87329@126.com;xinghuapan@aliyun.com
ObjectiveTo test the effect of bone marrow mesenehymal stem cells(MSCs)transplantation on oxidative stress and the development of pulmonary emphysema in rats.MethodsSD rats(n=26)were randomly divided into three groups:normal control group(group A,n=8),emphysema group(group B,n=8)and emphysema+MSCs transplantation group (group C,n=10).Rat models of emphysema was established by exposing rats to cigarette smoking for 14 weeks.Then rats of group C received MSCs transplantation.At the 14thand 28thdays after 4 course of MSCs transplantations,one rat in group C was sacrificed at each time point and their lungs were preserved in frozen sections.Survival of MSCs in the lung tissues were observed by fluorescence microscopy.Eight weeks after transplantations,lung sections were stained by hematoxylin and eo⁃sin(HE)to observe the morphological alterations.Mean linear intercept(MLI)and mean alveolar numbers(MAN)were also measured.Serum and lung malondialdehyde(MDA)levels and superoxide dismutase(SOD)activity were also examined.Re⁃sultsAt the 14thday and 28thday after transplantations of MSCs,MSCs successfully localized to lung and survived in rat models of emphysema.Emphysematous changes of lung tissues were observed in both group B and group C.MLI was higher while MAN was lower in group B and C than those in group A(P<0.05).MLI and MDA levels in serum and lung were high⁃er while MAN level and SOD activity were lower in group B than those in group C(P<0.05).MDA levels in serum and lung was higher while SOD activity was lower in group B and C than those in group A(P<0.05).ConclusionMSCs transplanta⁃tions can effectively alleviates pulmonary emphysema in rat models which might through reducing oxidative stress.
pulmonary emphysema;mesenchymal stem cells;oxidative stress;mesenchymal stem cell transplantation
R563.3
ADOI:10.11958/j.issn.0253-9896.2015.02.003
云南省应用基础研究项目资助(2012FB106)
1昆明市第一人民医院呼吸二科(邮编650011);2云南省干细胞工程实验室,成都军区昆明总医院
金志贤(1970),女,主任医师,学士,主要从事呼吸系统疾病研究
△E-mail:wangqing87329@126.com;xinghuapan@aliyun.com
