盐碱化草坪土壤耐盐解磷真菌的筛选及解磷能力研究
2015-08-20李学平刘萍李甲亮吴海楠
李学平 刘萍 李甲亮 吴海楠

摘要:采集草坪根际盐碱化土壤进行菌种筛选,并研究培养条件对菌株解磷效果的影响。试验结果表明,真菌菌株FL0908发酵液中的有效磷浓度为310.23 mg/L,真菌解磷圈直径与菌落直径比值(D/d)达到1.96。菌株FL0908在所供4种碳源条件下均能生长,不同碳源生长差异显著,最适碳源为葡萄糖,而在乳糖培养基上生长最差;对于所供4种氮源,在酵母浸膏上生长过于迅速,在亚硝酸钠条件下几乎不生长,最适氮源为酵母浸膏,硝酸钾次之;对于所供4种温度,真菌均可生长,最适温度为30 ℃;在所供的4種pH值条件下可正常生长,最适pH值为6。对于试验中发酵液条件的优化组合,最适解磷条件为:温度35 ℃,pH值7,碳氮比35 ∶1,转速130 r/min。
关键词:解磷真菌;生物学特性;盐碱土;根际
中图分类号: S182 文献标志码: A 文章编号:1002-1302(2015)07-0368-03
磷肥作为作物必需的营养物质对农业效益的提高具有重大作用,但是施入土壤后由于土壤的固定作用,大部分磷与土壤中的Ca2+、Fe3+、Al3+结合,形成难溶性磷酸盐[1],大大降低了肥料的有效性。在土壤性质、作物类型、磷肥种类和用量等一系列因素的影响下,每年施入的磷有75%~90%积累在土壤中成为难溶形态的磷[2],当季利用率一般为10%~25%[3];因此,如何提高磷肥利用率一直是研究人员关注的重要问题。解磷微生物是土壤中能将难溶性磷转化为植物能够吸收利用的可溶性磷的一类特殊功能微生物类群[4]。土壤中解磷微生物主要包括细菌、真菌和放线菌。关于解磷细菌的研究较多,也较深入[5-6]。关于解磷真菌方面的研究相对较少,但因为其具有解磷能力强的特点,一直也是研究的热点[7]。对不同种类解磷微生物溶磷效果的研究发现,细菌、酵母、霉菌接种在不同磷源上时,表现出的溶磷能力不同[8-12]。解磷真菌在数量和种类上都少于解磷细菌,但其解磷能力远远高于解磷细菌,而且遗传性状更加稳定[13]。因此,研究解磷真菌的解磷特性以及生物学特性,对促进植物生长发育以及解磷真菌在农学上的应用有重要作用。本试验采集草坪根际土壤,对解磷菌进行筛选并研究培养条件对菌株解磷效果的影响,同时对发酵液条件优化组合进行了研究,探讨解磷真菌的最适生长环境以及解磷的最适合条件。
1 材料与方法
1.1 供试样品
采集内陆盐碱地草坪根际土壤,采用抖土法将收集的土样放入密封袋内立刻带回实验室冷藏,备用。
1.2 培养基配方
1.2.1 基础培养基
菌种初筛用的是有机磷固体培养基和无机磷固体培养基。(1)有机磷固体培养基配方:葡萄糖 10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.003 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.01 g,CaCO3 5 g,卵磷脂 0.2 g,琼脂 15~20 g,蒸馏水 1 000 mL,pH值7.0~7.5。(2)无机磷固体培养基配方:葡萄糖 10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0003 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.01 g,Ca3(PO4)2 5 g,琼脂 15~20 g,蒸馏水 1 000 mL,pH 值7.0~7.5。
1.2.2 保存培养基
菌种保存时用到的培养基为斜面培养基,其配方为:葡萄糖 15 g,NaNO3 1 g,K2HPO4 0.5 g,KCl 025 g,MgSO4·7H2O 0.25 g,FeSO4·7H2O 0.005 g,琼脂 8 g,蒸馏水500 mL,自然pH值。
1.2.3 复筛培养基 菌种复培(纯化)时用的培养基为有机磷液体培养基和无机磷液体培养基。(1)有机磷液体培养基:葡萄糖 10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.003 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 001 g,CaCO3 5 g,卵磷脂 0.2 g,蒸馏水 1 000 mL,pH值 7.0~7.5。(2)无机磷液体培养基:葡萄糖 10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.003 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.01 g,Ca3(PO4)2 5 g,蒸馏水 1 000 mL,pH 值7.0~7.5。
1.2.4 活化培养基
经过观察,获知纯化所得的菌种为真菌,所以活化时用到的培养基为PDA培养基,其配方为:葡萄糖 20 g,马铃薯(去皮)200 g,琼脂15 g,蒸馏水1 000 mL,pH值自然。配制方法是将马铃薯去皮,切成小块,于锅中加水 1 000 mL,煮沸30 min,用双层纱布过滤,取其滤液,之后加入葡萄糖和琼脂,小火加热并用玻璃棒不断搅拌,至琼脂完全溶解,并加水补足1 000 mL。
1.2.5 发酵培养基 发酵条件优化组合采用的培养基为无机培养基和有机培养基。(1)有机培养基配方:葡萄糖 10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.003 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.01 g,CaCO3 5 g,卵磷脂 0.2 g,琼脂 15~20 g,蒸馏水 1 000 mL,pH 值7.0~75。(2)无机培养基配方:葡萄糖 10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.003 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.01 g,Ca(PO4)2 5 g,琼脂 15~20 g,蒸馏水1 000 mL,pH值 7.0~7.5。
以上培养基制作完成之后均在高压灭菌锅中,于 121 ℃、0.103 MPa条件下灭菌20 min。
1.2.6 发酵条件优化组合
本试验中发酵条件优化组合采用的是4因子(温度、pH值、碳氮比、转速)3水平的正交试验(表1),根据试验结果,综合分析确定菌株生长的最适条件。
1.3 菌株筛选
1.3.1 初筛
按照培养基配方与配量分别称取各药品,取少于总量的水于烧杯中,将各培养基成分(琼脂除外)逐一加入水中待溶;将玻璃杯放在石棉网上文火加热,并不断搅拌,使各药品快速溶解,然后补充水分至所需配制培养基的量;用 1 mol/L 的NaOH调节pH值至7.0~7.5;将配制好的培养基分装在锥形瓶内,加上棉塞包装灭菌。高压灭菌后倒平板,次日,将采集的土壤过筛磨细,称取10 g样品,进行梯度稀释至1×10-7、1×10-8、1×10-9,分别滴加菌液于相应编号的平板表面,每个梯度做3个重复,用涂布器涂布均匀,20~30 min后倒置,并放于28 ℃恒温箱中培养。每天观察平板,并记录菌落出现的日期、菌落解磷能力出现日期、菌落直径d、解磷圈出現日期及直径D。培养7 d后,得到解磷能力比较强的菌株进行纯化培养,将纯化培养几代的菌株进行菌种保存。
1.3.2 复筛
采用液体发酵培养法,将解磷微生物培养在难溶性磷液体培养基上,按照配方配制液体培养基进行高压灭菌,在超净工作台上,按照无菌接种法,接种纯化后的解磷真菌于发酵液中,置于摇床中,在30 ℃、120 r/min转速条件下培养7 d,每天观察发酵液的变化,并记录菌丝球的出现日期、菌丝球颜色、目测其大小。发酵结束后,进行发酵液有效磷测定。
1.3.3 生物学测定
本次试验采用察氏培养基进行试验,其配方如下:碳源30 g,NaNO3 2 g,K2HPO4 1 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,琼脂18 g,蒸馏水1 000 mL,自然pH值。
2 结果与分析
2.1 解磷真菌菌株筛选
通过菌种初筛和复筛,得到真菌菌株FL0908发酵液中的有效磷浓度为310.23 mg/L。真菌解磷圈直径与菌落直径比值(D/d)随时间延长而增大,菌株FL0908在4 d增幅最大,在生长到5 d时,解磷圈直径与菌落直径比值(D/d)趋于稳定,菌株FL0908的D/d达到最大值1.96(表2)。
2.2 发酵培养性状
通过观察结果(表3)显示,菌株FL0908的上清液较为透明,粗略判断菌株FL0908的解磷能力较强。
2.3 培养条件对解磷能力的影响
2.3.1 不同碳源对真菌生长的影响 真菌菌株FL0908在供试的4种碳源营养条件下均能生长,生长趋势基本一致,但是对葡萄糖的利用最好,对乳糖的利用最差(图1)。不同碳源不仅对真菌菌株FL0908的菌落直径影响较大,对菌丝体及菌落形态同样产生较为显著的影响。在葡萄糖培养基上,菌丝体较为粗壮,菌落浓密,在培养基背面产生较明显的黑色次生代谢物;在蔗糖和乳糖培养基上生长出的菌丝比较稀疏,颜色亦较浅。
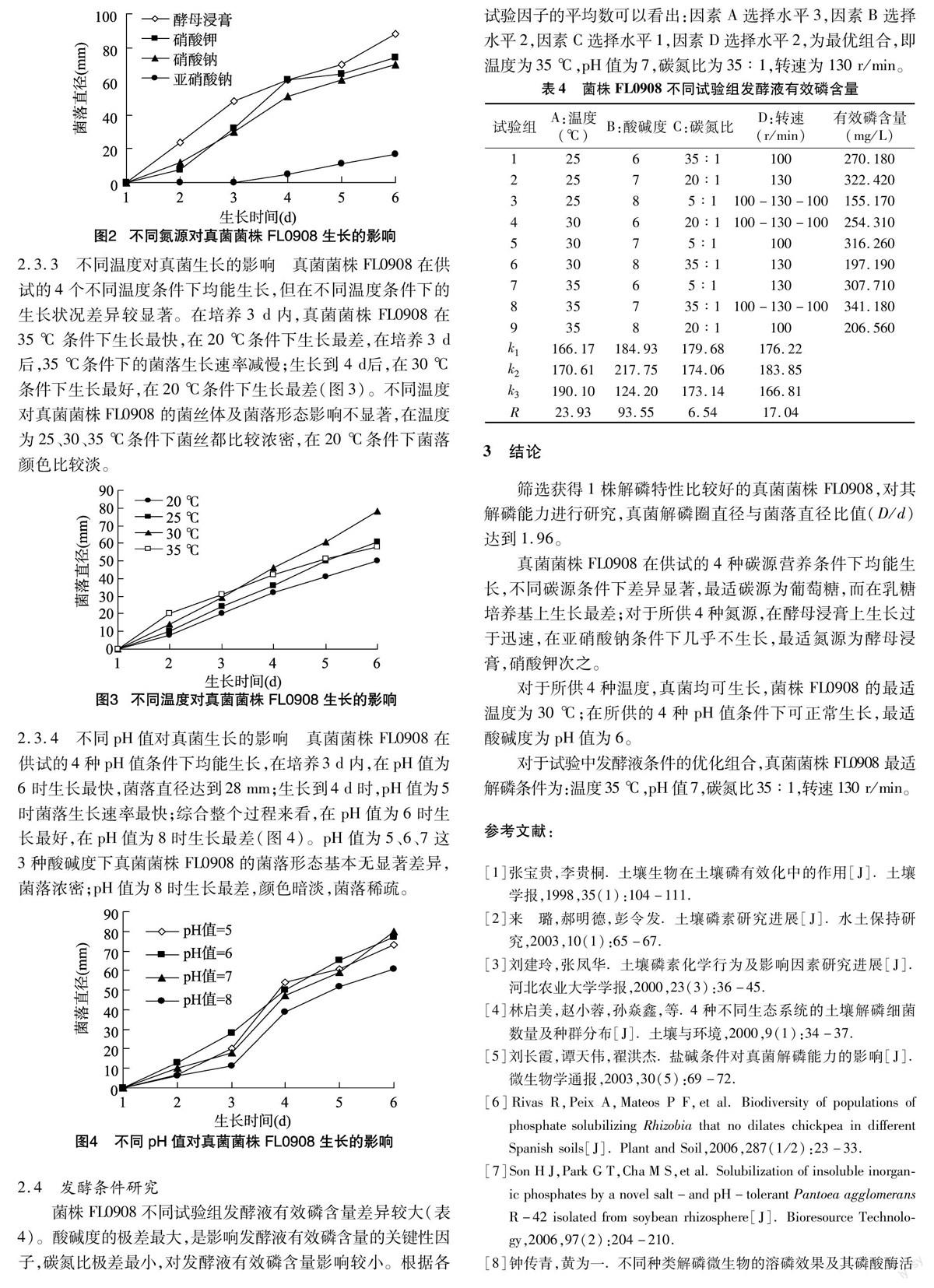
2.3.2 不同氮源对真菌生长的影响
不同氮源对真菌菌株FL0908生长的影响较大(图2)。真菌菌株FL0908在NaNO2上基本不生长,在其他不同氮源培养基上均能生长。其中在酵母浸膏上生长过于迅速,在KNO3和NaNO3上能正常生长。从整个过程来看,真菌菌株FL0908在酵母浸膏培养基上生长最好,在NaNO2培养基上生长最差。不同氮源不仅对真菌菌株FL0908的菌落直径影响较大,对其菌丝体及菌落形态同样产生较为显著的影响。真菌菌株FL0908在酵母浸膏和KNO3培养基上生长出比较浓密的菌丝;在NaNO2培养基上菌落颜色比较淡,菌落外围形成白色的生长圈,而且菌丝变为黑色所需时间更长。
2.3.3 不同温度对真菌生长的影响
真菌菌株FL0908在供试的4个不同温度条件下均能生长,但在不同温度条件下的生长状况差异较显著。在培养3 d内,真菌菌株FL0908在 35 ℃ 条件下生长最快,在20 ℃条件下生长最差,在培养3 d后,35 ℃条件下的菌落生长速率减慢;生长到 4 d后,在30 ℃条件下生长最好,在20 ℃条件下生长最差(图3)。不同温度对真菌菌株FL0908的菌丝体及菌落形态影响不显著,在温度为25、30、35 ℃条件下菌丝都比较浓密,在20 ℃条件下菌落颜色比较淡。
2.3.4 不同pH值对真菌生长的影响
真菌菌株FL0908在供试的4种pH值条件下均能生长,在培养3 d内,在pH值为6时生长最快,菌落直径达到28 mm;生长到4 d时,pH值为5时菌落生长速率最快;综合整个过程来看,在pH值为6时生长最好,在pH值为8时生长最差(图4)。pH值为5、6、7这3种酸碱度下真菌菌株FL0908的菌落形态基本无显著差异,菌落浓密;pH值为8时生长最差,颜色暗淡,菌落稀疏。
2.4 发酵条件研究
菌株FL0908不同试验组发酵液有效磷含量差异较大(表4)。酸碱度的极差最大,是影响发酵液有效磷含量的关键性因子,碳氮比极差最小,对发酵液有效磷含量影响较小。根据各试验因子的平均数可以看出:因素A选择水平3,因素B选择水平2,因素C选择水平1,因素D选择水平2,为最优组合,即温度为35 ℃,pH值为7,碳氮比为35 ∶1,转速为 130 r/min。
3 结论
筛选获得1株解磷特性比较好的真菌菌株FL0908,对其解磷能力进行研究,真菌解磷圈直径与菌落直径比值(D/d)达到1.96。
真菌菌株FL0908在供试的4种碳源营养条件下均能生长,不同碳源条件下差异显著,最适碳源为葡萄糖,而在乳糖培养基上生长最差;对于所供4种氮源,在酵母浸膏上生长过于迅速,在亚硝酸钠条件下几乎不生长,最适氮源为酵母浸膏,硝酸钾次之。
对于所供4种温度,真菌均可生长,菌株FL0908的最适温度为30 ℃;在所供的4种pH值条件下可正常生长,最适酸碱度为pH值为6。
对于试验中发酵液条件的优化组合,真菌菌株FL0908最适解磷条件为:温度35 ℃,pH值7,碳氮比35 ∶1,转速130 r/min。
参考文献:
[1]张宝贵,李贵桐. 土壤生物在土壤磷有效化中的作用[J]. 土壤学报,1998,35(1):104-111.
[2]来 璐,郝明德,彭令发. 土壤磷素研究进展[J]. 水土保持研究,2003,10(1):65-67.
[3]劉建玲,张凤华. 土壤磷素化学行为及影响因素研究进展[J]. 河北农业大学学报,2000,23(3):36-45.
[4]林启美,赵小蓉,孙焱鑫,等. 4种不同生态系统的土壤解磷细菌数量及种群分布[J]. 土壤与环境,2000,9(1):34-37.
[5]刘长霞,谭天伟,翟洪杰. 盐碱条件对真菌解磷能力的影响[J]. 微生物学通报,2003,30(5):69-72.
[6]Rivas R,Peix A,Mateos P F,et al. Biodiversity of populations of phosphate solubilizing Rhizobia that no dilates chickpea in different Spanish soils[J]. Plant and Soil,2006,287(1/2):23-33.
[7]Son H J,Park G T,Cha M S,et al. Solubilization of insoluble inorganic phosphates by a novel salt-and pH-tolerant Pantoea agglomerans R-42 isolated from soybean rhizosphere[J]. Bioresource Technology,2006,97(2):204-210.
[8]钟传青,黄为一. 不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J]. 土壤学报,2005,42(2):286-294.
[9]王莉晶,高晓蓉,吕 军,等. 解磷真菌C2′的分离鉴定及其在土壤中实际解磷效果的研究[J]. 土壤通报,2009,40(4):771-775.
[10]赵小蓉,林启美,李保国. 溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J]. 微生物学报,2002,42(2):236-241.
[11]张 巍,冯玉杰,胡纯国,等. 耐盐碱解磷菌的分离鉴定及解磷能力研究[J]. 土壤通报,2009,40(3):572-575.
[12]韩玉竹,赵建军,曾 兵,等. 根际解磷菌的分离及解磷能力测定[J]. 草地学报,2011,19(5):766-770.
[13]Kucey R N. Phosphate solubilizing bacteria and fungi in various cultivated and virgin Alberta soils,Canadian[J]. Journal of Soil Science,1983,63:671-678.
