60Co—γ射线诱变紫花苜蓿WL525HQ的SSR研究
2015-08-20刘胜洪周玲艳杨妙贤刘文赵钢
刘胜洪 周玲艳 杨妙贤 刘文 赵钢
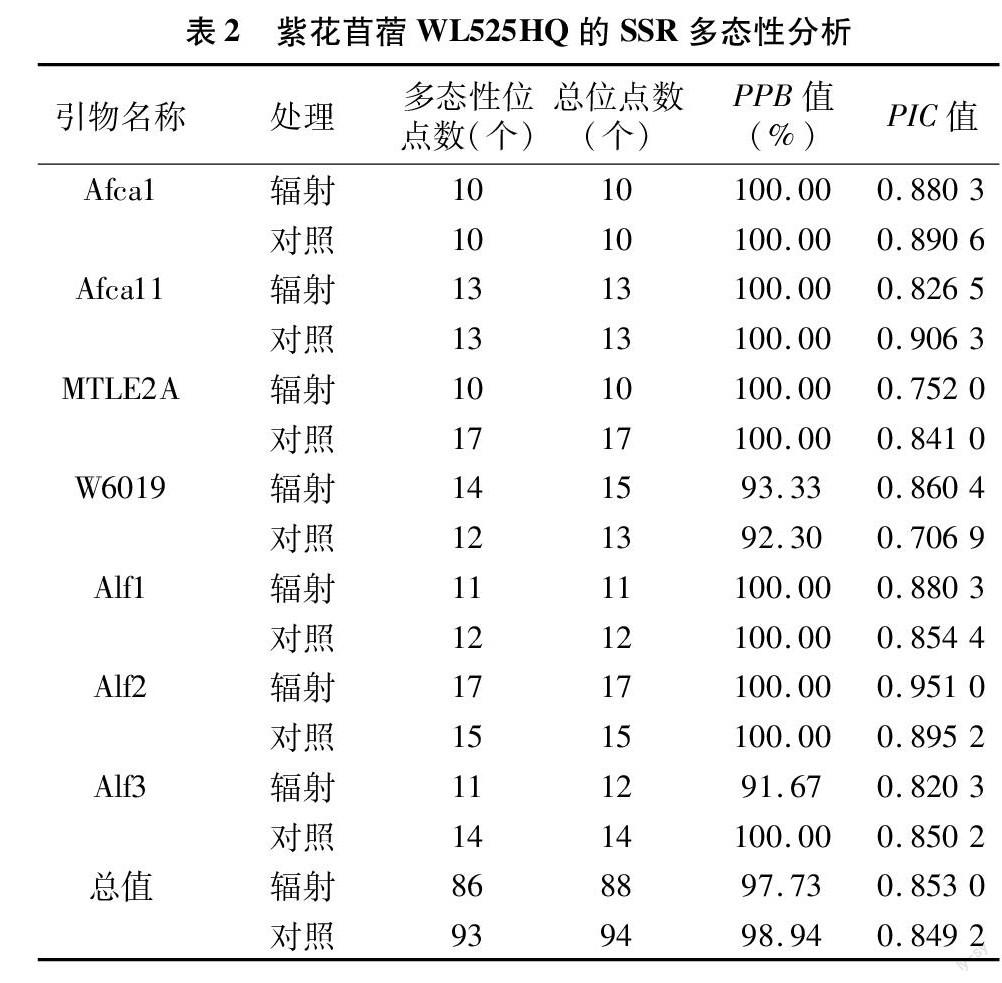

摘要:为了探究60Co-γ射线对紫花苜蓿诱变产生的微卫星变异及其辐射敏感性,用2 000 Gy剂量的 60Co-γ 射线辐射处理紫花苜蓿WL525HQ的种子。紫花苜蓿WL525HQ在人工温室栽培后,比较了辐照组和对照组之间各20个不同单株的简单重复序列(simple sequence repeat,SSR)的多态性变化。结果表明:7对引物均可扩增出紫花苜蓿WL525HQ的多态性位点,其中有5对引物的多态性位点百分比达到100%。经过计算该品种的多态性位点百分率(percentage of polymorphic band,PPB)值和多态性信息量(polymorphism information content,PIC)值发现,辐射组的PPB平均值达97.73%,略低于对照组的98.94%;而辐射组的PIC平均值为0.853 0,略高于对照组的0.849 2。说明 60Co-γ 射线使紫花苜蓿不同单株之间的SSR位点多态性产生了一定程度的变异,但也体现出WL525HQ品种对60Co-γ 射线具有较高的耐受力。
关键词:紫花苜蓿;辐射;SSR;多态性;WL525HQ
中图分类号: S335.2+1 文献标志码: A 文章编号:1002-1302(2015)07-0238-03
紫花苜蓿(Medicago sativa L.)属多年生优良豆科牧草,是世界上种植最多、应用较为广泛、生产潜力大的重要牧草。由于紫花苜蓿具有适应性强、品质好、产量高等优点,素有“牧草之王”的美誉,在现代草业和畜牧业的可持续发展中占有重要地位[1]。
研究表明,通过空间诱变、零磁空间诱变、辐射诱变均可引起苜蓿DNA水平上的变异[2-3],其中,60Co-γ辐射诱变是苜蓿育种的重要手段之一。60Co-γ射线具有能量高、穿透力强的特点,可造成DNA分子碱基变化、脱氧核糖变化、单链断裂、双链断裂以及DNA交联等,致使染色体发生变异,从而对苜蓿的某些性状进行改良[4]。目前,苜蓿的诱变育种工作已经在国内外广泛展开,苜蓿的辐射敏感性、育种的适宜剂量及其辐射诱变规律等工作成为各国学者普遍关注和研究的课题[5]。
与其他DNA分子标记相比,简单重复序列(simple sequence repeat,SSR)标记具有数量丰富、信息含量高、重复性好等特点,并且SSR标记覆盖整个基因组,呈现多基因特点,表现为共显性遗传[6-7]。因此本研究利用SSR分子标记技术可以在基因组范围内较广泛地观察紫花苜蓿的变异情况,对于苜蓿育种研究具有一定的指导意义。
1 材料与方法
1.1 辐照处理与种植
本试验所用的材料为WL525HQ紫花苜蓿,在华大生物科技有限公司辐照中心进行60Co-γ辐射处理,辐射剂量为 2 000 Gy,对照组为未经辐射处理。紫花苜蓿种子用0.1% HgCl2消毒5 min,然后用去离子水冲洗3次后播种于仲恺农业工程学院钟村教学农场大棚内。分别取20张辐照处理组、对照组植株的幼嫩叶片进行后续试验。
1.2 DNA的提取及PCR扩增产物检测
分别取辐照处理组、对照组苜蓿叶片0.1 g,放入研钵,加入约1 g石英砂、1.6 mL提取液[2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、15%聚乙烯吡咯烷酮-40、0.9% NaCl、 6.2% NaAc·3H2O、5% HAc],提取方法采用十二烷基硫酸钠法[8],并通过1.2%的琼脂糖凝胶电泳检测DNA质量。
采用9对稳定性好、多态性高的 SSR 引物[9-11](表1)进行扩增。扩增反应体系为:0.5 μL DNA样品(30 ng),2 μL 10×buffer,1.2 μL MgCl2(25 mmol/L),0.5 μL dNTPs(10 mmol/L),04 μL上游引物(10 μmol/L),0.4 μL下游引物(10 μmol/L),1 μL Taq 酶(0.5 U/μL),15.6 μL双蒸水。扩增程序为:95 ℃预变性 5 min;94 ℃变性 50 s,55~57 ℃退火 45 s,72 ℃延伸 50 s,35个循环;72 ℃延伸 10 min。扩增产物采用含7 mol/L尿素的 6%变性聚丙烯酰胺凝胶电泳分离,银染检测。
1.3 数据分析与统计
根据条带的有无,在Excel表格上构建0,1矩阵图,多态性位点百分率(percentage of polymorphic band,PPB)按照以下公式计算:
多态性百分率=多态性位点数量/总位点数量×100%。
等位位点频率的计算方法参考等位基因的频率计算方法[12]:等位位点频率p=位点数量/总位点数量。计算出等位位点频率后,用Picalc软件计算位点的多态性信息量(polymorphism information content,PIC)。
2 结果与分析
2.1 DNA的提取
本研究采用高盐低pH值的SDS核酸提取法[8]。琼脂糖凝胶电泳结果表明,点样孔清晰无杂质,基因组DNA条带清晰完整(图1)。紫外分光光度结果分析表明,样品D320 nm值接近 0,D260 nm/D280 nm值在 1.85~1.98之间,说明提取的DNA 纯度较高,符合 PCR扩增的要求。
2.2 PCR扩增产物的电泳检测
用7对SSR引物对紫花苜蓿处理组、对照组的DNA进行PCR扩增。结果表明, 7对引物的主要扩增位点位于 100~200 bp之間,处理组和对照间的SSR位点发生了不同程度的变化,仅有少量片段未发生变化,如W6019引物扩增的位点在110 bp 处变化不明显(图2中的D1、D2)。从图2中的A1、A2、B1、B2来看,引物Afca1、Afca11在辐射处理后SSR扩增带数量未发生变化;从图2中的D1、D2、F1、F2看,引物W6019、Alf2在辐射处理后SSR扩增带数量出现增加,条带位置有所改变;其余的3对引物在辐射处理后SSR扩增条带数量均减少(图2中的C1、C2、E1、E2、G1、G2)。
2.3 辐射处理苜蓿的多态性分析
通过PCR扩增结果进一步统计各个SSR位点的多态性,结果如表1所示。可见所使用的7对引物均可扩增出多态性位点,引物Afca1、Afca11在苜蓿辐射处理后的SSR扩增总位点数未发生变化;引物W6019、Alf2在苜蓿辐射处理后SSR扩增总位点数出现增加的现象,条带位置有所改变;其余的3对引物在辐射处理后SSR扩增总位点数均减少。7对引物中有5对引物的多态性位点百分率达到100%。经过计算苜蓿的PPB值、PIC值后发现,对照组的PPB平均值略高于辐射处理组,而对照组的PIC平均值略低于辐射处理组。说明 2 000 Gy 剂量的60Co-γ辐射对紫花苜蓿WL525HQ品种有一定的诱变作用,同时紫花WL525HQ对60Co-γ射线具有较高的耐受力。
3 结论与讨论
紫花苜蓿是多年生豆科植物,其叶、茎均含有较多的蛋白质、酚类、单宁等次生代谢物。因此,在提取苜蓿基因组DNA的时候,应该选取含有次生代谢产物较少的幼嫩叶片,比较有利于DNA的提取。高质量DNA的提取是植物基因组研究的基础[13]。本研究使用的高盐低pH值的核酸提取方法能抑制或避免细胞内各种物质与核酸发生反应,有效去除核蛋白,抑制各种酶活性,适用多种植物中提取DNA和RNA[14]。本研究提取的DNA样品中虽然存在少量RNA,但依然取得了较好的PCR扩增效果。
苜蓿是异花授粉植物,品种内个体间基因型杂合,在种子繁育时通常采用开放式授粉,品种内个体间相互传粉造成个体间基因型不同[9],有学者利用PL34HQ(南澳品系) 品种自交系进行SSR研究,发现苜蓿品种内不同单株间存在多态性差异[15]。另外,各地农业品种主管部门在苜蓿品种的选育过程中亦未将分子标记作为选育依据。因此,本研究对照组的不同单株间存在多态性差异。
目前,植物诱变育种主要利用化学诱变、紫外线诱变、辐射诱变、太空诱变等手段,对植物的种子、枝条、愈伤组织(离体培养)等进行诱变,均已证明可以引起植物微卫星DNA发生变异[16]。利用诱发突变技术能够诱发各种有用的基因突变,产生自然界稀有的或用常规方法较难获得的新类型、新性状、新基因。辐射诱变技术已成为我国科学工作者开创农作物诱变遗传改良的一种有效途径[17]。
但是,不同作物或同种作物不同品种对诱变存在生理或遗传的敏感差异。不同品种的一品红的生理指标因辐射敏感性不同而随辐射呈现完全不同的变化趋势[18];叶开玉等对4个猕猴桃品种辐照后的嫁接成活率、植株生长量的调查发现,随辐射剂量的变化,猕猴桃的嫁接成活率及生长量在品种间差异较大[19];章铁等发现,兰花在辐射后,突变体与对照品种之间有稳定的分子多态性差异[20];在对茄子[21]、甘蓝型油菜[22]、大豆[23]、苜蓿[24]、茶树[25]和芝麻[26]的诱变研究中发现,作物对诱变的敏感性可分为极敏感型、敏感型、中间型、迟钝型4个类型[27]。通过本研究发现,紫花苜蓿WL525HQ品种在60Co-γ射线照射后,其微卫星位点发生了一定程度的变异,但其具有较高的60Co-γ射线耐受力,属辐照迟钝型[24,27]。因此,在实际辐照育种过程中可选择适当的辐照剂量,以提高作物品种的成活率和变异率。
参考文献:
[1]尹 强,武海霞,王志军,等. 环境因子对苜蓿田间自然干燥的影响[J]. 草地学报,2013,21(1):188-195.
[2]杨红善,常根柱,包文生. 紫花苜蓿的航天诱变[J]. 草业科学,2013,30(2):253-258.
[3]刘录祥,郑企成. 空间诱变与作物改良[M]. 北京:原子能出版社,1997.
[4]朱彩霞,古佳玉,邵 群,等. 植物DNA双链断裂损伤修复机制研究进展[J]. 中国农业科技导报,2010,12(5):17-23.
[5]张月学,杨茹冰,徐香玲,等. 60Co-γ射线辐射紫花苜蓿种子的细胞生物学效应研究[J]. 湖南农业大学学报:自然科学版,2007,33(S1):142-146.
[6]刘卫东. SSR标记分离技术的研究概况[J]. 咸宁学院学报,2007,27(6):80-84.
[7]Akkaya M S,Bhagwat A A,Cregan P B. Length polymorphism of simple sequence repeat DNA markers in soybean[J]. Genetics,1992(132):1131-1139.
[8]劉 文,柯辉鹏,梁 红. 动植物总核酸提取试验[J]. 仲恺农业技术学院学报,2008,21(3):17-21.
[9]王小山,陈志宏,韩建国,等. 采用微卫星(SSR)标记研究苜蓿品种鉴定初报[J]. 草地学报,2007,15(4):344-347.
[10]魏臻武,符 昕,耿小丽,等. 苜蓿遗传多样性和亲缘关系的SSR和ISSR分析[J]. 草地学报,2007,15(2):118-123.
[11]魏臻武. 利用SSR、ISSR和RAPD技术构建苜蓿基因组DNA指纹图谱[J]. 草业学报,2004,13(3):62-67.
[12]Frankham R,Ballou J D,Briscoe D A.保育遗传学[M]. 黄宏文,康明,译. 北京:科学出版社,2005:48.
[13]朴政玉,曲柏宏,孙祎龙. 苜蓿基因组总DNA提取及RAPD反应条件优化[J]. 湖北农业科学,2006,45(4):403-405.
[14]刘 文,梁 红,杨碧忍,等. 一种高等植物小片段RNA分子标记方法[J]. 生物多样性,2012,20(1):86-93.
[15]武自念,魏臻武,赵 艳,等. 多叶苜蓿自交一代遗传关系的SSR分析[J]. 中国草地学报,2010,32(6):27-33.
[16]潘伟明,刘 文,杨妙贤,等. 武植3号中华猕猴桃微卫星DNA变异的研究[J]. 湖北农业科学,2010,49(10):2344-2347,2352.
[17]刘录祥,郭会君,赵林姝,等. 我国作物航天育种20年的基本成就与展望[J]. 核农学报,2007,21(6):589-592,601.
[18]李 畅,苏家乐,刘晓青,等. 不同敏感型一品红品种对60Co γ线辐照诱变的生理响应[J]. 扬州大学学报:农业与生命科学版,2010,31(4):95-98.
[19]叶开玉,李洁维,蒋桥生,等. 猕猴桃60Co-γ射线辐射诱变育种适宜剂量的研究[J]. 广西植物,2012,32(5):694-697.
[20]章 铁,刘秀清,孙晓莉,等. 60Co-γ射线辐射诱变蝴蝶兰M1代花型突变体的RAPD分析[J]. 激光生物学报,2011,20(1):27-31.
[21]何娟娟,刘富中,陈钰辉,等. 茄子航天诱变后代变异及其SSR标记多态性研究[J]. 核农学报,2010,24(3):460-465,489.
[22]谢 琳,牛应泽,罗 谊. 航天诱变对甘蓝型油菜根尖的细胞学效应[J]. 核农学报,2008,22(2):179-182.
[23]郑 伟,郭 泰,王志新,等. 航天搭载大豆SP2农艺性状诱变效应初报[J]. 核农学报,2008,22(5):563-565,606.
[24]尚 晨,张月学,李集临,等. γ射线和高能混合粒子场辐照紫花苜蓿品質变异的比较分析[J]. 核农学报,2008,22(2):175-178.
[25]杨跃华 林树祺. 茶树人工诱变技术的研究Ⅲ.不同品种茶树的辐照敏感性[J]. 茶叶科学,1990,10(2):53-58.
[26]张秀荣,李培武,李英德,等. 芝麻不同品种对空间诱变的敏感性及生物效应研究初报[J]. 中国油料作物学报,1998,6(2):26-27.
[27]康玉凡,申庆宏,乔玉梅. 我国苜蓿品种的适宜辐射剂量[J]. 内蒙古农牧学院学报,1998,19(2):71-77.
