茶多酚对猪精液低温保存的影响
2015-08-20彭夏云陆媚许春荣刘德玉李铭胡传活
彭夏云 陆媚 许春荣 刘德玉 李铭 胡传活

摘要:为了寻找一种可较好保护精子的低温保护剂,改善猪精液低温保存方法,通过在改进的猪精液低温稀释液中添加0、0.50、1.00、1.50、2.00 mg/mL茶多酚,对比7 d内4 ℃下低温保存猪精子的活率、活力、畸形率、质膜和顶体完整性等参数,探讨茶多酚在猪精液低温保存中应用的效果。结果表明,在猪精液低温保存后7 d,仅0.50、1.00 mg/mL 组5个质量指标均显著好于对照组(P<0.05),其中1.00 mg/mL组效果最好。总之,在本试验条件下,适宜浓度的茶多酚可以明显改善4 ℃低温条件下猪精液的保存效果,其中最佳添加浓度是1.00 mg/mL。
关键词:猪;精液;低温保存;茶多酚;活力;畸形率;顶体完整性
中图分类号:S828.3+4 文献标志码: A 文章编号:1002-1302(2015)07-0210-03
随着我国养猪业的不断发展和种猪联合育种工作的需要,猪的人工授精迅速普及,猪精液品质的控制以及精液保存稀释剂日趋成为猪人工授精技术的核心。然而,输精后(尤其是用低温冷冻后的精液)的受胎率却很低,这与精子的受精能力有着重要的关联[1]。精子作为一种复杂的终端细胞,必须具备一定条件才可以完成受精。从理论上说,当精液温度下降到4 ℃或更低时,精子代谢活动水平降低,营养物质消耗减少,有利于延长精子的生命周期,达到长期保存的效果[2];但是,在精液低温保存过程中,由于精子质膜组成的不同,猪精子对温度的改变非常敏感,对低温的耐受能力比其他家畜差,易发生冷休克,使得精子处于氧化应激状态,产生大量的活性氧,氧化精子质膜的不饱和脂肪酸导致膜脂流动性降低,最终导致精子细胞膜功能异常[3]、干扰精子代谢、损伤精子DNA[4]等,甚至诱发其凋亡[5],这些局限在一定程度上限制了猪精液低温保存技术的研究与应用。茶多酚是一类存在于茶树中的多羟基酚类化合物的总称[6],近年来,了解到茶多酚的抗氧化作用不仅对体外的油脂而且对体内脂质体、蛋白质、DNA 等具有比其他天然抗氧化剂如维生素C、维生素E和化学合成抗氧化剂更强的保护作用[7],但是目前未见其活性成分在猪精液保存方面应用的报道。本试验将不同浓度茶多酚添加到稀释液中,研究其对猪精液低温保存的影响,以期为猪精液低温保存稀释液配方的改良提供参考。
1 材料与方法
1.1 材料
1.1.1 试剂及仪器 主要试剂:茶多酚(由上海源叶生物科技有限公司生产),考马斯亮蓝(由国药集团化学试剂有限公司生产),葡萄糖、蔗糖(由国药集团制药总厂生产),青霉素、庆大霉素、碘化丙啶(Sigma中国有限公司),Diff-Quik染液(由南京建成生物工程研究所生产),卵黄(取自广西南宁市富凤农牧有限公司生产的初产鸡蛋),新鲜猪精液(由广西科达畜禽改良有限公司提供)。
主要仪器设备:迈郎精子全自动分析系统、相差显微镜(由南宁松景天伦生物科技有限公司生产),电子冷暖箱(由北京福意联电器有限公司生产),冰箱(由河南新飞电器有限公司生产),电热恒温水槽(由上海精宏实验设备有限公司生产),电子天平(由上海菁海仪器有限公司生产),恒温载物台(由江苏省金坛市杰瑞尔电器有限公司生产)。
1.1.2 低温稀释液的配制 在徐振军等报道的配方[8]基础上稍作改进:蔗糖 4 g、葡萄糖 3 g、庆大霉素0.048 g、青霉素0.06 g、卵黄(7 000 g、15 ℃离心25 min,取上清液)20 mL,溶于80 mL双蒸水中。
1.2 精液处理方法
1.2.1 精液采集 采用手握法采集精液,将预热好的集精杯(35~37 ℃)用灭菌滤纸盖好,收集中间段精液,边采集边过滤去除胶状物。在37 ℃下用显微镜检查常规品质,精子活力在0.7以上、无异味、色泽为乳白色的精液,放入保温瓶中于1 h内运回实验室备用。
1.2.2 精液稀释与平衡 精液带回实验室后(室温25 ℃左右),暗处静置20 min,测量精液和稀释液的温度,确保二者的温差为0.1~0.3 ℃。将含有各浓度茶多酚的低温稀释液(提前12 h配制好)按1 ∶1的比例缓慢加入到猪精液中,轻轻上下摇晃,使精液与稀释液充分接触,室温23~25 ℃下暗处静置平衡0.5 h;然后将低温稀释液(温度保持25 ℃左右)按1 ∶1的比例再次加入上述已混匀的液体中,使得猪精液与稀释液的最终稀释比为1 ∶3;用数层纱布包裹后放入电子冷暖箱中17 ℃下平衡3 h,再次包裹数层纱布放入冰箱中4 ℃下保存,每6 h轻轻摇动1次,防止精子沉淀死亡。
1.3 精子质量评价
采用PI荧光染色法[9]检测精子活率,计算机辅助精液分析仪(CASA)[9]检测精子活力,Diff-Quik染色[10]检测精子畸形率,考马斯亮蓝染色法[11]检测精子顶体完整率,低渗肿胀法(HOST)[12]检测质膜完整率。
1.4 试验设计
试验按茶多酚在低温稀释液的浓度(0、0.50、1.00、1.50、2.00 mg/mL)分为5组,7 d内对精子的活率、活力、畸形率、弯尾率和顶体完整率进行测定,试验重复5次。
1.5 数据处理
试验数据先用Excel进行前期处理,然后用SPSS 17.0进行方差分析和多重比较,数据以“平均值±标准差”表示。
2 结果与分析
2.1 茶多酚对低温保存猪精子活率的影响
由表1可知,在4 ℃低溫条件下,0.50、1.00 mg/mL添加组7 d内均可以提高猪精子活率,其中1.00 mg/mL添加组效果更好,与对照组相比差异显著(P<0.05);1.50 mg/mL添加组从第3天开始对精子活率有显著提高的作用;高浓度组(2.00 mg/mL)仅在第3、第4天可以显著提高精子活率,其余时间与对照组差异不显著(P>0.05)。
2.2 茶多酚對低温保存猪精子活力的影响
由表2可知,在4 ℃低温条件下,添加茶多酚各试验组精子活力均高于对照组,但2.00 mg/mL添加组的活力在前4 d显著高于对照组(P<0.05),第5天开始与对照组差异不显著(P>0.05);另外3组(0.50、1.00、1.50 mg/mL)7 d内的活力与对照组相比差异均显著(P<0.05)。其中,1.00 mg/mL 添加组效果最佳,在第3天和第5天至第7天显著优于对照组及各添加组(P<0.05)。
2.3 茶多酚对低温保存猪精子畸形率的影响
由表3可知,在4 ℃低温保存条件下,0.50、1.00 mg/mL添加组可显著降低精子的畸形率(P<0.05);1.50 mg/mL添加组的畸形率在保存的第3天至第5天显著低于对照组(P<005);高浓度添加组(2.00 mg/mL)的畸形率在7 d内与对照组相比差异不显著(P>0.05)。
2.4 茶多酚对低温保存猪精子顶体完整性的影响
由表4可知,高浓度组(2.00 mg/mL)的精子顶体完整从第2天开始显著高于对照组(P<0.05);其余3组的顶体完整率在7 d内均显著高于对照组(P<0.05),其中0.50、1.00 mg/mL 浓度组效果较好,第6天时仍达50%以上。
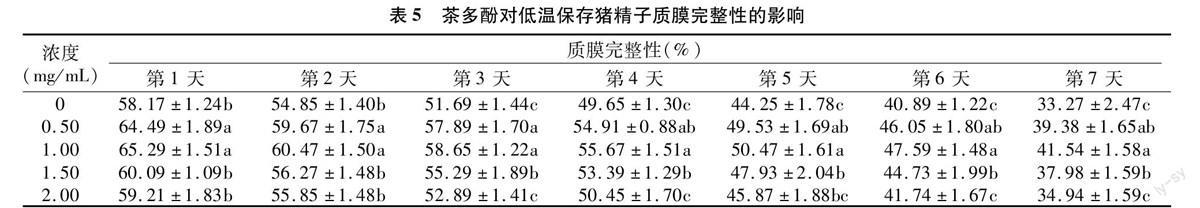
2.5 茶多酚对低温保存猪精子质膜完整性的影响
由表5可知,添加茶多酚各试验组精子质膜完整率均高于对照组,但2.00 mg/mL浓度组与对照组相比差异不显著(P>0.05);1.50 mg/mL浓度组从第3天开始显著高于对照组(P<0.05);0.50、1.00 mg/mL浓度组能显著提高精子质膜完整率(P<0.05),但这2组差异不显著(P>0.05)。
3 结论与讨论
精液在稀释过程中暴露于空气中,使得其氧气浓度高于在生殖道内的氧气浓度,体外操作时光线和温度会发生变化,低温保存过程中会发生低温打击,这些外界因素都会使猪精子细胞内活性氧水平增加,从而引起氧化应激损伤和脂质过氧化,导致精子结构和功能的损伤。本试验结果表明,向猪精液稀释液中添加茶多酚,对猪精子4 ℃低温保存起较好的保护作用,可明显提高低温保存下猪精子的运动参数、顶体完整率以及质膜完整率效果最好的为1.00 mg/mL浓度组。茶多酚对猪精子低温保存有这样的保护作用,其原因可能与它的抗氧化机制有关。茶多酚作为优良的氢供体,向活泼自由基提供氢离子后形成的自由基通过共振杂化成稳定的自由基;而提供的氢离子与活泼自由基结合后,使得活泼自由基失活,切断其链式反应,从而延缓油脂中不饱和脂肪酸自动氧化成过氧化物的连锁反应,起到抗氧化作用。茶多酚的显著抗氧化性在于还可以降低脂质过氧化物和丙二醛的含量,从而降低氧自由基对精子细胞的损伤[13]。另外,茶多酚最主要的活性成分为儿茶素类,其中没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)活性最强,同时具有抗氧化和抗凋亡作用。有研究表明,EGCG具有对抗β-淀粉样蛋白诱致海马神经细胞的凋亡作用[14],并对过氧化氢、一氧化氮和1-甲基-4-苯基-1,2,3,6-四氢吡啶等氧化应激因素诱导的PC12 细胞和SH-SY5Y 细胞凋亡模型具有抗凋亡作用[15-16]。EGCG抗细胞凋亡作用取决于其结构中含有2个三酚基团,该基团是其抗氧化作用的主要活性部位,通过增强抗氧化酶的活性加速氧化产物的转化,同时阻止细胞氧化产物的大量生成,尤其是ROS的生成,减少对线粒体的氧化性损伤,而精子尾部节律性运动的能量主要来自线粒体呼吸代谢产生的ATP,这可能是其抗细胞凋亡的主要作用机制[15-16]。茶多酚的强抗氧化性和抗凋亡作用不容小觑,虽然本试验结果也证明了它在猪精液低温保存中的保护作用,但具体的更有说服力的机理和原因还有待于进一步探索。
适宜浓度的茶多酚均可以明显改善4 ℃低温条件下猪精液的保存效果,其中1.0 mg/mL浓度组对精子在7 d内的保存质量均起到提高作用,效果较好。
参考文献:
[1]Johnson L A,Weitze K F,Fiser P,et al. Storage of boar semen[J]. Animal Reproduction Science,2000,62(1/2/3):143-172.
[2]Bailey J L,Bilodeau J F,Cormier N. Semen cryopreservation in domestic animals:a damaging and capacitating phenomenon[J]. Journal of Andrology,2000,21(1):1-7.
[3]Curry M R,Kleinhans F W,Watson P F. Measurement of the water permeability of the membranes of boar,ram,and rabbit spermatozoa using concentration-dependent self-quenching of an entrapped fluorophore[J]. Cryobiology,2000,41(2):167-173.
[4]Harrison R A P,Ashworin P J C,Miller N G A.Bicarbonate/CO2,an effector of capacitation,induces a rapid and revensible change in the lipid architecture of boar sperm plasma membranes[J]. Molecular Reproduction and Development,1996,45:378-391.
[5]Henkel R,Kierspel E,Stalf T,et al. Effect of reactive oxygen species produced by spermatozoa and leukocytes on sperm functions in non-leukocytospermic patients[J]. Fertility and Sterility,2005,83(3):635-642.
[6]趙爱云. 新型天然抗氧化剂茶多酚的研究进展[J]. 中国食品添加剂,2005(5):78-80,86.
[7]王彩华. 茶色素治疗高血压病高粘血症的临床观察[J]. 实用中医药杂志,1998,14(1):44-45.
[8]徐振军,任 康,白桂芬,等. 带精浆直接稀释法探讨猪精液低温(4 ℃)保存的可行性[J]. 广西农业生物科学,2006,25(增刊1):23-30.
[9]张 婷. 四种糖类对猪精液冷冻保存效果的研究[D]. 杨凌:西北农林科技大学,2008:18-20.
[10]王彦芳,张 洲,寇 卉. Diff-Quik与改良巴氏染色法对精子形态染色效果比较[J]. 吉林医学,2012,33(24):5155-5156.
[11]陆海一,陆金春,胡毓安,等. 考马斯亮蓝染色法检测人精子形态和顶体反应[J]. 中华男科学,2002,8(3):204-206.
[12]朱 跃,朱 杰. 低渗肿胀精子类型对精子活动率及男性生育能力的影响[J]. 安徽医学,2011,32(10):1695-1697.
[13]李 军,林丽文,辛 勤,等. 绿茶多酚抗衰老作用研究[J]. 食品与药品,2013(2):106-109.
[14]Choi Y T,Jung C H,Lee S R,et al. The green tea polyphenol(—)-epigallocatechin gallate attenuates β-amyloid-induced neurotoxicity in cultured hippocampal neurons[J]. Life Sciences,2001,70(5):603-614.
[15]Koh S H,Kim S H,Kwon H,et al. Epigallocatechin gallate protects nerve growth factor differentiated PC12 cells from oxidative-radical-stress-induced apoptosis through its effect on phosphoinositide 3-kinase/Akt and glycogen synthase kinase-3[J]. Brain Research: Molecular Brain Research,2003,118(1/2):72-81.
[16]Guo S H,Bezard E,Zhao B L. Protective effect of green tea polyphenols on the SH-SY5Y cells against 6-OHDA induced apoptosis through ROS-NO pathway[J]. Free Radical Biology & Medicine,2005,39(5):682-695.
