pH值响应聚乙二醇化壳聚糖基隐形纳米胶束的制备 及其载药性能
2015-08-19姚文杰辛梅华李明春方江海
姚文杰,辛梅华,李明春,方江海
(华侨大学材料科学与工程学院,环境友好功能材料教育部工程研究中心,福建 厦门 361021)
近年来,可明显提高药物体内半衰期,增强药物靶向性及疗效的聚乙二醇(PEG)化隐形纳米胶束逐渐受到人们的重视[1]。PEG化隐形纳米胶束是在PEG化的基础上降低胶束粒径至100nm左右,从而进一步降低网状内皮系统对其识别和摄取能力,延长在血液循环滞留时间[2-3]。 Praneet等[4]制备了N-邻苯二甲酰基-3-mPEG-壳聚糖自组装纳米胶束,并以喜树碱为模型药物研究了药物包埋和释放行为。结果表明,在pH值为7.4的PBS模拟液中该聚合物具有较高稳定性和药物缓释性能,胶束平均粒径为200~267nm。Wang等[5]利用十八烷基季胺化赖氨酸对壳聚糖改性后(OQLS),分别接枝mPEG和FA(叶酸),制得mPEG-OQLS和FA-OQLS。将两者混合形成了具有主动靶向的隐形纳米微囊,其平均粒径达160nm,但产物仅溶于氯仿不溶于水,无法应用于疏水药物的包载。因此制备能水溶的PEG化双亲性聚合物胶束成为当前研究的热点。
李昆等[6]制备了水溶双亲性N-辛基化-N-mPEG化壳聚糖,并对产物包覆量子点进行研究,发现聚合物纳米粒子为球形,且分布较为均一,粒径为200nm左右。Jong等[7]制备了PEG化聚天冬酰胺衍生物,在PBS模拟液中pH值为7.4时,胶束稳定性高且具有缓释性能,在pH值为6.5时,出现突释现象,该研究为实现药物在人体的主动靶向释放提供了可能性。作者课题组[8]曾制备高取代度的N,N-双十二烷基壳聚糖,能溶于氯仿和四氢呋喃。烷基链取代度增加,载药量增加,临界胶束浓度和胶束粒径减小[9-10]。但高取代N,N-双烷基壳聚糖的疏水性强,而mPEG羧基化和卤化改性在壳聚糖的羟基上接枝率低[6,11],不易形成水溶性双亲性衍生物。为此,本文提出一种新的方法,将mPEG经氯乙酸羧化改性后,通过酰化反应接枝到双烷基壳聚糖的羟基上,制备出高接枝度N,N-双烷基-3,6-O-mPEG-壳聚糖(PEDLCS)水溶性衍生物,合成路线见图1,并以酮洛芬为疏水模型药物,对产物在水中的自组装行为进行研究,为其在疏水药物增溶中的应用提供依据。
1 实验部分
1.1 主要仪器与试剂
FD-1B-50型冷冻干燥机(博医康实验仪器公司);FLS920型全功能稳态/瞬态荧光光谱仪(Edinburgh Instruments);Nexusu 470 型傅里叶变换红外光谱仪(Nicolet);Bruker Avance III 型(500 MHz)核磁共振波谱仪(Bruker);Vario MICRO元素分析仪(Elementar);ZEN3600纳米激光粒度及zeta电位分析仪(malvern)。
壳聚糖(CS,Mw=50kDa,DD=90.95%),浙江澳兴生物科技有限公司;月桂醛(95%),二氯亚砜(99%),聚乙二醇单甲醚(mPEG,Mn= 1000Da),阿拉丁试剂;十二烷基磺酸钠(SDS),NaBH4(99%),上海国药集团;氯乙酸(99%),天津市光复精细化工研究所;酮洛芬(KP),武穴市迅达药业;其他试剂均为市售分析纯。
1.2 mPEG-COOH的合成
[12]方法,将10.0g mPEG溶于40mL 20% NaOH溶液中,搅拌1h,缓慢滴加氯乙酸水溶液(4.7g氯乙酸溶于5mL水中),60℃反应6h。用稀盐酸调节pH值至中性,旋蒸除水,得白色固体。干燥,乙醚洗涤,再将产物溶于少量氯仿中,冰乙醚沉析,抽滤得目标产物mPEG-COOH。
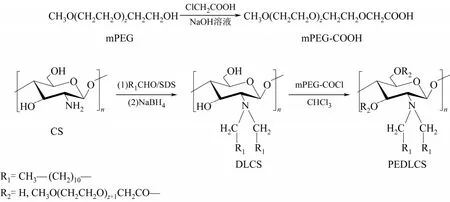
图1 PEDLCS的合成路线
1.3 N,N-双十二烷基-3,6-O-mPEG-壳聚糖的合成
首先采用作者课题组方法[8]合成油溶性的N,N-双十二烷基壳聚糖(DLCS)。再参考文献[13]方法,将7g mPEG-COOH溶于20mL氯仿中,冰浴下搅拌0.5h,回流管上接干燥管,缓慢滴加2mL二氯亚砜1h。再滴加DLCS的氯仿溶液(0.5g DLCS溶于20mL氯仿中),室温反应1h后60℃反应7h。旋蒸除氯仿后溶于丙酮,过滤,滤液浓缩后的产物溶于水,用透析袋在蒸馏水中充分透析,冷冻干燥得产物N,N-双十二烷基-3,6-O-mPEG-壳聚糖(PEDLCS)。
1.4 PEDLCS载酮洛芬胶束的制备
参考文献[10]的方法,准确称取0.1gN,N-双十二烷基-3,6-O-mPEG-壳聚糖溶解于50mL pH值为7.4的PBS缓冲溶液中,平均分成5份。100mg酮洛芬溶于3mL乙醇中,按一定比例量取酮洛芬(KP)溶液分别加入上述PEDLCS水溶液中,室温超声30min,蒸馏水透析12h。12000r/min离心10min,0.45μm滤膜过滤,滤液冻干至恒重得载药胶束粉末,4℃保存备用。
1.5 载药量和包封率测定
取1.4节制备的载酮洛芬胶束溶于1mL的PBS缓冲溶液中。移取0.2mL胶束溶液于10mL容量瓶中,乙醇定容,12000r/min离心10min,取上清液在260nm测定吸光值A,根据酮洛芬乙醇溶液的线性方程A=72.902C+0.0205(R2=0.9994),C为酮洛芬胶束浓度,单位mg/mL,线性范围0~0.025 mg/mL,求得胶束内酮洛芬的质量。计算包封率和载药量。
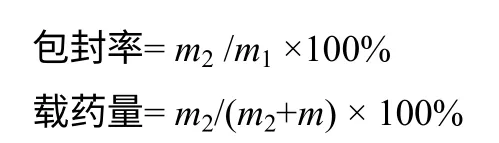
式中,m1为加入的KP总质量;m2为胶束内KP的质量;m为载体的质量。
2 结果与讨论
2.1 产物的表征
2.1.1 产物的FTIR分析

图2 合成产物的FTIR图
采用KBr压片法,测得N,N-双十二烷基壳聚糖(DLCS)、聚乙二醇单甲醚(mPEG)、羧化改性聚乙二醇单甲醚(mPEG-COOH)、N,N-双十二烷基-3,6-O-mPEG-壳聚糖(PEDLCS)的红外光谱如图2所示。图中b、c分别为mPEG和mPEG- COOH的FTIR谱图,2870cm-1附近的吸收峰为聚 乙二醇重复单元(—CH2—CH2—O—)中C—H的伸缩振动峰,1100cm-1附近为mPEG中醚键C—O—C的伸缩振动峰;c与b相比,1723cm-1附近出现了羧基中的C=O伸缩振动峰[15],说明mPEG已羧化改性。 a、d分别为DLCS和PEDLCS的FTIR谱图,d与a相比,d在2928cm-1、2860cm-1和721cm-1处出现同样的特征吸收峰,2928和2860cm-1处为甲基和亚甲基的C—H伸缩振动峰,721cm-1为n≥4的(CH4)n基团的骨架振动峰,说明长链烷基已接到壳聚糖上[8]。且b与d相比,d在1636cm-1、1458cm-1、1350cm-1和1100cm-1处出现了mPEG骨架的特征峰[11],说明mPEG已接枝到DLCS上得到目标产物。
2.1.2 产物的1H NMR分析
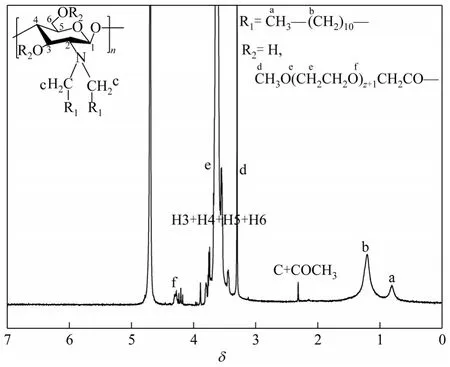
图3 PEDLCS的1H NMR图
以D2O为溶剂测得PEDLCS的1H NMR图如图3,其中δ3.44~3.89为壳聚糖骨架上H3、H4、 H5、H6的质子峰。δ2.32为十二烷基与氨基相连的亚甲基的质子峰,δ1.2附近为十二烷基上亚甲基的质子峰,δ0.81为十二烷基的甲基质子峰,说明长链烷基已经接到壳聚糖的氨基上[5]。δ3.29为—O—CH3(d)中H(d)的质子峰,δ3.62为—CH2—CH2(e)—O—CH2—中H(e)的 质 子 峰,δ4.28为CH3O(CH2CH2O)z+1CH2(f)CO—中H(f)的质子峰,说明mPEG已经接枝到双烷基壳聚糖上[15]。由1H NMR谱图进一步说明已合成了目标产物PEDLCS。
2.1.3 产物的取代度测定
产物的元素分析及由C/N 摩尔比计算取代度[9]结果见表1。壳聚糖的脱乙酰度为90.95%,十二烷基取代度为1.89,烷基链取代度是已报道[9-10]的两亲性烷基壳聚糖衍生物的近2倍 ,疏水链取代度高有利于形成粒径较小的聚合物胶束[10]。mPEG接枝率为1.63,与文献报道的16.5%[4]和29%[11]mPEG相比,接枝度有较大的提高,mPEG的接枝率高可以增加产物的亲水能力使产物溶于水,并且大量mPEG的存在保障了所形成载药胶束的长循环功 能[1]。
2.1.4 产物的溶解性试验
称取0.1g产物于100mL溶剂中,观察溶解情况,结果见表2。壳聚糖(CS)只有在弱酸性条件下可以溶解,这是由于壳聚糖分子内和分子间的氢键作用。N,N-双十二烷基壳聚糖(DLCS) 只溶于四氢呋喃和氯仿而不溶于水,N,N-双十二烷 基-3,6-O-mPEG-壳聚糖(PEDLCS)不仅能溶于酸性、中性和碱性水溶液中,而且能溶于除乙醚之外 的大部分有机溶剂,可见mPEG链的高接枝率拓宽了目标产物PEDLCS的溶解性能,是一种少有的两亲性聚合物。

表1 产物的元素分析结果及取代度
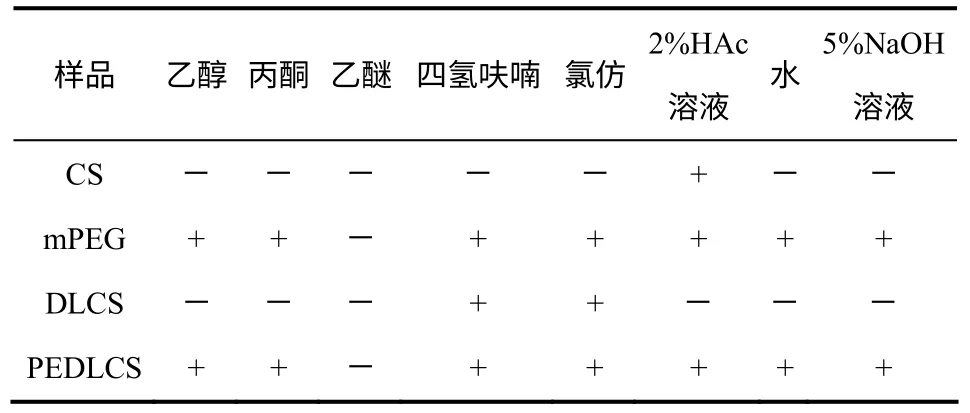
表2 原料及产物的溶解性
2.2 产物的载药性能以及载药胶束的pH值响应性
2.2.1 临界胶束浓度
以芘为荧光探针,采用稳态荧光法测定N,N-双十二烷基-3,6-O-mPEG-壳聚糖(PEDLCS)的临界胶束浓度(CMC)[14]。配制一系列含不同浓度芘的PEDLCS水溶液,选择激发波长335nm,扫描范围350~450nm,狭缝宽度0.6nm测其稳态荧光光谱,进一步计算并绘制lgC~I372/I383关系曲线如图4所示。分段做曲线的切线,切线的交点对应的浓度即为PEDLCS的CMC值0.1170 mg/mL,比文献[4]报道的mPEG化壳聚糖基药物载体材料的CMC值28μg/L小,CMC值小有利于在体内循环被稀释时胶束的稳定存在。
2.2.2 载药胶束粒径、Zeta电位及包封率和载药量的测定
按照实验部分1.4节操作,制备N,N-双十二烷基-3,6-O-mPEG-壳聚糖自组装载酮洛芬胶束。测得不同KP/PEDLCS投料比的PEDLCS载药胶束的载药量、包封率、粒径和Zeta电位见表3,可见随着KP/PEDLCS投料比从0.6∶1增大到1.4∶1,包封率从79.85%下降到45.88%,载药量从32.39%增大到39.11%。载药胶束的粒径随着载药量增大呈现先减小再增大的趋势,Zeta电位的绝对值都在30 mV左右,说明载药胶束都具有良好的稳定性。粒径较小有利于实现胶束在体内的隐形性,达到长循环,因此选择最佳KP/PEDLCS投料比0.8∶1制备载药胶束,平均粒径为155.1nm,此时包封率为65.78%,载药量为34.48%;与文献报道的200~267nm[4]、220.2nm[15]和167.5nm[5]相比具有较小的 粒径。可见,引入mPEG亲水基团不仅使产物可以形成稳定胶束,对KP有较高的包封率和载药量,而且形成的聚合物胶束粒径较小,有望成为壳聚糖基隐形纳米胶束。

图4 芘的荧光发射强度比(I372/I383)与 PEDLCS浓度关系曲线
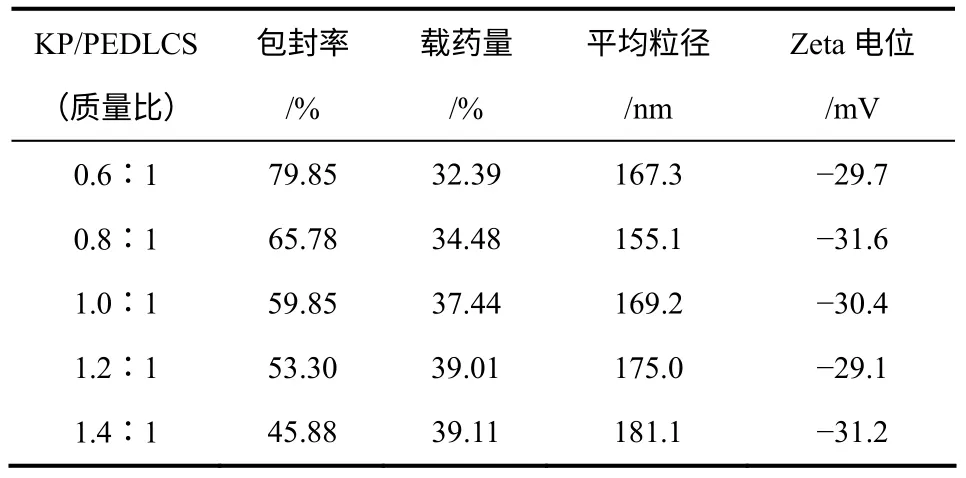
表3 PEDLCS载酮洛芬聚合物胶束的性能参数
2.2.3 载药胶束在不同pH值条件下的响应性
采用KP/PEDLCS质量比为0.8∶1,按照1.3节制得的载药胶束具有良好的pH值响应性。在pH值5.5时胶束呈絮凝状,缓慢滴加PBS缓冲溶液,随着pH值的逐渐增大,在6.0左右凝聚物快速消失,继续增大pH值胶束呈现透明状;再次调节pH<6.0时,凝聚物又迅速出现,可见PEDLCS载药胶束呈现出较优越的pH值敏感性。这可能是由于产物中氮双烷基的存在,在pH值7.4~5.5反复调节时,聚合物胶束质子化和去质子化作用的结 果[7]。
把KP/PEDLCS=0.8∶1制得的载药和空白胶束复溶于不同pH值的PBS溶液中,用纳米激光粒度及Zeta电位分析仪测定粒径和Zeta电位,结果见表4。可见,随着pH值从7.4降低到6.5,空白胶束粒径变大,粒径分散指数从0.155增大到0.359,Zeta电位的绝对值降低;载药胶束的粒径由158.4nm增大到345.8nm,粒径分布由单峰变成双峰(图5),粒径随pH值降低而增大,并且Zeta电位的绝对值由31.5降低到7.95。以上实验说明随着pH值的降低,载药胶束和空白胶束的稳定性降低,粒径有增大的趋势,PEDLCS具有pH值响应性,其响应范围符合癌细胞微环境(pH值7.2~6.0)[16]。
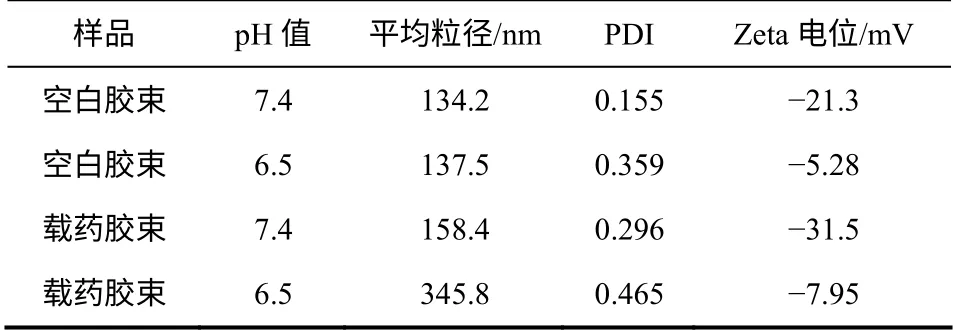
表4 不同pH值条件下空白胶束和载药胶束的性能参数
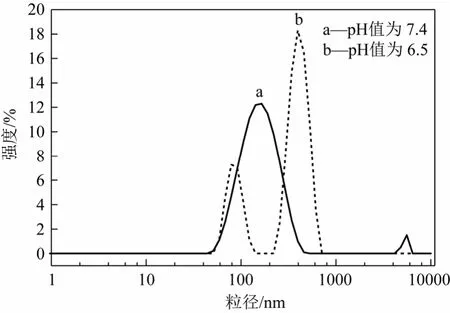
图5 载药胶束在pH值为7.4(a)和6.5(b)的粒径分布
3 结 论
mPEG先用氯乙酸羧化改性,再通过酰化反应接枝到双烷基壳聚糖上,制得高取代度的N,N-双十二烷基-3,6-O-mPEG-壳聚糖(PEDLCS)衍生物,其中烷基取代度为1.89,mPEG接枝度为1.63。PEDLCS溶于水和除乙醚外的大部分有机溶剂,在水溶液中能自组装形成粒径较小的稳定胶束,较小的粒径和较高的mPEG接枝度有利于实现胶束在人体的长循环,从而达到隐形性。pH值响应范围符合癌细胞微环境(pH值7.2~6.0),有望成为具有pH值响应主动靶向的隐形纳米胶束。
参 考 文 献
[1] Koshkaryev A,Sawant R,Deshpande M,et al. Immunoconjugates and long circulating systems:Origins,current state of the art and future directions[J].Advanced Drug Delivery Reviews,2013,65:24-35.
[2] 顾芃,陈建明. PEG化隐形纳米脂质体的研究进展[J]. 药学与临床研究,2011,19(1):47-50.
[3] Pignatello R,Leonardi A,Pellitteri R,et al. Evaluation of new amphiphilic PEG derivatives for preparing stealth lipid nanoparticles[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,434:136-144.
[4] Praneet O,Tanasait N,Amornrut C,et al. Incorporation of camptothecin intoN-phthaloyl chitosan-g-Mpeg self-assembly micellar system[J].European Journal of Pharmaceutics and Biopharmaceutics,2006,64:269-276.
[5] Wang H J,Zhao P Q,Liang X F,et al. Folate-PEG coated cationic modified chitosan——Cholesterol liposomes for tumor-targeted drug delivery[J].Biomaterials,2010,31:4129-4138.
[6] 李昆,孙婷,孙媛,等. 两亲性壳聚糖衍生物的制备及其包覆量子点[J]. 高分子学报,2012,2:180-186.
[7] Jong R M,Young S J,Miklos Z et al. pH-Responsive PEGylated nanoparticles based on amphiphilic polyaspartamide:Preparation,physicochemical characterization and in vitro evaluation[J].Polymer International,2013,62:1218-1224.
[8] 周景润,辛梅华,李明春,等.O-季铵盐-N,N-双长链烷基壳聚糖的制备及其性能[J]. 化工进展,2008,27(10):1654-1658.
[9] Huo M,Zhang Yong,Zhou J P,et al. Synthesis and characterization of low-toxic amphiphilic chitosan derivatives and their application as micelle carrier for antitumor drug[J].International Journal of Pharmaceutics,2010,394:162-173.
[10] Huo M,Zhang Yong,Zhou J P,et al. Formation,microstructure,biodistribution and absence of toxicity of polymeric micelles formed byN-octyl-N,O-carboxymethyl chitosan[J].Carbohydrate Polymers,2011,83:1959-1969.
[11] Lin W J,Chen T D,Liu C W. Synthesis and characterization of lactobionic acid grafted pegylated chitosan and nanoparticle complex application[J].Polymer,2009,50:4166-4174.
[12] Pushpamalar V,Langford S J,Ahmad M,et al. Optimization of reaction conditions for preparing carboxymethyl cellulose from sago waste[J].Carbohydrate Polymers,2006,64(2):312-318.
[13] He X,Zhang F,Wang R,et al. Preparation of a carbon nanotube/carbon fiber multi-scale reinforcement by grafting multi-walled carbon nanotubes onto the fibers[J].Carbon,2007,45 (13):2559-2563.
[14] Wu Y,Zheng Y,Yang W,et al. Synthesis and characterization of a novel amphiphilic chitosan-polylactide graft copolymer[J].Carbohydrate Polymers,2005,59(2):165-171.
[15] Liang X,Sun Y,Duan Y,et al. Synthesis and characterization of PEG‐graft‐quaternized chitosan and cationic polymeric liposomes for drug delivery[J].Journal of Applied Polymer Science,2012,125(2):1302-1309.
[16] 许金霞,唐建斌,赵鲁杭,等. 肿瘤 pH 响应的聚合物胶束用于肿瘤药物靶向输送的研究进展[J]. 药学学报,2009,44(12):1328-1335.
