基于移动终端的麻痹性贝类毒素现场快速检测系统设计*
2015-08-17邹瞿超方佳如苏凯麒裘利坚浙江大学生物传感器国家专业实验室生物医学工程教育部重点实验室生仪学院杭州310027
邹瞿超,方佳如,苏凯麒,周 洁,胡 宁,裘利坚,王 平(浙江大学,生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027)
基于移动终端的麻痹性贝类毒素现场快速检测系统设计*
邹瞿超,方佳如,苏凯麒,周洁,胡宁,裘利坚,王平*
(浙江大学,生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027)
为实现食品中毒素的现场快速检测,设计了一种基于移动终端的麻痹性贝类毒素现场高通量快速检测系统。采用PSP试剂盒对毒素进行显色反应,实现了一定浓度范围内的毒素检测;采用暗室结构,配合面光源透射,提供了稳定的检测环境;采用具有较高像素摄像头的移动终端对反应结果进行采集和处理,实现了检测结果的精确分析和高效交互。以实际样品作为对象进行了系统的功能测试,并与商用酶标仪的结果进行了对比,证明该系统能够较为准确地测得样品中麻痹性毒素的浓度,且检测速度较快,灵敏度较高。结果表明,本系统操作简单,且具有较高的灵敏度、检测速度和通量,能在现场实现麻痹性贝类毒素的快速检测,为食品安全评估提供了一种高效的初筛手段。
生物传感器;麻痹性贝素;试剂盒;移动终端
EEACC:7230Jdoi:10.3969/j.issn.1004-1699.2015.09.001
麻痹性贝毒(Paralytic shellfish poison,PSP)是一类对人体神经肌肉产生麻痹作用的海洋生物毒素,其对人体的作用机理主要表现为阻断神经细胞钠离子通道,从而造成神经系统传输障碍[1]。PSP是所有海洋生物毒素中分布最广、危害最大的几类毒素之一,主要由海洋中的单细胞甲藻产生,并通过贝类对有毒藻的滤食在其体内持续积累,进而通过食物链的富集作用威胁到人们的食品安全和身体健康[2-3]。近年来,我国的东南沿海地区多次发生了因食用染毒贝类引发的消费者中毒甚至死亡事件[4-5]。为了实现食品中PSP毒性的有效评估,设计一种高效准确的检测系统是十分必要的。
随着各方面技术的飞速发展,出现了多种实现PSP毒性有效评估的检测方法。较为传统的毒素检测方法是小白鼠生物试验法,该方法于1980年得到美国分析化学家协会AOAC(Association of Official Analytical Chemists)的推荐[6],并被包括我国在内的许多国家接受和采用,成为检测PSP的标准方法。但该方法也有较多的限制,如不能确定样品中毒素结构;提取液的pH值、盐含量以及其他金属离子均会对毒性判断产生影响;不同小鼠的品系、批次、损伤程度和大小也对测定结果有影响等[7-9]。而高效液相色谱-质谱联用的方法与前者相比具有灵敏度高、结果准确可靠、可确定各种毒素成分、所需检测的样品量少等优势,已被国际上广泛接受。该方法存在的问题是PSP分析标准品全球缺乏,由于各种PSP类似物的毒性种类唯一,很多类似物较易相互转化,样品中的原始或潜在总毒性难以作出判断[10-12]。而免疫分析法通过抗原抗体反应具有高特异性与灵敏度,可分为血球凝聚、放射免疫分析(RIA)和酶联免疫分析(ELISA),但该方法使用过程中获得其特殊的单克隆抗体较为困难并且实验中易出现假阳性[13-16]。此外,其他技术如细胞传感器等也被用于贝类毒素的检测。细胞传感器利用活细胞作为敏感元件感应到细胞外微环境的波动,从而能够通过检测毒素对细胞状态的影响来高效地评估毒性的大小,具有新型的、高一致性、高通量等特点,是对传统方法的很好补充[17-19]。目前,麻痹性贝类毒素检测中较为可靠和常用的仪器是高效液相色谱仪,该设备配合上述高效液相色谱-质谱联用的方法可获得较高检测精度和较为全面的检测参数,但是其仪器结构复杂,价格非常昂贵,检测耗时较长,检测费用也较高,且对待测样品前处理有较高要求,不利于将其发展为现场检测技术。而酶标仪作为应用广泛的光学检测仪器常被用于溶液浓度的检测,配合ELISA方法也被用于实验室内的麻痹性贝类毒素浓度评估,但其体积相对较大不便携,多通道检测时速度较慢,数据处理较为复杂,也不适合样品的现场快速检测和筛选。因此,目前尚未有适合用于现场的便携式检测系统来实现待测贝肉样品中麻痹性贝类毒素浓度的快速、可靠评估。
本文基于免疫分析技术设计一种麻痹性贝类毒素现场检测系统,该系统以移动终端作为分析平台,具有通量高、速度快、操作简单、便携等特点,用于麻痹性贝类毒素的现场快速检测,是对水产品毒性检测方法的补充和发展。本文将详细介绍该系统的原理和组成,并且通过系统性能测试及毒素检测实验验证系统的可行性。
1 材料和方法
1.1试剂与仪器
麻痹性毒素检测试剂盒Abraxis BioScience,异丙醇,冰醋酸,纯水,低温离心机,拍击式均质器,微量进样器,电子天平,振荡器,现场检测系统,酶标比色仪。
1.2方法
1.2.1测定原理
检测的基础为抗原抗体反应,微孔板上固定有PSP抗体的捕捉抗体,在加入标准溶液或样品提取液和PSP酶标记物之后,游离的PSP将与PSP酶标记物竞争结合PSP抗体,而PSP抗体同时与捕捉抗体连接,未结合的酶标记物在洗涤过程中被除去。将酶基质和显色剂加入微孔中孵育,一定时间后加入终止溶液,溶液的颜色状况将与样品中毒素的浓度存在对应关系,通过自制现场检测系统采集溶液颜色图像并进行合适的分析,即可对样品中的毒素浓度进行评估。
1.2.2贝肉样品前处理
除去样品贝壳,将贝肉置于收集器中沥水,5 min后去除碎屑组织,并进行均质,取10 mL备用。向10 mL均质液中加入10 mL萃取液(70%异丙醇:5%冰醋酸=5∶2),并振荡,使均质液与萃取液均匀混合。在4℃下,3 500 G离心10 min,收集上清液。上清液过滤,取100 μL滤液,用样品稀释缓冲液稀释到2.5 mL(25倍稀释,针对样品中毒素浓度不同,可选择不同的稀释倍数,以扩展检测范围)。取50 μL稀释后的滤液作为样品溶液用于试剂盒分析。重复上述步骤,可获得多个待测样品溶液。
1.2.3准备待测检测板
将所有试剂置于室温(20℃~28℃)下,从铝箔袋中拿出一条微孔条,放入干燥剂并重新封好袋子以免微孔条受潮。分别吸取50 μL的浓度为0,0.02× 10-9,0.04×10-9,0.08×10-9,0.16×10-9,0.32×10-9的标准品依次加到对应微孔条中,用于确定试剂盒检测贝类麻痹性毒素的标定曲线,必须保证每种溶液使用干净的吸头吸取,避免交叉污染。将前述步骤中的样品溶液加到其余微孔条中,吸取50 μL酶标记物到微孔板的每个孔中,然后加入50 μL抗体溶液到每个小孔中,混匀,在20℃~28℃下孵育30 min。孵育完后,将微孔中的溶液倒入水槽中,用配好的洗板缓冲液(含有0.05%Tween-20的PBS溶液)清洗,每个微孔至少加入250 μL,震荡后倒掉并倒置在吸水纸上拍打,重复三至四次。在吸水纸上拍打,尽可能将水拍干,然后,每个微孔中加入100 μL显色溶液,在20℃~28℃下避光孵育30 min。孵育完成后,往每个微孔中加入100 μL的终止溶液,即准备好试剂盒96孔检测板用于样品溶液浓度的检测。
1.2.4待测样品快速检测
使用现场检测系统进行检测,将准备好的试剂盒96孔检测板放置在检测装置的适配器上,开启光源,然后使用智能移动设备采集试剂盒96孔检测板的图像,并在分析软件中进行处理,即可计算出样品溶液贝类腹泻性毒素的浓度,根据样品前处理步骤的稀释倍数(如1 mL样品溶液的毒素等于1 g去壳贝肉样品的毒素),即可得到去壳贝肉所含有的贝类腹泻性毒素的含量。
1.3系统设计
本系统组成主要包括运行于移动终端的检测软件、提供稳定检测环境的检测装置以及作为传感器件和检测对象的试剂盒三部分。如图1所示。试剂盒即为上文中所述的麻痹性毒素检测试剂盒。下面将分别就分析软件和检测装置的设计进行详细介绍。

图1 系统实物图
1.3.1检测软件设计
本系统的检测软件(图2)运行于移动终端Iphone,采用Objective-C语言进行开发。Objective-C是一种通用、高级、面向对象的编程语言,扩展了标准的ANSI C编程语言,并将Smalltalk式的消息传递机制加入到ANSI C中,是苹果公司OSX和iOS操作系统,及其相关API、Cocoa和Cocoa Touch的主要编程语言。基于Objective-C语言与Iphone所用iOS操作系统之间的紧密关系,本系统的检测软件可以方便地调用移动终端的相关软硬件资源实现信息采集、处理和交互。
软件的信息采集功能主要是控制智能终端的高像素后置摄像头采集检测结果。软件可控制摄像头进行特定流程的感光和自动对焦从而获得稳定的反应图像,需要时也可以对反应过程进行较长时间的观察和记录。由于检测时试剂盒几十个孔的反应过程都在同一帧图像内出现,可以通过本系统实现真正的实时同步高通量检测。
软件的信息处理功能可以分成两个部分:建立标定曲线和对比确定实际样品浓度。
首先,使用颜色比率与浓度(其以10为底的对数)之间的关系来确定检测毒素的标定曲线。其中颜色比率与图像像素之间的关系如下
式中:Cr(n)是浓度为n的标准品的颜色比率,Ck(n)是浓度为n的标准品的子图像R分量平均值(标准样品为0.02×10-9,0.04×10-9,0.08×10-9,0.16×10-9,0.32× 10-9五个浓度标准品组成的梯度),C0为0的标准品孔的子图像R分量平均值。处理时切割出标准品孔所对应的子图像,子图像为孔内像素范围为10×10的图像;将各子图像分别转换至颜色孔间RGB,提取各子图像中每个像素的R分量,并计算各子图像像素R分量平均值Ck(n);根据上式计算五个标准品溶液颜色比率Cr(n);根据最小二乘法拟合曲线算法,拟合出Cr(n)关于标准品浓度n以10为底的对数的标定曲线,即系统检测毒素的标定曲线。
其次,计算待测样品孔的颜色比率,并对照标定曲线得到待测样品溶液的毒素浓度。待测样品孔颜色比率与其图像像素之间的关系如下
式中:Cr(i)是第i个待测样品的颜色比率,Ck(i)是第i个待测样品的子图像R分量平均值,C0为0的标准品孔的子图像R分量平均值。处理时切割出的样品溶液孔子图像,子图像同样为孔内像素范围为10×10的图像;将子图像转换至颜色孔间RGB,提取子图像中每个像素的R分量,并计算子图像像素R分量平均值Ck(i);根据上式计算待测样品溶液颜色比率Cr(i);将待测样品溶液的Cr(i)值代入系统检测毒素的标定曲线,计算出样品中的毒素浓度,即可完成对应样本毒素浓度的检测。重复上述步骤,可完成多样本的高通量检测。
软件的交互功能表现为用户可通过操作界面对整个检测流程进行控制,并获取检测结果。图3(A)是软件启动时的界面图,图中标示了毒素检测的整个流程。图3(B)为软件的主界面,其中区域1是检测通道选择区域,可点击某一通道得到该通道的检测结果;区域2是检测操作区域,可完成系统的标定曲线校准、实际样品检测和数据上传等功能;区域3是结果显示区域,显示了当前的通道和该通道检测结果。点击主界面区域2中的“Calibrate”按钮可计入标定曲线校准界面图(图3(C)),其中区域4是标定曲线显示区域,显示了当前的标定曲线情况;区域5是参数选择区域,可改变检测对象和对应的衡量参数以便重新校准。用户可通过对上述界面的相应操作完成样品的毒素检测,得到待测样品中的毒素浓度。
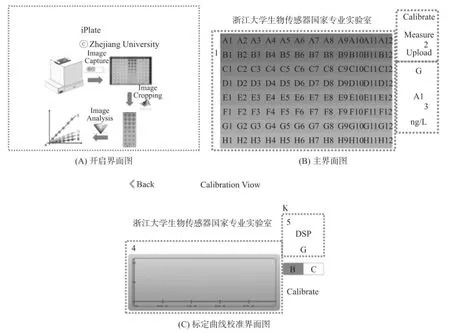
图3 软件界面图
1.3.2检测装置设计
为了保证检测结果的一致性,排除环境干扰,并为智能终端提供合适的检测位置,设计了试剂盒检测的检测装置(图4(A)),如图4(B)所示包括:智能移动设备适配器2、暗室上盖3、试剂盒适配器5、冷光片6、试剂盒装载台7、暗室底座8和控制器9。其中,智能移动设备适配器2用于固定移动终端1的检测位置;暗室上盖3与暗室底座8组成暗室,屏蔽外界环境光对检测的干扰;控制器9需12 V电压源供电,可驱动冷光片6发出均匀白光为图像采集提供光源;冷光片6具有不产生热量、不含紫外线、发光效率高、功耗低等特点,亮度80 cd/m2左右,且不均匀性在±5%以内,满足检测要求;试剂盒适配器5和试剂盒装载台7可固定待测试剂盒4的检测位置,保证试剂盒4与移动终端1相对位置固定且间距为移动终端1后置摄像头成像较为清晰的焦距长度,并方便检测过程中试剂盒4的装卸更换。该装置的结构在固定了试剂盒的检测区域与智能终端摄像头之间的位置关系的同时,保证智能终端能采集到所有样品图像,并为成像提供均匀光照,从而保证检测结果的稳定性和可靠性。

图4 试剂盒检测装置示意图
2 结果与讨论
2.1性能测试
系统性能测试实验采用0.02×10-9,0.04×10-9,0.08×10-9,0.16×10-9,0.32×10-95个浓度的毒素标准品溶液建立贝类麻痹性毒素检测的标定曲线,并使用0.01×10-9、0.03×10-9、0.1×10-9、0.2×10-94个已知浓度的样品对标准曲线和检测系统进行功能验证。图5为系统检测过程中建立的标定曲线,表1为系统性能测试中四个已知浓度样品的检测和对比结果。系统性能测试实验中标定曲线的线性度达到0.9 713,已知浓度样品检测结果的相对误差均在20%以内。
2.2贝类麻痹性毒素检测
使用现场检测系统与酶标仪对同样的8个实际贝肉样品进行贝类麻痹性毒素检测,并将酶标仪的结果作为控制组进行对照。使用0.02×10-9,0.04×10-9,0.08×10-9,0.16×10-9,0.32×10-95个浓度的毒素标准品溶液分别建立两套系统的毒素检测标定曲线,如图6所示,两条曲线的趋势基本一致,且线性度皆高于0.95,其中现场检测系统的线性度为0.9 649,酶标仪的线性度为0.9 582,现场检测系统标定曲线的线性度略高于酶标仪的标定曲线。此外,现场检测系统的标定曲线斜率为-0.355,截距为0.3 938;而酶标仪的标定曲线斜率为-0.5 085,截距为-0.025 36,可见现场检测系统还具有较高的检测灵敏度。
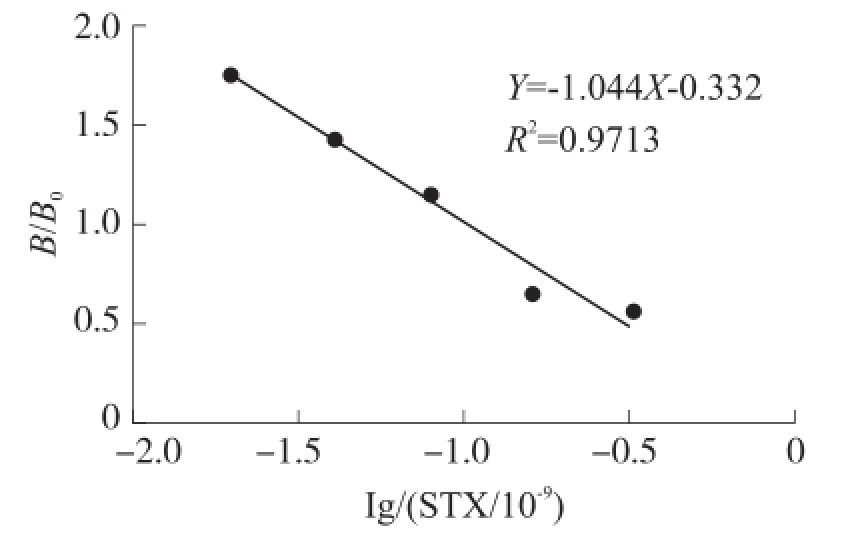
图5 系统性能测试的标定曲线

表1 已知浓度样品验证结果
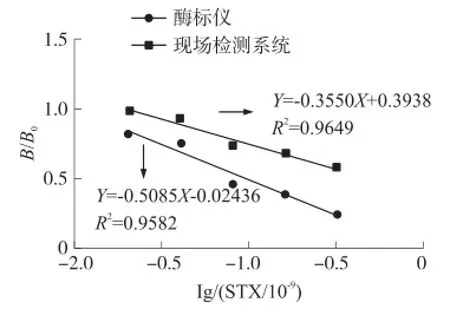
图6 酶标仪与现场检测系统标定曲线对比
8个实际样品的检测结果如表2、表3所示。其中,表2为两套系统直接测得的结果,考虑到为扩展检测范围,前处理流程中将样品溶液进行了稀释,实际为样品稀释150倍后的结果,从表中可以看出,现场检测系统的结果与酶标仪基本一致,相对误差在20%以内。表3为表2中直接测得的结果经换算后得到的各个去壳贝肉样品中的毒素浓度,两套系统的结果仍保持较好的同步性,且与换算前两者间的关系基本一致,相对误差仍在20%以内,满足检测要求,达到实验的预期目的。
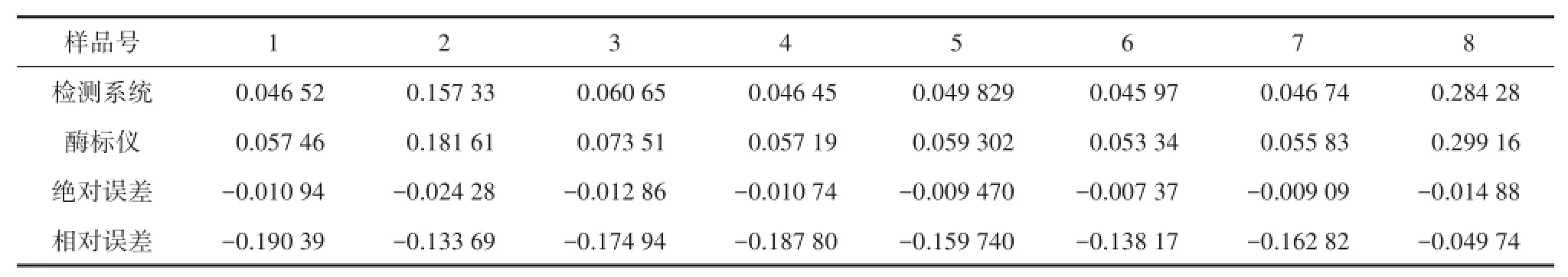
表2 实际样品溶液中毒素检测结果对比(稀释150倍,单位×10-9)

表3 实际样品贝肉中毒素检测结果对比(换算后,单位μg/kg)
3 结论
本文介绍了一种基于移动终端的麻痹性贝类毒素现场检测系统,结合免疫分析技术中的酶联免疫分析(ELISA)方法和移动终端的优势,致力于建立麻痹性贝类毒素的现场快速分析平台,用于该毒素样品的初筛和毒性评价。本系统包括检测软件和检测装置,在完成系统性能测试后,还对麻痹性贝类毒素实际样品进行了检测试验,并将实验结果与酶标仪的检测结果进行了对比。研究结果表明,基于移动终端的麻痹性贝类毒素现场检测系统具备方便快速、高灵敏度、高通量测量等特点,为麻痹性贝类毒素的样品初筛和检测提供了新的有效手段。
[1] M Z,J L,B L,et al.A Recent Shellfish Toxin Investigation in China[J].Marine Pollution Bulletin,1999,39(99):331-334.
[2] Etheridge S M.Paralytic Shellfish Poisoning:Seafood Safety and Human Health Perspectives[J].Toxicon,2010,56(2):108-122.
[3] Huan-ling W,Yu-bo L,Ren-yan L,et al.Present Status of Paralytic Shellfish Poisoning in China[J].Fisheries Science,2008,27 (7):374-378.
[4] 杜克梅,雷芳,吴霓,等.我国东海和南海近岸海域麻痹性贝类毒素污染状况[J].暨南大学学报:自然科学与医学版,2013,34(1):343-346.
[5] Anderson D,Kulis D,Qi Y,et al.Paralytic Shellfish Poisoning in Southern China[J].Toxicon,1996,34(5):579-590.
[6] Turner A D,Hatfield R G,Rapkova M,et al.Comparison of AOAC 2005.06 LC Official Method with Other Methodologies for the Quantitation of Paralytic Shellfish Poisoning Toxins in UK Shellfish Species[J].Analytical and Bioanalytical Chemistry,2011,399(3):1257-1270.
[7] T A,OB S,K N,et al.Oral Toxicity in Mice of Algal Toxins from the Diarrheic Shellfish Toxin(DST)Complex and Associated Toxins[J].Journal of Natural Toxins,1998,7(2):141-158.
[8] Johnson H M,amp,Mulberry G.Paralytic Shellfish Poison:Serological Assay by Passive Haemagglutination and Bentonite Flocculations[J].Nature,1966,211(5050):747-748.
[9] 张松山,李庆鹏,靳静,等.麻痹性贝类毒素常规检测分析方法比较与研究进展[J].食品安全质量检测学报,2014,5(3): 763-769.
[10]Malik A K,Blasco C,Picó Y.Liquid Chromatography-Mass Spectrometry in Food Safety[J].Journal of Chromatography A,2010,1217(25):4018-4040.
[11]Bernd Christian,Luckas B.Determination of Marine Biotoxins Relevant for Regulations:From the Mouse Bioassay to Coupled LC-MS Methods[J].Analytical and Bioanalytical Chemistry,2008,391(1):117-134.
[12]Song K C,Lee K J,Yu H S,et al.Paralytic Shellfish Poisoning (PSP)Analysis Using Liquid Chromatography-Tandem Mass Spectrometry[J].Korean Journal of Fisheries and Aquatic Sciences,2013,46(2):154-159.
[13]Usleber E,Dietrich R.Immunoassay Methods for Paralytic Shellfish Poisoning Toxins[J].Journal of AOAC International,2001,84 (5):1649-1656.
[14]Dao-Yan X,Lei L,Ren-Yan L.Development of Paraltic Shellfish Poisoning(PSP)Monoclonal Antibody and Establishment of Enzyme Linked Immolunosorbent Assay(ELISA)Detection Method [J].Chinese Journal of Immunology,2013,29(1):69-73.
[15]于兵,曹际娟,尤永莉,等.ELISA与小白鼠生物法检测贝类中麻痹性贝毒的比较[J].检验检疫科学,2005,15(1):32-35.
[16]Qi-fang L.Detection of Paralytic Shellfish Poisoning(PSP),Diarrhetic Shellfish Poison(DSP),Neurotoxic Shellfish Poison(NSP)by ELISA[J].China Tropical Medicine,2012,12(11):1398-1399.
[17]王天星,黎洪波,苏凯麒,等.基于细胞电阻抗传感器的细胞多生理参数分析系统设计[J].传感技术学报,2014,27(12): 1589-1595.
[18]苏凯麒,邹玲,王琴,等.基于细胞阻抗传感器的腹泻性毒素检测系统设计与实现[J].传感技术学报,2014,27(3):283-288.
[19]Hu N,Wang T,Cao J,et al.Comparison between ECIS and LAPS for Establishing a Cardiomyocyte-Based Biosensor[J].Sensors and Actuators B:Chemical,2013,185(8):238-244.

邹瞿超(1990-),男,浙江大学,硕士研究生,主要研究方向为生物传感器与系统,cnqczou@zju.edu.cn;

王平(1962-),男,浙江大学,教授,博士生导师,主要研究方向为传感器与检测技术、生物芯片与生物电子学、人工嗅觉与人工味觉等,cnpwang@zju.edu.cn。
Design and Implementation of an In-Suit Paralytic Shellfish Poison Detection System Based on Mobile Terminal*
ZOU Quchao,FANG Jiaru,SU Kaiqi,HU Ning,QIU Lijian WANG Ping*
(Biosensor National Laboratory,Key Laboratory of Biomedical Engineering of Education Ministry,Department of Biomedical Engineering,Zhejiang University,Hangzhou 310027,China)
For the in-suit detection of the paralytic shellfish poison(PSP),a system based on mobile terminal is designed to realize high-throughput quick analysis of the toxin.Chromogenic reaction of PSP kit with the toxin can achieve the concentration within appropriate scope.A darkroom with an area light source can provide a stable testing environment.A mobile terminal with high megapixel camera for data collection and processing can realize accurate analysis of the testing results and efficient interaction.Finally,toxin detection experiments with shellfish samples used to certify the availability of the system.The results showed that the system had several attributes such as in-suit fast detection,simple operation,high sensitivity and applied a new detection platform for PSP of food.
biosensor;paralytic shellfish poison;kit;mobile terminal
R318
A
1004-1699(2015)09-1269-06
项目来源:海洋公益项目(201305010)
2015-04-29修改日期:2015-06-24
