模板法制备银纳米点阵活性基底及其用于葡萄糖的高灵敏检测
2015-08-16郭合帅郑贤正吴明红
郭合帅, 付 群, 林 伟, 郑贤正, 鲁 波, 吴明红, 雷 勇
(1.上海大学环境与化学工程学院,上海 200444;2.上海大学分析测试中心,上海 200444)
模板法制备银纳米点阵活性基底及其用于葡萄糖的高灵敏检测
郭合帅1, 付 群1, 林 伟1, 郑贤正1, 鲁 波2, 吴明红1, 雷 勇1
(1.上海大学环境与化学工程学院,上海 200444;2.上海大学分析测试中心,上海 200444)
介绍了基于超薄氧化铝模板(ultra-thin alumina mask,UTAM)制备的金属银纳米点阵表面增强拉曼散射(surface-enhanced Raman scattering,SERS)活性基底用于葡萄糖的高灵敏检测方法.以UTAM为模板,采用真空镀膜制备了大面积高度有序的银纳米点阵活性基底.该基底的表面经过预处理,吸附了一层癸硫醇/巯基己醇自组装分子层,可用于检测葡萄糖.研究结果表明,该基底使葡萄糖分子的表面拉曼增强信号得到极大增强,且增强信号均一稳定、检测灵敏,特征峰的强度相对标准偏差小于10%.该制备方法具有易操作、成本低的特点.
超薄氧化铝模板;纳米点阵;表面增强拉曼散射;葡萄糖;生理浓度
表面增强拉曼散射(surface-enhanced Raman scattering,SERS)是指在一些特殊的材料表面,分子的拉曼散射光谱强度能得到非常显著的增强,可以将吸附在材料表面的分子的拉曼检测信号放大约106~108倍,对于特殊的纳米量级粒子形态分布的基底表面,分子的拉曼检测信号的增强甚至可以高达1012~1014倍.SERS效应的强弱与基底的材料和结构有着密切关系,因而制备表面稳定、尺寸可控、有序的SERS活性基底已成为SERS研究的热点之一[1-4].
传统方法制备的SERS活性基底在制备和应用上都有一些缺点,限制了SERS技术的进一步应用和发展.本课题组在研究阳极氧化铝模板的基础上,提出并发展了超薄氧化铝模板(ultra-thin alumina mark,UTAM)表面纳米制备技术[5-7].UTAM具有简单易得、低成本的独特优势,可制备大面积高度有序、尺寸可控的纳米颗粒阵列结构.利用UTAM制备的纳米帽结构作为SERS基底检测罗丹明6G时,其表面增强拉曼散射信号的增强非常明显[8].另外,利用UTAM制备的纳米点阵活性基底具有可重复性好、高灵敏、高增强的特性[9-10].目前,对多种探针分子的检测结果已经显示出这种表面纳米结构活性基底在高灵敏痕量分析检测方面的巨大潜力和广阔的发展前景.
SERS技术因其具有高灵敏性和高选择性的特点,已被广泛应用于生物、化学传感技术中痕量分析物的检测,如炭疽孢子、前列腺特异性抗原、葡萄糖[11]、细菌[12]、基因材料[13-14]以及免疫复合物[15]等.近几年,随着人们生活质量的提高,糖尿病的发病率及患病率呈攀升趋势,成为威胁人类健康的重大问题,已引起各国政府的关注和重视.因此,对葡萄糖分子的高灵敏检测进行深入研究具有十分广阔的市场潜力和极为重要的现实意义.
本研究利用UTAM制备的金属银纳米点阵作为SERS基底,通过预处理后,使金属银纳米点阵基底的表面修饰了一层癸硫醇和巯基己醇形成的自组装分子层,用于葡萄糖分子的SERS检测,得到了葡萄糖分子在金属银纳米点阵基底上的SERS光谱.实验结果表明,所制备基底使葡萄糖分子的拉曼信号得到极大增强,且增强信号均一稳定,检测灵敏,特征峰的强度相对标准偏差小于10%.本研究还通过对SERS基底结构参数的调控实现了对葡萄糖检测性能的灵活调控,达到了SERS活性基底最优化的目的.
1 实验部分
1.1 仪器与试剂
本研究所用仪器如下:JSM-6700F场发射扫描电镜(scanning electron microscope,SEM) (日本JEOL公司);Renishaw InVia plus激光显微拉曼光谱仪(英国Renishaw公司);DZD650A电子束蒸发镀膜机(沈阳科友真空技术有限公司);DHG-9053A电热恒温鼓风干燥箱(上海精宏实验设备有限公司);BSA124S Sartorious电子天平(赛多利斯科学仪器(北京)有限公司);中温管式炉(CVD(Z)-06/60/350/30/1)(合肥日新高温技术有限公司).
本研究所用试剂如下:高纯铝片(99.99%,厚度0.2 mm,北京有色金属与稀土研究所);银粉(99.999%,上海国药化学试剂厂);癸硫醇(1-decanethiol,DT,Sigma-Aldrich);6-巯基-1-己醇(6-mercapto-1-hexanol,MH,Sigma-Aldrich);丙酮、无水乙醇、高氯酸、草酸、磷酸、三氧化铬、氯化铜、盐酸、葡萄糖均为分析纯;紫外正光刻胶(RZJ-390PG-50mPa.S,苏州瑞红电化学);实验室用水均为高纯去离子水.
1.2 超薄氧化铝模板的制备
高纯铝片(99.999%)经清洗、退火和抛光处理后,在温度为2°C、电压为40 V、浓度为0.3 mol/L的草酸溶液中采用两步氧化法进行阳极氧化.第一次氧化的时间为12 h,一次氧化结束后,铝片表面生成一层氧化铝膜.将带有氧化层的铝片放入体积比为1∶1的1.8%铬酸和6%磷酸的混合溶液中,在温度为60°C时去除氧化铝膜,时间约为10 h.用高纯去离子水反复冲洗后,放入电解槽中进行二次氧化.二次氧化与一次氧化条件相同,氧化时间为5 min.二次氧化结束后,用高纯去离子水将样品冲洗干净,自然风干.在样品表面旋涂光刻胶,置于60°C恒温干燥箱内烘干,约4 h后取出.以CuCl2溶液去除铝基底,最后在温度为30°C的5%磷酸溶液中进行扩孔,扩孔时间分别为55,60,65和70 min.最后,将样品转移到硅片上得到结构参数不同的UTAM.
1.3 有序银纳米点阵活性基底的制备
将上述制备的结构参数不同的UTAM样品置于蒸发镀膜设备中,在真空度为8×10-4Pa、蒸发速率为0.3~0.5 nm/s的条件下,蒸发银粉厚度为60 nm.然后,用0.1 mol/L的NaOH溶液去除UTAM,得到在硅衬底上的大面积高度有序、结构参数不同的银纳米点阵结构.
1.4 葡萄糖检测
由于葡萄糖分子具有较小的散射截面、弱的吸收以及自身的吸附特性,因此很难在裸露的基底表面观测到葡萄糖的SERS现象[16-17].近几年,许多研究者通过在SERS基底上吸附一层修饰分子,从而得到了葡萄糖分子的表面增强拉曼光谱,这是由于这层修饰分子可以形成自组装分子层(self-assembled monolayer,SAM),使葡萄糖更易于吸附在基底表面.能够形成SAM的修饰分子有EG3[18]、癸硫醇(1-DT)[16]、十二烷基硫醇(1-DDT)[19]、邻巯基苯甲酸(4-MBA)[20]和癸硫醇/巯基己醇(DT/MH)[21]等.因此,本实验中制备的结构参数不同的银纳米点阵需要进行预处理.首先将银纳米点阵浸于浓度为1 mmol/L的癸硫醇溶液中,浸泡45 min后取出,转移到浓度为1 mmol/L的6-巯基-1-己醇溶液中,浸泡至少12 h后取出,氮气吹干[21].所有预处理的银纳米点阵均置于真空干燥箱内备用.
将预处理后的同一颗粒直径的银纳米点阵分别浸于不同生理浓度(5,10,15,20和25 mmol/L)的葡萄糖溶液中,1 h后取出,氮气吹干,测试其SERS光谱,研究不同生理浓度下银纳米点阵对葡萄糖分子SERS光谱的影响;将预处理后的不同颗粒直径银纳米点阵分别浸于生理浓度为15 mmol/L的葡萄糖溶液中,1 h后取出,氮气吹干,测试其SERS光谱,研究不同颗粒直径的银纳米点阵活性基底对葡萄糖分子SERS光谱的影响;将空白硅片浸于浓度为1 mol/L的葡萄糖溶液中,1 h后取出,氮气吹干,测试其常规拉曼光谱.
2 结果与讨论
2.1 超薄氧化铝模板的表征
图1(a)~(d)分别为不同扩孔时间下的UTAM扫描电镜图,其中(a)~(d)相对应的扩孔时间分别为55,60,65和70 min.通过SEM图可以看出,所有UTAM均大面积高度有序,模板孔径大小均一、形状一致,呈六边形紧密排列、分布均匀.UTAM的高度有序性和均一性是制备有序和形状均一的金属银纳米点阵结构的必要保证,并且模板的孔径随着扩孔时间的变化而变化,当模板的扩孔时间由55 min延长到70 min时,模板的孔径也随之增大.通过软件Image J测量可知,随着扩孔时间的延长,模板的孔径由58 nm(扩孔时间55 min)逐渐增大到81 nm(扩孔时间为70 min).在特定氧化条件下制备的UTAM的孔中心距是确定不变的,即相邻两个孔的圆心之间的距离不变.在温度为2°C、电压为40 V、浓度为0.3 mol/L草酸溶液的氧化条件下,模板的孔中心距为(100±2)nm,即随着扩孔时间的延长,孔径逐渐增大,相邻孔间距则相应地减小(从42 nm减小到19 nm).因此,UTAM的结构参数可以通过改变扩孔时间来调节.因为模板的孔间距会直接影响纳米点阵的间隙(gap),继而影响活性基底的SERS性能,所以UTAM结构参数的可调可控是使所制备银纳米点阵的结构和性能可调可控的前提,因而通过调节UTAM的扩孔时间可实现对活性基底SERS性能的可调可控.

图1 不同孔径的UTAM扫描电镜图Fig.1 SEM images of UTAM with di ff erent pore diameters
2.2 银纳米点阵的表征
图2(a)~(d)分别为不同颗粒直径的金属银纳米点阵扫描电镜图.这些银纳米点阵是由不同孔径的UTAM作为模板蒸发沉积厚度为60 nm的银膜所得到的.由图可知,各个银纳米点阵结构均大面积高度有序、分布均匀、形状一致,呈明显的正六角形紧密排列,与UTAM结构一致.通过软件Image J测量可知,银纳米点阵的颗粒直径与UTAM的孔径相吻合,随着UTAM孔径由58 nm(扩孔时间为55 min)逐渐增大到81 nm(扩孔时间为75 min),相应的银纳米点阵颗粒直径也逐渐增大,由58 nm(见图2(a))增大到81 nm(见图2(d)).另外,相邻纳米颗粒的中心距为(100±2)nm,与UTAM中相邻孔中心距一致.因此,随着银纳米点阵的颗粒直径逐渐增大,相邻银纳米颗粒的间隙(gap)逐渐减小(从42 nm减小到19 nm),尤其在图2(d)中,银纳米颗粒直径最大,使得相邻纳米颗粒间隙即SERS“热点”(“热点”是指紧密相邻的纳米结构中的脉间区域或是纳米颗粒之间的特定间隙)尺寸最小,“热点”数目最多,这对纳米结构点阵SERS活性基底的性能有着非常重要的影响.因此,通过调节UTAM的扩孔时间可以制备结构参数不同的UTAM,进而实现对大面积高度有序银纳米点阵结构参数的可调可控,最终实现活性基底中SERS活性位点的可控制备,达到SERS活性基底最优化的目的.

图2 不同颗粒直径的银纳米点阵的扫描电镜图Fig.2 SEM images of ordered Ag nanoparticle arrays with di ff erent diameters
2.3 葡萄糖的表面增强拉曼光谱及实验结果分析
2.3.1 颗粒直径对葡萄糖SERS光谱的影响
为了研究银纳米点阵活性基底中颗粒直径对葡萄糖分子的SERS光谱的影响,本实验测试了图2(a)~(d)中不同颗粒直径的银纳米点阵SERS活性基底对生理浓度为15 mmol/L的葡萄糖溶液的SERS光谱(见图3).图3中自上而下依次为颗粒直径81,74,67和58 nm的银纳米点阵活性基底的SERS谱图以及葡萄糖分子的常规拉曼谱图,其中4条谱线均显示了4个相同葡萄糖分子的拉曼特征峰以及位移,在893和1 124 cm-1处的拉曼特征峰归属于葡萄糖分子的C—C伸缩振动;1 069和1 435 cm-1处的拉曼特征峰归属于葡萄糖分子的C—H伸缩振动;1 296 cm-1处的拉曼特征峰归属于葡萄糖分子的C—C—H左右摆动[19].可以看出,葡萄糖分子的常规拉曼光谱信号极弱,几乎观察不到有效的分子振动信号,而在银纳米颗粒点阵活性基底上得到的葡萄糖分子振动信号明显增强,而且随着银纳米点阵的颗粒直径从58 nm增大到81 nm,活性基底的SERS信号逐渐增强,当颗粒直径增大至81 nm时,所得的葡萄糖分子的SERS信号达到最强.这是因为随着银纳米颗粒直径由58 nm增大到81 nm,相邻纳米颗粒间隙逐渐减小,尤其是当颗粒直径为81 nm时,相邻纳米颗粒间隙(即SERS“热点”)尺寸大大减小,“热点”处局域表面等离子体共振引起的电磁场增强是拉曼信号大幅增强的主要原因.由于等离子体共振间的耦合,电磁场强度相当高,因此“热点”尺寸越小,拉曼增强信号越强,故活性基底的SERS效应可得到极大的增强.
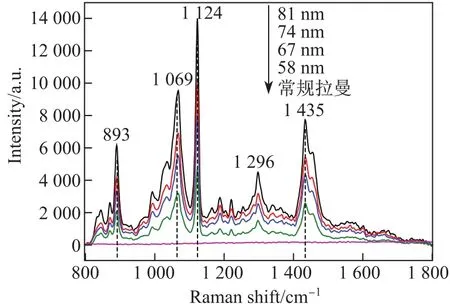
图3 不同颗粒直径的银纳米点阵基底的葡萄糖分子SERS光谱Fig.3 Glucose molecule SERS of Ag nanoparticle arrays substrates with di ff erent diameters
另外,4个特征峰(893,1 069,1 124和1 435 cm-1处)强度随颗粒直径的变化趋势如图4(a)所示.可以看出,颗粒直径越大,特征峰的强度越强,这是由于随着颗粒直径的增大,颗粒间的间隙(gap)逐渐减小,导致“热点”尺寸变小,使得SERS强度增强,其中1 124 cm-1处的特征峰与颗粒直径的变化呈现出较好的线性关系.
2.3.2 不同生理浓度对葡萄糖分子SERS光谱的影响
对于葡萄糖传感器来说,必须在0~450 mg/dL(即0~25 mmol/L)生理浓度的条件下才能检测到血糖[22].因此,本实验中将银纳米点阵作为SERS基底,进行预处理后测试不同生理浓度下的信号变化情况.实验中SERS活性基底采用颗粒直径为81 nm的银纳米点阵,分别对不同生理浓度(5,10,15,20和25 mmol/L)的葡萄糖溶液进行SERS测试,结果如图4(b)所示.所得到的特征峰强度与所测试葡萄糖的生理浓度呈正线性相关.与其他特征峰相比,处于1 124 cm-1的特征峰与不同的葡萄糖生理浓度均表现出较好的线性关系.

图4 点阵颗粒直径和生理浓度对葡萄糖分子SERS光谱的影响Fig.4 Response showing the intensity variation of prominent SERS peaks of glucose at nanoparticle diameter and physiological concentrations
2.3.3 银纳米点阵SERS基底的均一性检测
为了验证所制备的金属银纳米点阵能否作为实用检测葡萄糖生理浓度的表面增强拉曼活性基底,本实验还对颗粒直径为81 nm的银纳米点阵结构进行了拉曼增强信号均一性检测.在基底表面随机选取20个点进行SERS测试,20个点的SERS谱图如图5(a)所示.可以看出,随机选取的20个点的SERS谱线峰形和强度都比较接近,说明基底的拉曼信号均一性良好.为定量衡量银纳米点阵的均一性,还分别计算了893,1 069,1 124和1 435 cm-1处4个特征峰的相对标准偏差(relative standard deviation,RSD)(见图5(b)),分别为9.62%,7.55%,7.60%和7.68%.作为实用的SERS活性基底,特征峰处的相对标准偏差一定要小于20%[23-24].本实验通过UTAM制备得到的银纳米点阵的表面拉曼增强信号相对标准偏差小于10%,这说明所制得的银纳米点阵SERS活性基底信号均一性比较理想,可以作为葡萄糖生理浓度的检测基底.

图5 随机选取20个点的拉曼光谱和4个特征峰处的相对标准偏差Fig.5 SERS spectra of 20 dots randomly selected on sample surface and the RSD of 4 peaks
为了进一步验证SERS基底的拉曼增强信号均一性,本实验对银纳米点阵进行了mapping测试.由于点阵中颗粒直径越大,“热点”尺寸越小,SERS的增强效果越显著,因此本实验选取颗粒直径最大的银纳米点阵(即81 nm)作为活性基底,对其进行预处理后浸于15 mmol/L的葡萄糖溶液中1 h,取出氮气吹干后进行mapping测试.图6(a)为在银纳米点阵活性基底表面随机选取6个区域测试得到的SERS mapping图,选取的面积为20µm× 20µm,步长设为2µm,特征峰为1 124 cm-1.图6(b)为SERS峰强度分布,从中可以看出1 124 cm-1特征峰处的拉曼强度分布集中在(1.0~1.2)×104,与图6(a)的mapping测试结果相吻合.图6(c)为大面积银纳米点阵的扫描电镜图,说明采用UTAM制备的金属银纳米点阵大面积高度有序.从图6(a)的mapping图可以看出明暗变化较小,SERS谱图的特征峰强度分布比较集中,这也说明了所选区域的拉曼增强信号是均一的.
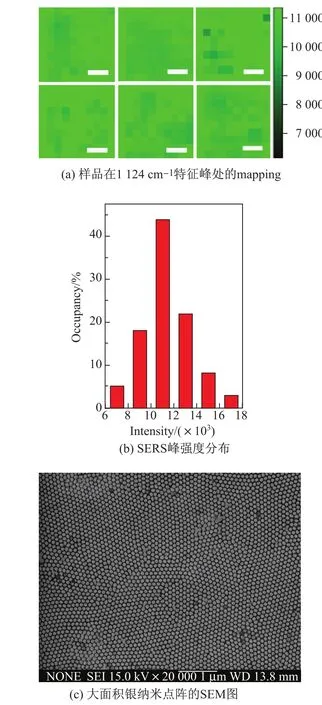
图6 基底的均一性及其SERS信号的可重复性Fig.6 Uniformity and SERS signal reproducibility of the substrate
3 结束语
本研究通过UTAM制备得到了形貌均一、高度有序、结构参数可控的金属银纳米点阵.首次采用模板法制备的金属银纳米点阵作为检测葡萄糖分子的SERS活性基底,对其进行预处理后发现,其对葡萄糖分子的拉曼信号具有显著的增强作用,且增强信号均一性较好,特征峰处的相对标准偏差均小于10%,可用于葡萄糖生理浓度的检测.本研究还通过调节UTAM的扩孔时间制备出结构参数不同的UTAM,进而实现对大面积高度有序的银纳米点阵结构参数的可调可控,最终实现对活性基底中SERS活性位点的可控制备,达到SERS活性基底最优化的目的.
[1]FLEIsCHMANN M,HENDRA P J,MCQUILLAN A J.Raman spectra of pyridine adsorbed at a silver electrode[J].Chem Phys Lett,1974,26(2):163-166.
[2]CHOI D,CHOI Y,HONG S,et al.Self-organized hexagonal-nanopore SERS array[J].Small,2010, 6(16):1741-1744.
[3]陈振宜,陈娜,胡玲,等.2×2熔锥光纤表面增强拉曼散射实验[J].上海大学学报:自然科学版, 2012,18(1):7-11.
[4]HUANG Z L,MENG G W,HUANG Q,et al.Large-area Ag nanorod array substrates for SERS:AAO template-assisted fabrication,functionalization,and application in detection PCBs[J].J Raman Spectrosc,2013,44:240-246.
[5]周懿,付群,王沙沙,等.有序金纳米阵列的可控制备及其表面增强拉曼光谱[J].上海大学学报:自然科学版,2013,19(5):479-484.
[6]LEI Y,YANG S,WU M H,et al.Surface patterning using templates:concept,properties and device applications[J].Chem Soc Rev,2011,40(3):1247-1258.
[7]WU M H,WEN L Y,LEI Y,et al.UTAM surface nano-patterning in fabricating quantum-sized nanodots[J].Small,2010,6(5):695-699.
[8]王沙沙,付群,周懿,等.高拉曼增强银纳米帽阵列活性基底的模板法制备及其性能[J].上海大学学报:自然科学版,2013,19(4):417-422.
[9]DUAN G T,CAI W P,LUO Y Y,et al.Hierarchical surface rough ordered Au particle arrays and their surface enhanced Raman scatting[J].Applied Physics Letters,2006,89(18):181918.
[10]LEI Y,CHIM W K.Shape and size control of regularly arrayed nanodots fabricated using ultrathin alumina masks[J].Chem Mater,2005,17:580-585.
[11]DIERINGER J A,II R B L,SCHEIDT K A,et al.A frequency domain existence proof of singlemolecule surface-enhanced Raman spectroscopy[J].J Am Chem Soc,2007,129:16249-16256. [12]DONGHOON H,SUNG Y L,BEOM J K,et al.Mercury(Ⅱ)detection by SERS based on a single gold microshell[J].Chem Commun,2010,46:5587-5589.
[13]DINIsH U S,FU C Y,AJAY A,et al.Development of highly reproducible nanogap SERS substrates:comparative performance analysis and its application for glucose sensing[J].Biosensors and Bioelectronics,2011,26:1987-1992.
[14]LEI Z,JIA J X,LUO M,et al.Multifunctional magnetic plasmonic nanoparticles for fast concentration and sensitive detection of bacteria using SERS[J].Biosensors and Bioelectronics, 2012,31:130-136.
[15]ZHENG Y H,THAI T B,REINECK P L,et al.DNA-directed self-assembly of core-satellite plasmonic nanostructures:a highly sensitive and reproducible near-IR SERS sensor[J].Adv Funct Mater,2012,23(12):1519-1526.
[16]MROzEK M F,WEAvER M J.Detection and identi fi cation of aqueous saccharides by using surface-enhanced Raman spectroscopy[J].Anal Chem,2002,74:4069-4075.
[17]SHAFER K E,HAYNEs C L,GLUCKsBERG M R,et al.Toward a glucose biosensor based on surface-enhanced Raman scattering[J].J Am Chem Soc,2003,125:588-593.
[18]STUART D A,YONzON C R,ZHANG X Y,et al.Glucose sensing using near-infrared surfaceenhanced Raman spectroscopy:gold surfaces,10-day stability,and improved accuracy[J].Anal Chem,2005,7:4013-4019.
[19]RYCENGA M,MCLELLAN J M,XIA Y N.A SERS study of the molecular structure of alkanethiol monolayers on Ag nanocubes in the presence of aqueous glucose[J].Chemical Physics Letters, 2008,463:166-171.
[20]DONG J,TAO Q,GUO M D,et al.Glucose-responsive multifunctional acupuncture needle:a universal SERS detection strategy of small biomolecules in vivo[J].Anal Methods,2012,4:3879-3883.
[21]DINIsH U S,YAw F C,AGARwAL A,et al.Development of highly reproducible nanogap SERS substrates:comparative performance analysis and its application for glucose sensing[J]. Biosensors and Bioelectronics,2011,26:1987-1992.
[22]LYANDREs O,SHAH N C,YONzON C R,et al.Real-time glucose sensing by surface-enhanced Raman spectroscopy in bovine plasma facilitated by a mixed decanethiol/mercaptohexanol partition layer[J].Anal Chem,2005,77:6134-6139.
[23]NATAN M J.Concluding remarks surface enhanced Raman scattering[J].Faraday Discuss,2006, 132:321-328.
[24]LIN X,CUI Y,XU Y,et al.Surface-enhanced Raman spectroscopy:substrate-related issues[J]. Analytical and Bioanalytical Chemistry,2009,394(7):1729-1745.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
Template preparation of Ag nanoparticle arrays SERS-active substrate and highly sensitive detection of glucose
GUO He-shuai1,FU Qun1,LIN Wei1,ZHENG Xian-zheng1,LU Bo2, WU Ming-hong1,LEI Yong1
(1.School of Environmental and Chemical Engineering,Shanghai University,Shanghai 200444,China; 2.Instrumental Analysis&Research Center,Shanghai University,Shanghai 200444,China)
A highly sensitive method for detecting glucose using Ag nanoparticle arrays surface-enhanced Raman scattering(SERS)active substrates based on the ultra-thin alumina mask(UTAM)was reported.The large-area highly ordered Ag nanoparticle arrays active substrates were fabricated using thermal evaporation with UTAM as a shadow mask in vacuum.The surface of active substrates can adsorb a layer of decanethiol/mercaptohexanol(DT/MH)self-assembled monolayers(SAM)through the surface pretreatment.Therefore the active substrates can be used for detecting glucose molecules.SERS measurement results of the active substrate with glucose molecules as probe molecules show strong SERS performance,and the enhanced signal is uniform andstable.The relative standard deviation(RSD)of the characteristic peak intensity is less than 10%.This preparation method has the advantages of simple operation and low cost.
ultra-thin alumina mask(UTAM);nanoparticle;surface-enhanced Raman scattering(SERS);glucose;physiological concentration
TU 411
A
1007-2861(2015)01-0054-10
10.3969/j.issn.1007-2861.2014.03.004
2014-03-05
国家杰出青年科学基金资助项目(11025526);国家自然科学基金资助项目(41073073,51301104);长江学者和创新团队发展计划资助项目(IRT13078);上海市科委科技专项资助项目(13230500600);上海市千人计划资助项目;上海市东方学者资助项目
吴明红(1968—),女,教授,博士生导师,博士,研究方向为辐射化学和纳米器件.
E-mail:mhwu@sta ff.shu.edu.cn
