白藜芦醇通过Sirtuins 1通路促进自噬减轻大鼠脑缺血/再灌注损伤
2015-08-11周也涵叶秀峰
石 瑶,郭 倩,周也涵,万 丹,叶秀峰
(重庆医科大学 基础医学院 病理学教研室 神经科学研究中心, 重庆 400016)
研究论文
白藜芦醇通过Sirtuins 1通路促进自噬减轻大鼠脑缺血/再灌注损伤
石 瑶,郭 倩,周也涵,万 丹,叶秀峰*
(重庆医科大学 基础医学院 病理学教研室 神经科学研究中心, 重庆 400016)
目的观察白藜芦醇(Res)在大鼠局灶性脑缺血/再灌注(I/R)损伤中脑保护作用与自噬的关系。方法随机将大鼠分成假手术组(S组)、脑缺血/再灌注模型组(I/R组)、低和高剂量(15和40 mg/kg)Res处理组(R1和R2组),其中将R2组另设2个亚组:R2+3-甲基腺嘌呤(3-MA)组和R2+Sirt1抑制剂Sirtinol 组。线栓法构建大鼠I/R模型。缺血2 h,再灌注24 h后,用尼氏染色观察皮质区的组织学形态;用2,3,5-氯化三苯基四氮唑(TTC)染色法检测脑组织的梗死体积;用real-time QPCR和Western blot检测脑组织中Sirt1和LC3的mRNA和蛋白表达。结果与S组相比,I/R组大鼠可见明显的脑梗死灶,显微镜下见病理损伤改变,自噬相关蛋白LC3 Ⅱ/LC3 Ⅰ、Sirt1表达均有上升。Res预处理后,能明显减轻I/R大鼠皮质区的病理损伤,减少脑梗死体积(P<0.01),显著增加I/R大鼠脑组织中LC3 Ⅱ/LC3 Ⅰ和Sirt1的表达(P<0.01);而Sirt1抑制剂及3-MA能削弱Res的作用。结论Res减轻大鼠局灶性脑缺血/再灌注损伤的脑保护作用可能与Res通过提高Sirt1的表达进而促进自噬来完成的。
脑缺血/再灌注损伤;白藜芦醇;自噬;沉默信息调控因子1
白藜芦醇(resveratrol,Res)是一种广泛存在于虎杖、葡萄和花生等植物性食物或药物中的非黄酮类多酚小分子物质,具有抗感染、抗氧化、神经保护和抗肿瘤等多种生物学活性[1]。本实验的前期研究结果表明[2],Res预处理对大鼠局灶性脑缺血/再灌注损伤有神经保护作用,与文献[3]报道相符,且进一步研究发现保护机制可能与其诱导自噬的发生有关。然而,Res是在脑缺血/再灌注损伤中如何诱导激活自噬机制尚待阐明。
沉默信息调控因子1(sirtuins 1,Sirt1)是广泛存在于哺乳动物中NAD+依赖的去乙酰化酶,有研究发现Sirt1的表达及活性上调能够诱导自噬的激活[4],且被认为Res是目前为止发现最强的Sirt1激动剂[5],在神经变性疾病中,Res能通过上调Sirt1进而诱导自噬发生起到神经保护作用,对延缓神经变性疾病进展有重要意义[6]。
本实验旨在探讨Res对大鼠局灶性脑缺血/再灌注损伤中脑保护作用与自噬的关系,并进一步探讨其可能机制,找寻药物作用的靶点,以期为缺血性脑血管疾病的预防及临床治疗提供研究依据。
1 材料与方法
1.1 实验动物和分组
SPF级SD大鼠(雄性)72只,体质量250~300 g[重庆医科大学实验动物中心,许可证号:SCXK(渝)2007-0001]。将大鼠随机分成4个组:假手术组(S组,n=16)、脑缺血/再灌注模型组(I/R组,n=16)、低和高剂量(15和40 mg/kg)Res处理组(R1组,n=16和R2组,n=24),其中将R2组另设两个亚组:R2+3-MA组和R2+Sirtinol组。
1.2 药品与试剂
白藜芦醇(纯度99%,Genview公司);3-MA、Sirtinol、DMSO和TTC(Sigma公司);RNAiso Plus、PrimeSriptTMRT reagent Kit反转录试剂盒和SYBR® Premix Ex Taq®试剂盒(TaKaRa公司);鼠抗-Sirt1单克隆抗体和兔抗-LC3多克隆抗体(Abcam公司);兔抗-β-actin多克隆抗体(北京四正柏公司);HRP标记山羊抗鼠IgG和山羊抗兔IgG(北京中杉金桥公司);BCA蛋白定量试剂盒(北京百泰克公司)。蛋白裂解液和凝胶配制试剂盒(碧云天生物技术研究所)。
1.3 大鼠脑缺血/再灌注损伤模型制备及给药
采用改良的Longa等[7]大脑中动脉内线栓阻断法(middle cerebral artery occlusion,MCAO)建立局灶性脑缺血再灌注(I/R)模型,缺血2 h,再灌注24 h。S组:手术过程同I/R组,但线栓插入深度10 mm即可。R1组和R2组大鼠在用药前称重,分别给予Res低和高剂量(15和40 mg/kg)腹腔注射,每天1次,第7天于术前30 min给药。S组和I/R组大鼠予以DMSO和0.9%氯化钠注射液处理,给药方式及剂量同Res处理组。R2+3-MA组和R2+Sirtinol组大鼠于术前30 min用微量注射器向右侧脑室(前囟点旁开1.6 mm,向后0.9 mm,腔深3.8 mm)分别给药3-MA 5 μL(50 μg)、Sirtinol 5 μL(3.94 μg)。在模型制备过程中均用白炽灯加热,维持肛温37 ℃左右。术后大鼠麻醉苏醒后,参照Longa的评分标准[7],模型入选标准为1~3分,实验组随机补全,保证各组动物的数量不变。
1.4 尼氏染色法观察尼氏体表达
大鼠缺血2 h,再灌注24 h后麻醉、心脏灌洗,冰上断头取脑、4%多聚甲醛固定,石蜡包埋。切片行常规尼氏染色后用中性树胶封片。在显微镜下观察脑组织切片的染色情况,可见尼氏体存在于胞浆中呈深蓝色颗粒。
1.5 Real-time QPCR检测Sirt1和LC3 mRNA的表达
1.5.1 引物设计及合成:用Primer 5.0 软件设计大鼠目的基因LC3、Sirt1和β-actin的引物序列,由生工生物工程(上海)股份有限公司合成(表1)。

表1 大鼠目的基因LC3、Sirt1和β-actin的引物序列Table 1 Primer sequence of the rat LC3, Sirt1 and β-actin target gene
1.5.2 脑组织总RNA的提取:将各组大鼠于术后24 h断头处死,快速取出右侧大脑组织的额顶叶皮质,按RNAiso Plus提取试剂盒说明书提取组织的总RNA,检测总RNA的浓度和纯度,对A260/A280比值为1.8~2.2的样品进行下一步实验。
1.5.3 Real time QPCR反应:按反转录试剂盒说明书合成cDNA作为模板,进行real time QPCR反应。引物序列:见表1。25 μL反应体系:SYBR Premix Ex TaqTMⅡ 12.5 μL,上下游引物各1 μL,cDNA模板2 μL,ddH2O 8.5 μL。反应条件为:94 ℃ 5 min;94 ℃ 10 s,58 ℃ 1 min,72 ℃ 15 s,39个循环。以2-△△Ct(Ct代表循环阈值)表示基因的表达量△△Ct=(Ct目的基因-Ct内参基因)处理组-(Ct目的基因-Ct内参基因)对照组。
1.6 Western blot检测Sirt1和LC3的蛋白表达
术后24 h,提取各组脑组织总蛋白,BCA法测定蛋白浓度。制备SDS-PAGE凝胶,上样电泳,蛋白经湿转法转至PVDF膜上,TBS漂洗膜3次, 封闭液(质量分数为5%脱脂奶粉溶于1×TBST缓冲液)室温封闭1 h,将膜置于溶有一抗Sirt1或LC3或β-actin的封闭液中,室温0.5 h,4 ℃过夜。次日用TBST漂洗膜3次,将膜放入已用封闭液稀释的二抗中,室温1h,TBST漂洗膜3次。ECL显影,调节BIO-RAD凝胶成像仪的参数进行曝光采图,Quantity one软件分析,测定并计算出LC3 Ⅱ与LC3 Ⅰ、Sirt1与β-actin条带吸光度值比值,进行统计学分析。
1.7 TTC染色测定脑梗死的体积
用TTC染色法测定大鼠脑梗死体积。术后24 h,深度麻醉大鼠,立即断头取出除嗅球、小脑和低位脑干后的剩余脑组织,放于脑冠状切片槽中,均匀切成厚度为2 mm薄片,迅速放入质量分数为2%的TTC染液中,避光,37 ℃染色20 min后观察脑片颜色,红色为正常组织,苍白色为梗死灶,用体积分数为4%的多聚甲醛避光固定6 h,拍照,应用Image Pro Plus 6.0图像分析软件测量并计算出脑梗死的体积。
1.8 统计学分析

2 结果
2.1 尼氏染色对大鼠皮质区的形态学观察
S组大鼠皮质区的神经细胞形态结构正常,胞质内可见丰富的深蓝色颗粒,即尼氏小体;I/R组神经细胞的结构模糊,胞体肿胀,尼氏小体减少且淡染;经不同浓度Res预处理后,R1和R2组减轻了大鼠皮质区异常形态学改变,增加了尼氏小体的数量;而R2+3-MA组和R2+Sirtinol组大鼠皮质区的病理改变加重,但比I/R组仍有改善(图1)。
2.2 Real time QPCR检测Res对Sirt1和LC3 mRNA表达水平的影响
与S组相比,I/R组脑组织Sirt1和LC3 的mRNA表达增加(P<0.01),经不同浓度Res预处理后,Sirt1和LC3 的mRNA表达进一步上调,其中R2组差异更明显(P<0.01)(图2A);Sirtinol处理组mRNA表达降低,3-MA处理组LC3 mRNA表达被抑制,但仍高于I/R组(P<0.01)(图2B)。
2.3 Western blot检测Res对Sirt1和LC3 Ⅱ/LC3 Ⅰ蛋白表达水平的影响
与S组相比,I/R组脑组织Sirt1和LC3 Ⅱ/LC3 Ⅰ蛋白表达增加(P<0.01),经不同浓度Res预处理后,Sirt1和LC3 Ⅱ/LC3 Ⅰ蛋白表达进一步增加,其中R2组差异更明显(P<0.01)(图3A);Sirtinol处理组二者蛋白表达下降,3-MA处理组LC3 蛋白表达被抑制,但仍高于I/R组(P<0.01)(图3B)

A.S group; B.I/R group; C.R1 group; D.R2 group; E.R2+3-MA; F.R2+Sirtinol

A.expression of Sirt1 and LC3 detected by real time QPCR;B.Sirtinol and 3-MA changed the expression of Sirt1 and LC3 detected by real time QPCR;*P<0.01 compared with S group;**P<0.01 compared with R2 group;#P<0.01 compared with I/R group;ΔP<0.01 compared with R1 group
图2 Real time-QPCR分析中各组Sirt1和LC3 mRNA的转录水平
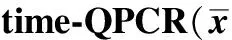
2.4 脑梗死体积检测
I/R组出现明显的脑梗死灶,经Res预处理后,R1和R2组梗死体积减小,R2组差异更明显(P<0.01);Sirtinol处理组和3-MA处理组脑梗死体积有所增大,但仍小于I/R组(P<0.01)(图4)
3 讨论
缺血性脑血管疾病是临床上常见病和多发病,具有高致残率、高囜死率等特点,严重威胁公众健康。自噬是真核细胞中广泛存在的降解/再循环系统[8],LC3是自噬标记性蛋白,具有LC3 Ⅰ和LC3 Ⅱ两种形式,LC3 Ⅱ含量或LC3 Ⅱ/LC3 Ⅰ的比值增高可反映自噬活性的增强[9]。研究表明[10- 11],自噬在局灶性脑缺血/再灌注损伤中可被诱导激活且起保护作用。Res属于非黄酮类多酚化合物,结构简单,具有抗感染、抗氧化、神经保护和抗肿瘤等强大的生物学作用[1]。本研究发现,与S组相比,I/R组大鼠出现明显的脑梗死灶和病理学改变,以及LC3的表达增加,经Res预处理后R1和R2组脑缺血/再灌注损伤引发的病理改变减轻,脑梗死体积减少及LC3的表达进一步增加,这与本实验前期研究结果一致[2]。且本实验进一步研究表明,与R2组相比,给予自噬抑制剂3-MA共处理3-MA+R2组,脑组织LC3表达降低,病理改变加重且脑梗死体积增加。证实Res可诱导脑I/R自噬激活发挥脑保护作用。

A.expression of Sirt1 and LC3 Ⅱ/LC3 Ⅰ detected by Western blot;B.Sirtinol and 3-MA changed the expression of Sirt1 and LC3Ⅱ/LC3 Ⅰ detected by Western blot;*P<0.01 compared with S group;**P<0.01 compared with R2 group;#P<0.01 compared with I/R group;ΔP<0.01 compared with R1 group
图3 各组神经元中Sirt1和LC3蛋白的表达
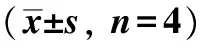
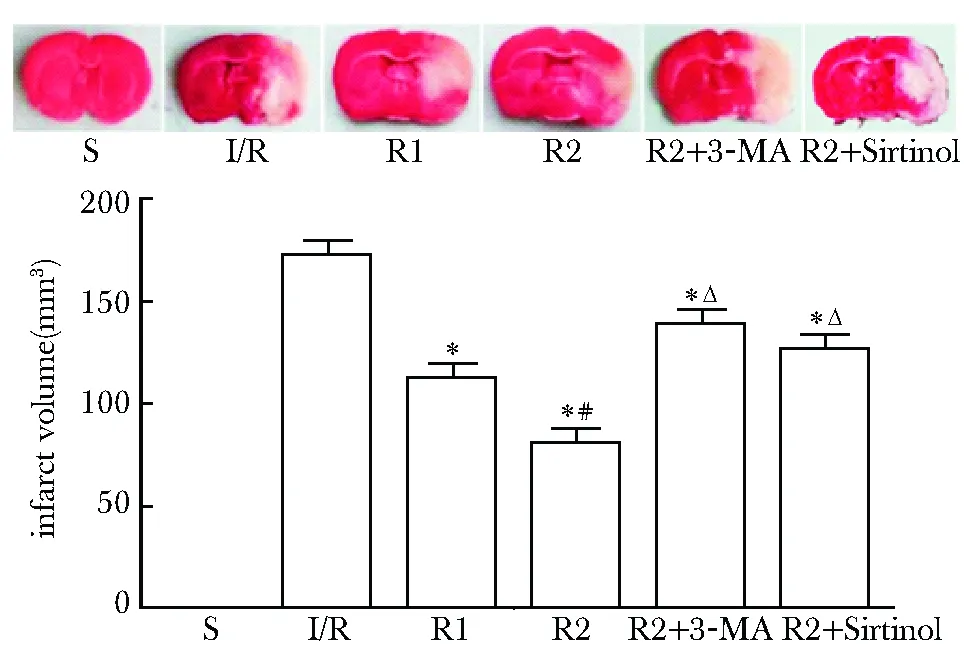
red.normal brain tissue; white.infarction tissue;*P<0.01 compared with I/R group; #P<0.01 compared with R1 group;ΔP<0.01 compared with R2 group图4 脑冠状切片TTC染色
Sirt1作为一种NAD+依赖的去乙酰化酶,在哺乳动物脑神经元中高表达,调节神经的损伤修复及神经保护[12]。众所周知,Res被认为是目前为止发现的最强Sirt1激动剂[5]。研究表明,在神经变性疾病(阿尔茨海默病、帕金森病)中,Res能通过上调Sirt1进而诱导自噬发生起到神经保护作用,对延缓神经变性疾病进展有重要意义[6]。
为了研究Res诱导激活脑I/R自噬的机制,进一步检测了Sirt1的表达。实验结果显示脑I/R模型中Sirt1 mRNA和蛋白表达上调,Res预处理R1和R2组可促进Sirt1表达进一步增加,Sirt 1抑制剂Sirtinol处理后,Res介导的Sirt1和LC3表达上调被抑制,且脑梗死体积增加,认为Sirt1确实参与了Res诱导的自噬调控。
综上所述,本实验结果表明Res在脑缺血/再灌注损伤中诱导自噬的发生起脑保护作用,Res诱导激活自噬对脑缺血/再灌注起保护作用的机制可能与上调Sirt1的表达及活性有关,为缺血性脑血管疾病的预防及临床治疗提供新的研究依据。
[1] Delmas D, Solary E, Latruffe N. Resveratrol, a phytochemical inducer of multiple cell death pathways: apoptosis, autophagy and mitotic catastrophe[J]. Curr Med Chem, 2011, 18: 1100- 1121.
[2] 郭倩, 余音, 潘乾广, 等. 白藜芦醇保护脑缺血/再灌注损伤与自噬关系的研究[J]. 中国药理学通报, 2013,29: 995- 998.
[3] 任俊伟,杨琴,范层层,等.白藜节醇保护脑缺血再灌注损伤及其机制[J].第三军医大学学报,2010, 32: 2586- 2590.
[4] Lee IH,Cao L,Mostoslavsky R,etal.A role for the NAD-dependent deacetylase Sirtl in the regulation of autophagy[J].Proc Natl Acad Sci U S A,2008,105:3374- 3379.
[5] Stünkel W, Campbell R M. Sirtuin 1 (SIRT1) The Misunderstood HDAC[J]. J Biomol Screen, 2011, 16: 1153- 1169.
[6] Wu Y, Li X, Zhu JX,etal. Resveratrol-activated AMPK/SIRT1/autophagy in cellular models of Parkinson’s disease[J]. Neurosignals, 2011, 19:163- 174.
[7] Longa E Z, Weinstein P R, Carlson S,etal. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20: 84- 91.
[8] 潘伟,刘世明. 自噬与心血管疾病[J]. 基础医学与临床,2013,04:492- 495.
[9] 毕娟娟, 何 林, 余 音, 等. 自噬在熊果酸诱导的人脐静脉内皮细胞损伤中的作用[J]. 中国病理生理杂志, 2012, 28: 601- 607.
[10] Su J, Zhang T, Wang K,etal. Autophagy activation contributes to the neuroprotection of remote Ischemic perconditioning against focal cerebral ischemia in rats[J]. Neurochem Res, 2014, 39:2068- 2077.
[11] Yan W, Zhang H, Bai X,etal. Autophagy activation is involved in neuroprotection induced by hyperbaric oxygen preconditioning against focal cerebral ischemia in rats[J]. Brain Res, 2011, 1402: 109- 121.
[12] Ramadori G, Lee CE, Bookout AL,etal. Brain SIRT1: anatomical distribution and regulation by energy availability[J]. J Neurosci, 2008, 28: 9989- 9996.
新闻点击
时差反应源自“体内分子制动”
据英国《BBC新闻》(BBC NEWS)2013年9月1日报道,英国牛津大学的研究人员认为,他们发现“倒时差”的发生是由于阻止人体在飞行时依靠光线调节体内生物钟而导致的“分子制动”。
发表在《细胞》期刊上的这项实验结果显示,如果在大鼠体内“打散”这些“分子制动”,实验鼠就能很快适应时差变化。研究人员希望,这个发现能有助于研发“倒时差”的新药,并能帮助一些神精疾病的治疗。
人体内的生物钟让人们与外界昼夜的变更保持一致,并直接影响到人体夜间的休息,饥饿感的产生,情绪和血压的变化。人们对于光线的反应就像是一个“重启按键”,让人体和外界的时间保持一致。但当人们从世界的一个地方飞往另一地方时,人体生物钟需要时间来重新调整,这就导致人体出现多日体虚状态,即“时差反应”。
研究人员把研究的重心放在脑部一区域的“主时钟”上。这个“主时钟”让机体其他地方随时与其“同步”,该区域被称为“视交叉上核”。他们针对那些由于光线变化而改变活动频率的DNA进行研究。他们发现,一群本来很活跃、并数量相当的基因,由于一种叫做“SIK1”的蛋白质的进入,他们全部再次进入休眠状态。如果对光线加以限制,这种蛋白质就能像“踩刹车”一样发挥作用。实验发现,如果降低这种蛋白质的功能,实验鼠就能迅速适应6 h的时差。
Resveratrol alleviates cerebral ischemia-reperfusion injury by promoting autophagy through Sirtuins1 pathway in rats
SHI Yao, GUO Qian, ZHOU Ye-han, WAN Dan, YE Xiu-feng*
(Dept. of Pathology, Institute of Neurosciences,Chongqing Medical University, Chongqing 400016, China)
Objective To observe the potential roles of autophagy induced by Resveratrol(Res) in rats model of focal cerebral ischemia-reperfusion(I/R)injury. Methods Rats were randomly divided into sham-operated group(S group), cerebral ischemia-reperfusion group (I/R group), low and high dose of Res pretreatment (15 and 40 mg/kg) group (R1 and R2 group); and R2 group were randomly sub-divided into R2+3-MA group and R2+Sirtinol group. The focal cerebral ischemia-reperfusiong (I/R) rat models were established by the middle cerebral artery occlusion (MCAO) using intraluminal suture method. Nissl’s staining was used to observe the pathological changes of brain tissue; 2, 3, 5-triphenyltetrazolium chloride (TTC) straining was used to observe infarct volume; real-time QPCR and Western blot assessments were performed to analyse the mRNA and protein expression of microtubule-associated protein light chain 3 (LC3) and mammalian sir2-related protein 1 (Sirt1), respectively. ResultsCompared with S group,I/R group showed obvious focal cerebral infarct, pathological damage change and autophagy related protein LC3 Ⅱ/LC3 Ⅰ, Sirt1 expression increased. Res pretreatment can significantly alleviate the pathological injury of rat cortical area, reduce the infarction volume (P<0.01) and increase the expression of LC3 Ⅱ/LC3 Ⅰ and Sirt1 (P<0.01); while the Sirt1 inhibitor and 3-MA can weaken the effect of Res. Conclusions Resveratrol enhances autophagy through activation of SIRT1 pathway and autophagy induction plays an important role in the neuroprotection of resveratrol in rats model of focal cerebral ischemia-reperfusion(I/R)injury.
cerebral ischemia/reperfusion injury; resveratrol; autophagy; sirtuins1
2014- 10- 13
2014- 12- 29
重庆市科技攻关计划项目(2008AB5118)
1001-6325(2015)04-0496-06
R741;R285.5;R-332
A
*通信作者(corresponding author):yxf1960@126.com
