孕妇外周血浆中艾杜糖-2-硫酸酯酶活性测定在黏多糖贮积症Ⅱ型无创产前诊断中的应用评价
2015-08-10姚凤霞张为民施惠平邱正庆孟岩黄尚志
姚凤霞,张为民*,施惠平,邱正庆,孟岩,黄尚志
(中国医学科学院 北京协和医学院 北京协和医院1.临床遗传学实验室,2.儿科,北京 100730;3.中国医学科学院 基础医学研究所医学遗传室,北京 100005)
黏多糖贮积症Ⅱ型(mucopolysaccharidosesⅡ,MPS Ⅱ,OMIM 309900),又称Hunter综合征,是一种罕见的X 连锁隐性遗传性溶酶体贮积症(lysosomal storage disorder,LSD)。1917年由加拿大的Hunter 医 生 首 先 报 道[1],国 外 统 计 发 病 率 为1∶100 000~1∶170 000 活产男婴,台湾地区为2.05∶100 000 活产男婴。据北京协和医院儿科遗传咨询门诊20多年来LSD 的研究发现,我国MPS(共7型)中约半数患者为MPS Ⅱ(未发表资料),而白种人则以黏多糖贮积症Ⅰ型(MPS I,Hurler综合征)为最常见。
MPS Ⅱ临床上分为重型和轻型,重型表现为进行性智力低下、骨骼异常、关节僵硬、面容丑陋等,多数患者15岁之前因呼吸道感染或心力衰竭而死亡;轻型临床表现轻,智力损伤较轻,一般可存活至成年,且有生育能力。目前报道重型的发生率高于轻型。MPS II是由于患者缺乏艾杜糖-2-硫酸酯酶(iduronate-2-sulphate sulphatase,IDS),造 成 糖 胺多糖(glycosaminoglycans,GAGs)不能降解,在各种组织尤其是结缔组织的溶酶体中贮积,导致多器官的进行性损坏。该病目前没有有效的治疗方法,所以产前诊断显得尤为重要。
目前,MPS II的产前诊断主要通过B超介导下经腹在孕早期(11~13周)或孕中期(16~20周)采集胎儿的绒毛组织或羊水进行酶学诊断。若绒毛、羊水上清和经培养羊水细胞中IDS 酶活性明显低于正常范围,且性别测定胎儿为男性,则为受累男性胎儿。前期产前诊断中发现,MPS II患者母亲再次妊娠时,外周血血浆中IDS 发生规律性变化,并与胎儿的基因型相关[2]。本研究在进行常规有创产前诊断的同时,对36例孕妇外周血血浆在孕前和不同孕周进行IDS酶活性测定,根据酶活性变化趋势推测胎儿是否受累,其结果与绒毛或经培养羊水细胞的IDS酶活性进行对比,初步探讨孕妇外周血血浆中酶活性变化的机理,确定无创产前诊断的可行性。
对象与方法
一、研究对象
本研究中36例孕妇为2010~2013年期间在北京协和医院产前诊断中心进行产前诊断的孕妇,在儿科遗传门诊与孕妇签署知情同意书。每例先证者皆从临床表现、尿甲苯胺蓝试验、IDS酶活性测定得到确诊,部分患者还进行了基因突变分析。
二、母亲孕前和孕中不同时期的新鲜外周血血浆中IDS酶活性测定
血浆标本检测时用去离子水稀释5倍后,每管取20μl测定酶活性,按文献[2]方法测定。每次酶活性测定时设平行的正常对照、阳性对照,并设β葡糖苷酸酶的平行对照,以确认蛋白制备物没有失活,保证方法的可靠性和标本的准确性。
三、胎儿绒毛组织或经培养羊水细胞的IDS酶活性测定
将绒毛组织或培养后的羊水细胞置冰浴中用超声粉碎仪破碎,制成细胞匀浆,按BCA 法测蛋白浓度。取20μl适度稀释的细胞匀浆按实验室常规方法测定酶活性,酶活性单位为nmol/4h·mg蛋白。每次酶活性测定时设平行的正常对照、阳性对照,并设β-半乳糖苷酶参考酶的平行对照,以确认蛋白制备物没有失活,保证方法的可靠性和标本的准确性。
四、胎儿性别鉴定和基因突变分析
为了确保胎儿标本的一致性,利用酶活性测定后的胎儿细胞匀浆直接提取DNA,进行分子诊断。使用X、Y 染色体的引物进行双重PCR 扩增,鉴定胎儿性别。引物序列为:
ZFXY:FAM-5’-ATTTGTTCTAAGTCGCCATATTCTCT-3’(X 与Y 染色体共有序列);
ZFX:5’-AGACACACTACTGAGCAAAATGTATA-3’(X 染色体特异的序列);
ZFY:5’-CATCAGCTGAAGCTTGTAGACACACT-3’(Y 染色体特异的序列)。
另外,对胎儿DNA 进行序列测定,检测先证者所具有的IDS基因突变(文章撰写中),从基因水平判定胎儿的基因型。
五、数据处理
使用SAS9.2统计软件进行分析。
将胎儿按产前诊断结果分为4组:男性不受累胎儿、女性非携带者胎儿、男性受累胎儿和女性携带者胎儿。每组的孕前、孕早期和孕中期孕妇外周血血浆IDS酶活性计算均值和标准差,并进行正态检验,绘制酶活性变化趋势图。同时,对4组不同孕周的酶活性值进行重复测量方差分析。
结 果
一、有创性胎儿组织/羊水检测结果
37例胎儿的绒毛组织或经培养后的羊水细胞分别测定了胎儿IDS 酶活性、胎儿性别鉴定,大部分胎儿进行了基因突变分析。37例胎儿产前诊断结果为:7例男性不受累胎儿、12例女性非携带者胎儿、7例男性受累胎儿、9例女性携带者胎儿和1例双胎(一男一女,不受累)。
二、母亲孕前和孕早、中期的新鲜外周血血浆IDS酶活性测定结果
36例孕妇收集到孕前、孕早期(孕12周)和孕中期(孕17周)的新鲜外周血浆,并测定了IDS酶活性。29例孕妇(包括1例双胎孕妇)外周血浆中IDS酶活性测定显示孕后较孕前升高,其余7例孕妇外周血浆中IDS酶活性值显示孕后较孕前有所下降(表1)。
除双胎外,按男性不受累、女性非携带者、男性受累和女性携带者4组胎儿将孕妇分组,分别对孕前、孕早期和孕中期孕妇外周血血浆IDS酶活性的均值绘制酶活性变化趋势图。
统计的差异检验显示当胎儿为男性不受累和女性非携带者时,这两组之间在不同孕周的IDS活性没有显著差异(P>0.05),故可以将此两种胎儿合并为正常胎儿;而当胎儿为男性受累或女性非携带者时,与其他组的孕妇外周血血浆IDS酶活性均存在显著性差异(P<0.05)(表2)。
孕妇血浆IDS酶活性趋势图显示,当胎儿为正常胎儿(男性非受累和女性非携带者)时,孕妇外周血血浆中IDS酶活性在孕早期就明显升高,且随着孕周的增加继续升高;当胎儿为女性携带者时,孕妇外周血血浆中IDS酶活性早期也升高,有随着孕周增加而升高的整体趋势,但升高的幅度较正常胎儿小;当为男性受累胎儿时,孕妇外周血血浆中IDS酶活性早期即显示低于孕前,且随着孕周的增加,酶活性继续降低(表2,图1)。
三、1例双胎孕妇的检测结果
1例双胎病例,孕前测定孕妇外周血血浆IDS酶活性为224.4nmol/4h·ml,孕12周时测定其外周血血浆IDS酶活性值为297.5nmol/4h·ml,酶活性比孕前有所升高。孕17周时经羊水穿刺,分别测定培养羊水细胞中IDS的酶活性、胎儿性别鉴定和胎儿IDS基因分析,得出双胎中一胎为男性不受累胎儿,另一胎为女性携带者。
讨 论
早在1984年有研究表明正常孕妇血浆中β-氨基己糖苷酶A、β-葡糖苷酸酶等多种溶酶体酶的酶活性升高,到妊娠末期可以升高到妊娠前的3~4倍[3]。最初认为这种增加可能是母亲本身因怀孕代谢状态变化导致的。有研究发现黏脂贮积症Ⅱ型(mucolipidosisⅡ)杂合子孕妇当胎儿为患者时,母亲外周血血浆中β-hexosaminidase活性异常升高,认为该水解酶可分泌入包括羊水在内的各种细胞外液中,胎儿和母亲进行物质交换致母血血浆中酶异常升高[4]。由于IDS同样属于溶酶体水解酶,在常规酶活性测定中,患者外周血血浆和白细胞内的IDS酶活性,均可检测到明显低于正常范围。

表1 36例孕妇IDS酶活性变化及产前诊断结果
表2 不同妊娠结局的孕妇血浆IDS酶活性的变动(±s)

表2 不同妊娠结局的孕妇血浆IDS酶活性的变动(±s)
注:与男性不受累或女性非携带者同期比较,*P<0.05;与女性携带者同期比较,#P<0.05;各组自身不同孕期之间比较,※P<0.05
孕妇血浆IDS酶活性(nmol/4h·ml)胎儿表型 例数孕前 孕12周 孕17周男性不受累 7 283.4±81.6※ 470.5± 89.4※ 507.9± 81.0※男性受累 7 160.5±47.5*# 145.8± 36.8*# 144.9± 45.8*#女性非携带者 12 306.0±85.5※ 455.8±129.4※ 513.3±157.6※女性携带者 9 214.9±74.8*※ 327.6±133.4*※ 375.3±120.4*※
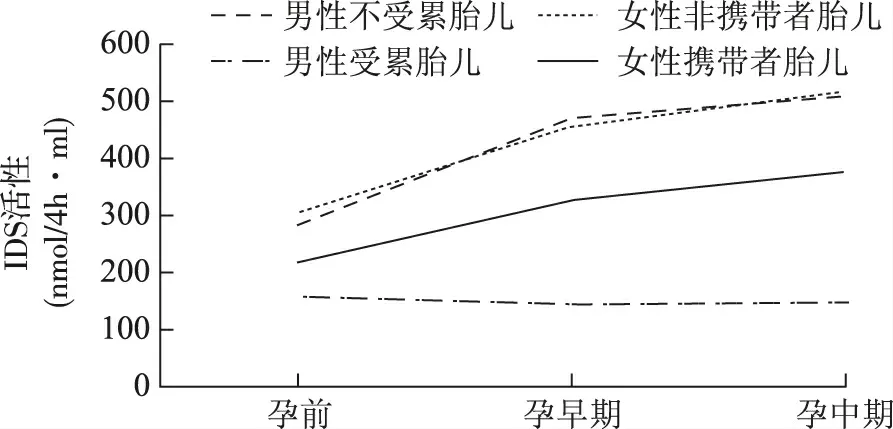
图1 35例单胎妊娠孕妇孕前、孕早期和孕中期外周血IDS酶活性趋势图
本研究入组的36名孕妇的孕前外周血血浆的IDS活性值多数趋近于血浆正常范围的低线,该正常参考范围(240.8~668.2nmol/4h·ml)是本实验室从大量无关个体中建立的。孕妇的孕前IDS酶活性值偏低可以间接提示其为携带者,早年有研究已证明MPS II携带者血浆中IDS活性比非携带者女性低[5]。
除1例双胎孕妇外,其余35例单胎孕妇外周血血浆中孕前和孕中不同时期IDS 酶活性变化经严格的统计学检验后,男性不受累和女性非携带者胎儿(无突变正常胎儿)无统计学差异外,无突变正常胎儿与女性携带者胎儿、男性受累胎儿两两之间均存在显著差异。当胎儿为正常胎儿时,孕妇外周血血浆中IDS酶活性在孕早期就明显升高,且随着孕周的增加继续升高;当胎儿为女性携带者时,孕妇外周血血浆IDS酶活性早期虽也升高,其升高的幅度较正常胎儿小,但整体趋势也为随着孕周增加而升高;当为男性受累胎儿时,孕妇外周血血浆中IDS酶活性早期即显示酶活性低于孕前,且随着孕周的增加,酶活性继续降低。
在研究过程中发现(数据未显示),孕育正常胎儿的孕妇,最早在孕8周时就测得外周血浆IDS酶活性已比孕前有所升高,该结果显示通过孕妇外周血血浆IDS 酶活性测定可比有创的产前诊断(孕11~12周)提前3~4 周获得胎儿的表型信息。同时,我们每间隔两周测定孕妇新鲜外周血血浆IDS酶活性变化,结果显示两周时间可以得到活性变化趋势,为将来在实际工作中运用孕妇外周血酶活性测定提供了依据。当然,本研究只是从不足40例孕妇中获得的结果,在将来应用到临床产前诊断还需要通过更多的病例验证,得到更完善的信息。
IDS酶活性变化机制还不清楚,以上实验数据提示可能与mucolipidosis Ⅱ相似。推测孕妇外周血中IDS 的变化除母亲本身酶的量随孕期的改变外,可能是正常胎儿来源的大量IDS转运到母亲血液中,导致孕妇外周血中的酶活性更进一步升高;而母亲血浆中IDS酶活性降低,则可能是相反的转运途径,是母亲的IDS进入胎儿代偿胎儿的缺陷。已经明确母血中某些胎儿特有的蛋白,如α甲胎蛋白从胎儿的羊水转移到母血中,故可以通过母血检测胎儿发育情况。另外,我们也从多年的实践中,观察到羊水中IDS的正常浓度范围相对较高,进一步支持以上推理。另一个可能的转运途径,母血中IDS可能还来源于胎膜(绒毛膜和羊膜)本身。研究发现负责母亲与胎儿之间物质交换的酶多数为高度唾液酸化的[4]。MPS Ⅱ中,IDS胎儿来源的物质进入母亲体内唾液酸化(sialylation)作用机理目前仍不清楚。这种唾液酸化可使胎儿来源的IDS 不能被母亲体内细胞(如肝细胞)重新摄取而降解,故在血液循环中不丢失而持续升高。
本研究中一例异卵双胎妊娠的孕妇,在孕前和孕早期测定IDS酶活性,显示有所增加,胎儿性别和培养羊水细胞酶活性测定结果显示,一个胎儿为非受累男胎,另一胎为携带者女胎。对于双胎孕妇,由于影响因素较多,通过孕妇外周血血浆IDS酶活性测定暂时无法对胎儿状况作出判断。
目前,MPS II的产前诊断主要通过B 超介导下经腹 在 孕 早 期(11~13 周)或 孕 中 期(16~20周)采集胎儿的绒毛组织或羊水进行酶学诊断。若绒毛、羊水上清和培养羊水细胞中IDS酶活性明显低于正常范围,且经性别测定为男性,则判断为受累男性胎儿。产前诊断是一种有创的诊断,且最早取材时期为孕11 周左右。随着高通量测序技术的飞速发展,目前通过孕妇外周血游离DNA 进行胎儿无创性产前诊断也随之有了进展,受技术和经济条件的限制,目前高通量技术在临床上主要用于染色体非整倍体(主要是21、18、13、X 和Y 染 色 体)的 拷 贝 数 异 常 检 测[6-9],但 对 于 单基因遗传病的无创产前诊断,目前研究主要是通过单体型连锁分析,经验相对少。在孕期胎儿与母亲之间通过胎盘屏障进行物质交换,IDS酶可以穿过细胞膜进入母亲外周血循环,本研究发现孕妇外周血血浆中IDS 酶活性随着孕周增加而变化,并通过35 例产前有创诊断,确定这种变化趋势与胎儿的性别和基因型密切相关,凡IDS酶活性逐渐下降的妊娠胎儿是男性受累胎儿,凡上升的则为获得母源正常等位基因或获得致病突变基因的女性携带者,可以继续妊娠。这可以作为无创性产前诊断的一种途径,对将来其他酶代谢相
关遗传疾病的无创产前诊断有一定启示作用。
[1] Hunter C.A rare disease in two brothers[J].Proc R Soc Med,1917,10(Sect Study Dis Child):104-116.
[2] 张为民,施惠平,李贝特,等.黏多糖贮积症Ⅱ型的诊断与产前诊断[J].中华儿科杂志,2006,44:644-647.
[3] Lombardo A,Goi G,Pistolesi E,et al.Behaviour of several enzymes of lysosomal origin in human plasma during pregnancy[J].Clin Chim Acta,1984,143:253-264.
[4] Hug G,Bove KE,Souku PS,et al.Increased serum hexosaminidase in a woman pregnant with a fetus affected with mucolipidosis II(I-cell disease)[J].N Engl J Med,1984,311:988-989.
[5] Zlotogora J,Bach G.Hunter syndrome:Prenatal diagnosis in matenal serum[J].Am J Hum Genet,1986,38:253-260.
[6] Bianchi DW,Platt LD,Goldberg JD,et al.Genome-wide fetal aneuploidy detection by maternal plasma DNA sequencing[J].Obstet Gynecol,2012,119:890-901.
[7] Sparks AB,Struble CA,Wang ET,et al.Noninvasive prenatal detection and selective analysis of cell free DNA obtained from malernal blood:evaluation for trisomy 2 1and trisomy 18[J].Am I Obstet Gynecol,2012,206:319,e1-9.
[8] Ashoor G,Syngelaki A,Wagner M.et al.Chromosome selective sequencing of maternal plasma cell-free DNA for first trimester detection of trisomy 2land trisomy 18[J].Am J Obstet Gynecol,2012,206:322,e1-5.
[9] Chiu RW,Akolekar R,Zheng YW,et al.Non-invasive prenatal assessment of trisomy 21by multiplexed maternal plasma DNA sequencing:large scale validity study[J].BMJ,2011,342:c7401.
