分化型甲状腺癌术后促甲状腺素抑制治疗的艺术
2015-08-10北京大学第一医院内分泌科王薇
北京大学第一医院内分泌科 王薇

王薇 北京大学医学博士,现任北京大学第一医院内分泌科副主任医师。中华医学会糖尿病学分会微血管并发症学组委员。 长期从事内分泌疾病的临床和科研工作,擅长糖尿病、甲状腺疾病和肾上腺疾病的诊治。主要研究方向为脂代谢与糖尿病肾病的发病机制。
引 言
甲状腺癌的患病率近几年在全球呈现增高的趋势。美国癌症学会(Am erican cancer society,ACS)发布的报告表明,在2001~2013年间,甲状腺癌的发病率上升了209%[1]。目前,国内研究尚缺乏全国性、长期、系统的资料,大多数研究未关注甲状腺癌组织学类型、肿瘤大小、生物学特征等。但国内地区性的甲状腺癌的流行病学研究显示,甲状腺癌在我国已成为患病率上升速度最快的恶性肿瘤之一。从多个沿海大城市的调查情况来看,女性甲状腺癌发病率在所有恶性肿瘤中排第1至8位,已进入我国最常见的恶性肿瘤行列。上海市区头颈恶性肿瘤流行病学分析[2]显示,2005~2009年间甲状腺癌的发病人数增长近一倍。2012年中国卫生部统计报告,甲状腺癌上升至女性恶性肿瘤第3位。
有学者认为,甲状腺癌患病率的迅速提高是检出率提高所致。很多文献认为,诊断技术的提高被认为是检出率增高的首要原因,甲状腺癌的发病率增长可能与医学诊断技术的发展、检查技术敏感性提高有关[3]。而且,超声影像的分辨率不断提升,能够发现临床没有症状的甲状腺癌。此外,电离辐射及碘的摄入量变化都是比较公认的影响甲状腺癌发病的因素。电离辐射暴露史是公认的甲状腺癌发病的危险因素,如日本原子弹爆炸核辐射地区、前苏联切尔诺贝利核泄漏污染区居民中甲状腺癌发病率明显增高。随着CT、X线等影像技术的广泛应用,使得患者电离辐射的暴露几率增加,可能也是影响甲状腺癌患病率的因素之一。而碘摄入量变化对甲状腺癌同样存在一定影响。当碘营养水平较低时,低分化甲状腺癌比例较高,而碘摄入的增加则更多发生的是分化良好的乳头状癌。
虽然甲状腺癌的患病率明显升高,但是其死亡率几十年来并未见明显变化[4,5]。在分化型甲状腺癌中低危患者比重最大,且增加的趋势也最明显。对分化型甲状腺癌生存时间和复发情况进行研究发现,分化型甲状腺癌生存时间长,20年生存率达97%,30年生存率达95%;但复发率不低,可达30%,复发时间多发生在术后5年内,最长可发生在术后35年。因此,对于甲状腺癌的治疗,预防其复发是重要的治疗策略。分化型甲状腺癌的治疗方法主要包括手术治疗、术后131I治疗、促甲状腺素(thyroid stim ulating horm one,TSH)抑制治疗。目前主张对分化型甲状腺癌的患者进行个体化的综合治疗。分化型甲状腺癌术后的TSH抑制治疗是指手术后应用甲状腺激素将TSH抑制在正常低限或低于正常值、甚至检测不到的程度,一方面补充甲状腺癌患者术后所缺乏的甲状腺激素,另一方面抑制分化型甲状腺癌细胞生长[6]。分化型甲状腺癌术后TSH抑制治疗虽然可以明显地减少复发的几率,但是也带来了患者心脏及骨质疏松等疾病风险的增加。可以说,如何确定及调整患者最佳的TSH抑制的目标值,是医学实践中的一门艺术。
甲状腺癌术后进行TSH抑制治疗的机制
从病理细胞来源上看,甲状腺癌包括滤泡上皮细胞、滤泡旁细胞及淋巴系细胞三类。滤泡上皮细胞来源的甲状腺癌又分为分化型甲状腺癌(包括乳头状癌和滤泡状癌)及未分化型甲状腺癌。
研究发现,分化型甲状腺癌细胞表面存在TSH受体,TSH与TSH受体结合,通过cAMP信号通路调节甲状腺特异基因[甲状腺球蛋白(thyrog lobu lin,Tg)、甲状腺过氧化物酶(thyroid peroxidase,TPO)及钠碘转运酶(Na+/I-sym porter,NIs)等]的表达,来调节细胞的增生分化[6]。降低血清TSH水平,可以达到抑制残余甲状腺癌组织的生长。目前,服用超生理剂量的外源性甲状腺激素,可以达到抑制垂体分泌TSH的作用。TSH抑制治疗的用药首选左旋甲状腺素口服制剂,甲状腺片中甲状腺激素的剂量及T3/T4的比例不稳定,可能带来TSH波动,因此不建议在长期抑制治疗中作为首选。
TSH抑制治疗的疗效评价
多高的TSH水平是最理想的,不仅可达到减少肿瘤复发,还可以提高生存率。1996年一项回顾研究[7]发现,保持长期TSH高度抑制(≤0.1m IU/L)较非TSH抑制(1m IU/L)者,甲状腺癌的复发率更低(P<0.01)。1998年,国际甲状腺癌治疗合作研究组织(NTCCSG)第一次提出,从控制疾病进展角度看,高危(Ⅲ期和Ⅳ期)患者TSH需抑制到<0.1m IU/L[8]。当血清TSH<0.1m IU/L时,垂体TSH对促甲状腺素释放激素(thyrotropin-releasing horm one,TRH)刺激完全不起反应,达到TSH完全被抑制状态。TSH抑制水平与分化型甲状腺癌复发转移和癌肿相关死亡的关系密切。当TSH抑制到<0.1m IU/L时,与正常TSH相比较,分化型甲状腺癌的复发、转移显著降低[9]。现有的研究发现,TSH抑制疗法的疗效不仅与血清TSH抑制水平有关,也与分化型甲状腺癌的危险分级有关。对于低危患者,当TSH完全被抑制时,复发和生存等方面效益并不显著增加[10]。
对于分化型甲状腺癌患者,TSH抑制治疗是否达到目标疗效,重要的评价指标是甲状腺功能,包括甲状腺激素水平(T3、T4)以及TSH。血清TSH测定方法经历了4个阶段的发展,第一代TSH测定,灵敏度较差,为1IU/L,不能满足TSH抑制治疗的监测需求。第二代TSH测定以免疫放射法为代表,称为敏感TSH,灵敏度0.1m IU/L。第三代、第四代TSH测定方法为超敏感TSH测定方法,灵敏度可以达到0.01~0.001m IU/L。在TSH抑制治疗的患者中建议选择三代以上的TSH测定方法,为实施TSH抑制治疗在检测方面提供可行性保障。
根据患者肿瘤复发危险度和TSH抑制治疗的不良反应风险,达到个体化的TSH控制目标(本文后续内容会详细阐述),使TSH处于偏低水平以抑制甲状腺癌的复发。同时,使患者的甲状腺激素水平(T3、T4)维持在正常范围,达到一个亚临床甲亢的水平。为使甲状腺激素对心脏、骨质疏松等不良反应相对较小,应避免使患者的甲状腺功能处于临床甲亢的水平。对于存在影响甲状腺结合球蛋白水平的疾病或因素(比如低蛋白血症、妊娠等)时,要同时测定游离T3、游离T4,以便准确地了解甲状腺功能的状态。甲状腺激素的需要量会受多种因素的影响而发生变化,对于甲状腺存在且功能正常者来说,机体通过调节垂体TSH分泌,自行调整甲状腺激素水平,按需分泌。但分化型甲状腺癌患者的TSH抑制治疗,不能进行自动调节,需要根据监测甲状腺功能结果进行药物调整。在冬季机体对甲状腺激素的需求量常常增加,夏季时甲状腺激素需求量减少。另外,患者在长达几十年的随诊治疗期间,分化型甲状腺癌的情况、患者自身的情况(年龄变化,绝经等)、合并症的情况会出现很多变化,都需要调整TSH的控制目标及药物剂量。
分化型甲状腺癌进行TSH抑制治疗的患者,在随访时除监测甲状腺功能外,还需监测甲状腺球蛋白水平和甲状腺影像学检查。
TSH抑制治疗的不良反应评价
在甲状腺癌患者的TSH抑制治疗中,给予充足的左甲状腺素钠,使TSH水平抑制在低于正常水平,也就是达到亚临床甲亢的状态。这种非生理状态对身体会产生一些不良反应,因而在TSH抑制治疗的患者中,需要密切关注这些不良反应。
研究发现,TSH抑制疗法的不良反应与TSH的抑制水平,TSH受抑制的持续时间、患者年龄以及患者的基础疾病等因素相关。TSH抑制治疗的常见不良反应主要包括对患者心脏、骨骼等的影响,正确认识及监测这些不良反应,能够使TSH抑制治疗更加安全有效。
TSH长期抑制治疗会增加骨质疏松的发生,并可能导致患者骨折风险增加。因此,对于拟行TSH抑制治疗的患者,治疗前需要进行骨密度的测定,以及血、尿钙磷水平和骨转化指标的检测,并进行定期监测。而对于患分化型甲状腺癌的绝经后妇女,拟进行TSH抑制治疗者,建议接受骨质疏松的预防治疗,补充钙剂和维生素D。对于已经达到骨质疏松诊断标准的患者进行TSH抑制治疗,则需要在补充钙剂和维生素D的基础上联合其他骨质疏松的治疗药物。
长期使用超生理剂量甲状腺激素,形成亚临床甲亢。特别是TSH需长期维持在很低水平(<0.1m IU/L)时,可能影响分化型甲状腺癌患者的心血管病相关事件和死亡风险增高。超生理剂量的甲状腺激素,对心脏的不利影响主要包括加重心脏负荷和心肌缺血,引发或加重心律失常,引起静息性心动过速、心肌重量增加、平均动脉压增大、舒张和(或)收缩功能失调等。减少甲状腺素剂量后则上述诸多受损情况可逆转。对需要进行TSH抑制治疗的分化型甲状腺癌患者,治疗前需要评估基础心脏情况;定期监测心电图,有症状的患者或者心脏疾病高危患者需要进行动态心电图和超声心动图检查;定期进行血压、血糖和血脂水平监测。必要时可测定颈动脉内膜中层厚度来协助评估动脉粥样硬化的危险性。对于TSH抑制治疗的患者,为减轻对心脏的不良反应,如无β受体阻滞剂禁忌证,应考虑给予该类药物。文献报道,使用β受体阻滞剂3~4个月后.外源性亚临床甲亢带来的心脏舒张功能和运动耐力受损可以得到显著改善,并能改善心血管事件(尤其是心房颤动)的相关死亡率。对于有心脏基础疾病或心血管事件的高危因素患者,应规范使用心血管药物治疗,并适当放宽TSH抑制治疗的目标。不同TSH的抑制水平,对心脏的影响程度也有差异。
有文献报道,对不同甲状腺功能状态的60岁以上老年人观察房颤发生率随访10年的研究[11]发现,血清TSH≤0.1m IU/L的亚临床甲亢的患者房颤累积发生率为28/1000患者年,甲状腺功能正常者(TSH 0.4~5m IU/L)房颤累积发生率为11/1000患者年。TSH明显降低的老年人发生房颤的相对风险是TSH正常者的3.1倍(95%CI 1.7~5.5,P<0.001),而TSH轻度降低(0.1~0.4 m IU/L)或者升高(TSH>5m IU/L)的患者与TSH正常者相比,房颤的10年发生率没有显著差异。
TSH受抑制对心脏事件及全因死亡的影响,不但与TSH的降低水平相关,还与持续时间有关。有文献[12]报道,70岁妇女诊断亚临床甲亢后2年、5年和10年死亡率分别多增加1.5%、4.0%和8.7%,男性患者分别增加2.3%、5.7%和10.7%。由此可见,TSH抑制水平越低、持续时间越长,发生心脏不良事件的风险越大。
既然TSH抑制治疗可能发生的不良反应与TSH的抑制水平以及TSH受抑制的持续时间相关,因此,对于分化型甲状腺癌的患者要进行个体化的TSH抑制治疗。对不同的患者,采取不同的TSH抑制程度就显得非常必要。基于这种个体化管理的策略,2012年发表的我国《甲状腺结节及分化型甲状腺癌指南》[14]建议,给予分化型甲状腺癌的患者双风险评估设定个体化的TSH控制目标(具体目标值详见下文)。以减少TSH长期受抑制所产生的不良反应。有文献报道,双风险评估不仅能显著降低分化型甲状腺癌复发率和转移率,还能明显减少外源性亚临床甲状腺功能亢进导致的心血管疾病及其他疾病相关事件的门诊就诊率、住院率[13]。该研究中将患者分为两组:①A组(304例):未进行双风险评估直接行术后TSH抑制治疗;②B组(252例):按照分化型甲状腺癌的复发危险度分层条件和TSH抑制治疗的不良反应风险分层条件进行风险评估,按照双风险评估的结果制定DTC术后TSH抑制治疗目标。结果A组患者3年内的无复发和转移率为96.8%;B组患者3年内的无复发和转移率为99.2%。B组3年无复发和转移率明显高于A组(P=0.044)。B组患者的心血管及其他疾病相关事件的住院率较A组患者降低了89%。
由此可见,根据双风险评估,即分化型甲状腺癌患者的肿瘤复发危险度和TSH抑制治疗的不良反应风险,制定个体化的TSH抑制目标,以减少TSH抑制治疗的不良反应。
TSH的控制目标
近年来,TSH抑制治疗的理念发生了转变,摒弃单一标准,制定个体化治疗目标。针对分化型甲状腺癌复发转移的危险程度及TSH抑制治疗的不良反应风险制定的TSH抑制的目标,不同地区、不同的指南也不完全相同。
在中国2012年发表的 《甲状腺结节及分化型甲状腺癌指南》中[14],将患者的甲状腺癌及基础疾病进行综合评估,甲状腺癌复发危险度分层见表1,将患者分为低危、中危、高危三组;TSH抑制治疗不良反应风险分层见表2,同样也分为低危、中危、高危三组。不同组别,TSH抑制治疗的目标有所差异。在术后1年之内的治疗初期,与之后的随访期相比,TSH抑制治疗的目标在各组都相对更加严格,详见表3。TSH抑制治疗的目标经历了一个从单纯强调减少肿瘤复发风险,到根据双风险评估制定个体化抑制目标的漫长过程,更好地向“以患者为中心”的疾病管理模式转化。

表1 肿瘤复发危险度分层

表2 TSH抑制治疗不良反应风险分层
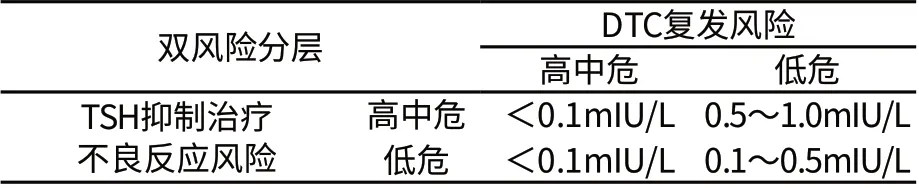
表3a TSH抑制治疗初治期(术后1年)

表3b TSH抑制治疗随访期
小 结
TSH抑制治疗分化型甲状腺癌,对不同的患者采取不同的TSH抑制标准十分必要。通过个体化的TSH抑制治疗,达到在减少肿瘤复发、转移、降低癌肿相关死亡的同时,也尽量避免和减少由于TSH长期抑制带来的亚临床甲状腺功能亢进状态导致的不良反应。但是这种个体化管理,对临床工作实施带来了更大的挑战,需要医生全面深入地理解和掌握TSH抑制治疗的策略。
[1] Soda JA, Hanna JW, Robinson KA, et al. Increases in thyroid nodu le fine-need le aspirations, operations, and diagnoses of thyroid cancer in the United States[J]. Su rgery, 2013, 154(6): 1420-1427.
[2] 吴云腾,任国欣,李朝军,等.上海市区近5年头颈恶性肿瘤流行病谱变迁及分析[J].口腔颌面外科杂志, 2014, 24(3): 192-194.
[3] Davies L, Welch HG.Increasing incidence o f thyroid cancer in the United States, 1973-2002[J].JAMA, 2006, 295: 2164-2167.
[4] Silverberg E.Cancer statistics, 1980[J].CA Cancer J Clin, 1980, 30: 23-38.
[5] Jem al A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60: 277-300.
[6] Brabant G. Thyrotropin suppressive therapy in thyroid carcinom a: what are the targets? [J]. J Clin Endocrino l Metab, 2008, 93: 1167-1169.
[7] Pujo l P, Daures JP, Nsakala N, et al. Degree of thyrotropin supp ression as p rognostic determ inant in differentiated thyroid cancer[J]. J Clin Endocrino l Metab, 1996, 81: 4318-4323.
[8] Cooper DS, Specker B, Ho M, et al. Thyro trop in supp ression and disease progression in patients w ith differentiated thyroid cancer: results from the National Thyroid Cancer Treatm ent Cooperative Registry[J].Thyroid, 1998, 8: 737-744.
[9] Hovens GC, Stokkel MP, Kievit J, et al. Associations o f serum thyrotropin concentrations w ith recurrence and death in differentiated thyroid cancer[J]. J Clin Endocrino l Metab, 2007, 92(7): 2610-2615.
[10] Cooper DS, Specker B, Ho M, et al. Thyro trop in supp ression and disease progression in patients w ith differentiated thyroid cancer: results from the National Thyroid Cancer Treatm ent Cooperative Registry[J].Thyroid, 1998, 8: 737-744.
[11] Saw in CT, Ge lle r A, Wo lf PA, et al. Low se rum thyro trop in concentrations as a risk factor for atrial fibrillation in older persons[J]. N Eng l J Med, 1994, 331: 1249-1252.
[12] Haentjens P, Van Meerhaeghe A, Poppe K, et al. Subclinical thyroid dysfunction and m ortality: an estim ate of relative and absolute excess all-cause m ortality based on tim e-to-event data from cohort studies[J]. Eu r J Endocrino l, 2008,159(3): 329-341.
[13] 王松,张方洁,代文杰,等.分化型甲状腺癌术后的TSH抑制治疗[J].中华普通外科杂志, 2014, 29(4): 295-298.
[14] 滕卫平,刘永锋,高明,等.甲状腺结节和分化型甲状腺癌诊治指南[J].中华内分泌代谢杂志, 2012, 28(10): 779-797.