表面增强拉曼光谱法快速分析中药三七的有效成分
2015-08-08卫程华陈娟许曼翎戚雪勇
卫程华,陈娟,许曼翎,戚雪勇
(江苏大学药学院,江苏镇江212013)
表面增强拉曼光谱法快速分析中药三七的有效成分
卫程华,陈娟,许曼翎,戚雪勇
(江苏大学药学院,江苏镇江212013)
目的:建立表面增强拉曼光谱(surface enhanced Raman spectroscopy,SERS)法快速分析中药三七中的有效成分。方法:对三七药材进行简单的预处理,分别测试三七药材粉末、三七水提和醇提样品的表面增强拉曼光谱;再结合薄层色谱分离技术,测试三七醇提取样品中单一有效成分的表面增强拉曼光谱,并对所获得的图谱进行解析。结果:直接测试三七药材粉末、三七水提和醇提样品的表面增强拉曼光谱有微弱信号;三七醇提取样品经过TLC技术分离后的单一组分可获得较理想的表面增强拉曼光谱。结论:建立的快速分析三七有效成分的表面拉曼光谱法具有简便,快速,专属性好,灵敏度高等特点,可拓展到其他中药材的质量控制和分析鉴定中。
表面增强拉曼光谱;三七;快速分析
三七[Panax notoginseng(Burk)F.H.Chen],属五加科人参属多年生草本植物,为我国特有的名贵中药材,分布在我国云南、广西、江西、四川等地,主要药用部位是其根部,具有散瘀止血,消肿定痛之功效[1]。三七成分复杂,主要药用成分为人参皂苷[2]。现在常用来分析三七的方法有薄层色谱法(TLC)[3]、高效液相色谱法(HPLC)[4]、核磁共振-质谱联用法(NMR-MS)[5]、超高效液相色谱法(UPLC)[6-7]等。
拉曼光谱(Raman spectra)是一种散射光谱,相对于常规分析方法,具有样品前处理简单、操作快速简便、绿色环保等优点,近年来在食品[8-10]、生物[11-12]、医药[13-14]等分析领域发展迅速。表面增强拉曼光谱(surface enhanced Raman spectroscopy,SERS)具有增强振动信号、低检测限以及良好的吸附选择性,因此在众多领域的应用分析上具有良好的发展潜力[15-16]。中药三七成分复杂,常规的拉曼光谱直接测试效果不佳,荧光干扰较强。本研究建立了利用便携式拉曼光谱仪快速测试三七中有效成分信号的表面增强拉曼光谱分析法,从而实现对三七药材的快速分析。
1 材料与方法
1.1 仪器与测试条件
仪器:EZRamam-M便携式拉曼光谱仪(EnWave Optronics公司);Tecnai-12透射电子显微镜(飞利浦公司);UV-2401PC紫外可见光分光光度计(日本岛津公司);BI-9000高浓度激光粒度分布仪(美国布鲁克海文仪器公司);SZCL-2数显智能控温磁力搅拌器(杭州瑞佳精密科学仪器有限公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司);80-2离心沉淀器(金坛市医疗仪器厂);电子天平(赛多利斯科学仪器有限公司)。
拉曼测试条件:光谱测量范围0~3 000 cm-1,CCD检测器,光谱分辨率1 cm-1,积分时间30 s,平均积分2次。采用785 nm半导体激光作为激发光源,激光功率为500 mW。
1.2 药材与试剂
药材:20头三七,产于云南,购于镇江市存仁堂大药房(安徽亳州市药材总公司,批号:20130618),经药学院傅海珍老师鉴定为道地药材。
试剂:硝酸银(分析纯,上海试剂一厂);柠檬酸三钠(分析纯,国药集团化学试剂有限公司);硅胶G薄层板(青岛海洋化工);甲醇、硫酸、三氯甲烷、乙酸乙酯、罗丹明B(分析纯,国药集团化学试剂有限公司);实验用水均为实验室自制双蒸水。
1.3 样品处理
三七粉末:取原药材,洗净烘干(60℃)后切片,捣碎研磨,过200目筛即可。
三七水提样品:称取烘干后的三七药材切片5 g,于烧杯中加水500 mL,浸泡30min,煎煮1 h后,两层纱布过滤,取滤液。将滤液浓缩至100 mL后离心,取上清液于4℃冰箱内保存备用。
三七醇提样品:取三七粉末5 g于具塞锥形瓶中,加甲醇50 mL浸润,超声1 h后,静置,取上清液于4℃冰箱内保存备用。
1.4 银胶溶液的制备
参考Lee等[17]的方法,以柠檬酸三钠还原硝酸银制备银纳米粒子。将100 mL硝酸银溶液(0.002 2 mol/L)于智能控温磁力搅拌器上搅拌(1 000 r/ min)加热到90℃,再逐滴加入2.6 mL柠檬酸三钠溶液(0.039 mol/L),90℃恒温搅拌1 h至溶液呈黄绿色。
1.5 拉曼扫描方法
三七粉末样品:取少许三七粉末样品于固体检测架上,滴加适量银胶溶液,待其成糊状后刮平测试表面,进行拉曼扫描。
三七水提/醇提取液样品:取1 mL三七提取液(水/醇提取)于透明样品瓶中,滴加等体积的银胶溶液,摇匀,10 min后进行拉曼扫描。
三七醇提样品TLC-SERS扫描:以三氯甲烷:乙酸乙酯:甲醇:水=15∶40∶22∶10下层溶液为展开剂,点样5μL,平行点数样。待展距约为10 cm时取出薄层板,晾干。在距板面垂直10 cm左右,喷以10%稀硫酸溶液,晾干,置烘箱中(105℃)烘干至出现紫红色斑点后取出,于每个斑点处滴加1滴银胶溶液,迅速利用刮刀搜集紫色斑点处的硅胶粉末,平行斑点合并为一种样品,分别获得样品A、B、C。如图1所示。

图1 TLC-SERS采样示意图
1.6 数据处理
实验获得的拉曼光谱图均采用OriginLab公司出品的Origin 8.5软件绘制,使用FFT-Filter平滑处理方式,平滑点数为5。
2 结果与讨论
2.1 银溶胶的表征
由于中药材三七以及其提取物成分复杂、活性成分含量低等原因,银胶溶液的质量很可能对测试效果具有一定的影响,故本实验对银纳米粒子的形态、大小、粒径分布进行了初步表征,并以罗丹明B为探针分子,检测了自制银胶的增强效果及其最低作用浓度。
2.1.1 紫外吸收光谱 图2为柠檬酸三钠还原硝酸银制备了表面增强基底材料银溶胶的紫外吸收光谱图,全波长扫描范围为200~800 nm。

图2 银胶紫外吸收光谱
银胶的紫外吸收光谱反映了纳米粒子表面等离子体共振吸收的谱峰和强度,它们与纳米粒子的形状、浓度、粒径分布以及粒径大小有关。谱峰的最大吸收位置可用来粗略表征银粒子的粒径,谱峰的波长越大,相应的粒子半径也越大;而谱峰的个数反映纳米粒子的形状,一般球形粒子只有1个吸收峰[18]。由图2可知,在428 nm处有最大吸收,且为单峰,可初步判断本实验制备的银纳米粒子为类球形粒子。
2.1.2 透射电镜及粒径分布 将自制银溶胶经预处理后于透射电子显微镜中检视得到透射电镜图(图3),可观察到球形银纳米颗粒,粒径在100 nm左右。图4为银纳米粒子的粒径分布图,结果显示本实验自制银胶纳米粒子粒径呈正态分布,平均粒径为102.9 nm,分散性良好。

图3 银纳米粒子电镜图

图4 银纳米粒子粒径分布图
2.1.3 银纳米粒子的增强效果 以0.000 1 g/mL的罗丹明B为探针分子检测银胶溶液的增强效果,结果见图5a,同一质量浓度的罗丹明B与不同存放时间的银胶所获得的SERS图谱有明显不同,新制银胶与存放24 h后的银胶相比峰信号较强,图谱更丰富,而存放48 h后的银溶胶几乎不具有增敏作用,银胶存放时间久可能有沉降和聚集,影响增敏效果,所以本实验中增敏材料均采用新制银胶;另外,0.000 1 g/mL罗丹明B的常规拉曼光谱如图5a中的d光谱所示,未见明显的拉曼信号,而滴加了新制银胶的罗丹明B拉曼信号较好,峰谱信息丰富,特征峰明显,由此证明,本实验自制的银胶具有良好的拉曼信号增敏作用。
为考察本实验自制银胶增敏效果的灵敏度,分别配制质量浓度为0.000 5,0.000 2,0.000 1,0.000 08、0.000 05和0.000 01 g/mL罗丹明B溶液,分别滴加等体积的新制银胶后测试不同质量浓度罗丹明B的SERS,如图5b。结果显示,浓度低至0.000 05 g/mL的罗丹明B在增敏材料的作用下亦可出现较理想的拉曼信号,当浓度为0.000 01 g/mL时,即使在添加了增敏材料的情况下也未能观察到有效的拉曼信号。由此可推测,在本实验中所制备银溶胶的作用下,可检测到质量浓度为0.000 05 g/ mL的单一化学物质。
2.2 三七的SERS图谱及解析
2.2.1 三七样品的拉曼光谱 三七粉末样品的常规拉曼以及SERS测试图谱如图6,三七粉末样品直接测试其常规拉曼光谱得到一个“荧光包”,并未获得拉曼信号,这可能与中药材成分复杂、荧光强等因素有关;滴加了新制银溶胶的三七粉末样品,测试了其样品的多个位置,验证得出该图谱稳定,特征峰位置固定,该图谱可用作鉴别20头云三七药材的佐证。
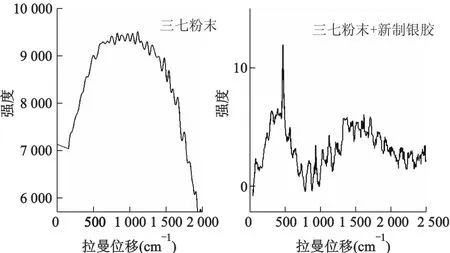
图6 三七粉末样品的常规拉曼光谱及表面增强拉曼光谱
三七水提/醇提样品与等体积的新制银胶混合后测试其SERS,结果如图7所示。结果表明,三七水提液的常规拉曼光谱图为一“荧光包”,而加了等体积的银溶胶后,在310,475,615,740,925,943,1 080,1 120,1 330 cm-1处出现了微弱的拉曼信号。三七醇提液的常规拉曼光谱在1 030,1 465 cm-1出现了2个明显的拉曼信号,而该两处的拉曼信号峰正好与甲醇的2个特征峰位置一致,实为C-H的面内振动以及C-O-H的弯曲振动引起的拉曼信号;滴加了等体积新制银胶的三七醇提液样品的SERS图谱在735,943,1 030,1 080,1 330,1 385,1 465以及1 533 cm-1等处出现了微弱的拉曼信号,扣除溶剂峰后,735,943,1 080,1 330 cm-1等相同位置出现了拉曼信号,其中735,943,1 330 cm-1可能是三七中糖类碳水化合物的特征峰,而1 080 cm-1可能为人参皂苷分子母核六元环的C-C振动峰,水提液中925,1 120 cm-1为人参皂苷中C-O-C醚键的振动峰,310,475 cm-1等600 cm-1以下多为三七中有效成分的环骨架模型引起的振动[19]。

图7 三七提取液的常规拉曼光谱以及表面增强拉曼光谱
2.2.2 三七醇提液的TLC-SERS检测 由以上测试结果可知,三七粉末样品滴加了自制银胶后会出现拉曼信号,但由于成分太复杂、荧光较强等干扰因素的存在,三七粉末的SERS图谱的信息并不丰富,严格意义上讲只存在个别特征峰;而三七水提液和醇提液与银胶混合后测试的SERS图谱有相应拉曼信号出现,但是信号均较微弱,荧光影响依然存在。
为了进一步克服中药复杂系统拉曼荧光强的弱点,得到三七中单一有效成分的详细拉曼图谱,本实验采取了将经过甲醇粗提的三七样品经TLC法进行简单分离后,测试其单一组分的SERS。为排除硅胶存在对测定主成分的影响,本实验中先测试硅胶G的SERS作为空白对照,结果如图8所示,空白硅胶G的SERS并没有明显的拉曼信号,所以对样品中主成分的拉曼光谱信号并无影响。

图8 空白硅胶G的表面增强拉曼光谱
图9为显色斑点采集样品A、B、C的SERS图谱,结果显示3种单一成分在471,543,960,1 015,1 113,1 233,1 374,1 475 cm-1附近均有拉曼峰出现,推测其为三七中人参皂苷母核及相同基团振动变形所引起的。如1 015 cm-1附近为伯醇C-C-O的面外伸缩振动,1 113 cm-1为仲醇C-C-O的面外伸缩振动,1 233 cm-1为环氧化合物的环对称伸缩,1 374 cm-1为六元环的环伸缩,1 457 cm-1为六元环椅式异构体的剪式振动[20-21]。
但比较3个图谱可发现,除了以上共有峰以外,每个成分的SERS还有其特征峰。如斑点A样品的SERS图谱中726,781 cm-1等特征峰,斑点B样品的SERS图谱中212,743,1 169 cm-1等特征峰,斑点C样品的SERS图谱中361 cm-1处出现的峰。根据这些特征峰的信息,我们可以用SERS来区分和鉴别三七提取物中不同的有效成分,建立三七中各种有效成分的标准对照拉曼图谱,更便于实际鉴别操作中的成分鉴别,也为今后应用SERS定量分析中药材中有效成分打下基础。
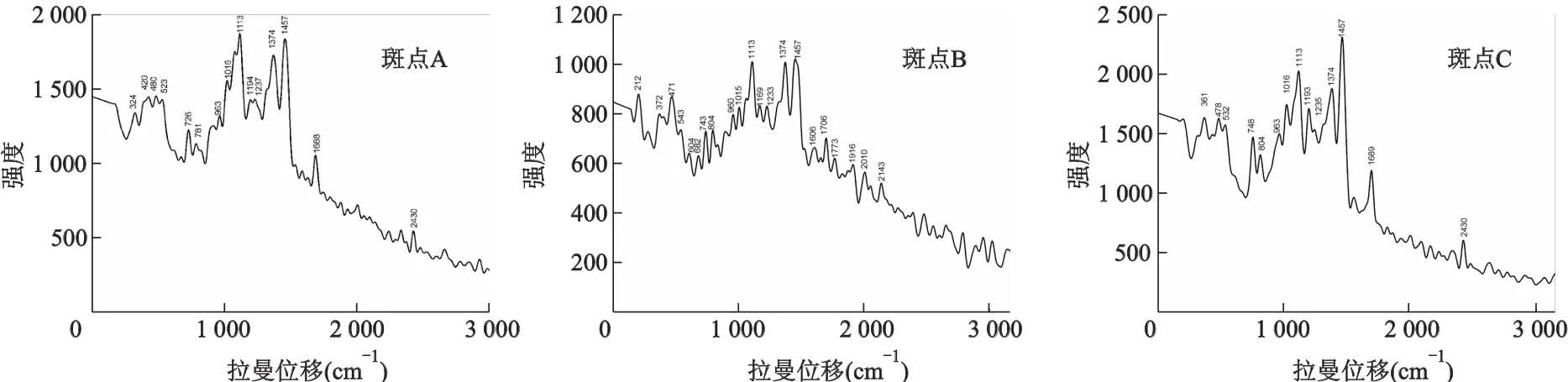
图9 三七TLC分离斑点的表面增强拉曼光谱
3 结论
本实验建立了利用SERS技术快速、稳定、灵敏地分析测试三七药材粉末、三七药材提取物中成分的方法,以及经简单预处理后,结合TLC分离方法,应用SERS来检测分析三七中单一有效成分的方法。实验结果表明,SERS法可快速获得三七药材粉末、三七提取物的特征拉曼光谱,在今后的实验中可借鉴此法建立不同产地以及不同采收季节等三七的拉曼图谱库,进一步完善三七药材拉曼光谱鉴定的方法。另外,可结合标准对照品,采用TLCSERS法,建立三七提取物中多个不同成分的标准SERS库,直接作为各有效成分的参考对照。同时,本实验中所建立的方法可拓展到其他中药材的鉴定和分析中,为中药快检技术提供新的方法。
[1] 黄冬兰,陈小康,徐永群,等.三七炮制前后的红外光谱分析研究[J].光谱学与光谱分析,2014,34(7):1849-1852.
[2] Ding R,Bao J,Wan J,et al.Panax notoginseng saponins protect against chronic ethanolinduced hepatic steatosis[J].JChin Pharm Sci,2014,23(6):361-368.
[3] 孙晓东,李军,韩立敏.薄层扫描法测定三七中皂甙元齐墩果酸的含量[J].陕西中医,2009,30(3):346-347.
[4] 王德民,孙大雨,王彦波,等.高效液相色谱法测定冠心丹参滴丸中三七皂苷R1的含量[J].黑龙江医药,2014,27(2):244-246.
[5] 刘伟芬,李禄辉.三七皂甙类成分分析方法研究进展[J].中国中医药现代远程教育,2014,12(3):162-163.
[6] 文屏,王建文,蔡珊珊.UPLC法测定九味肝泰胶囊中人参皂苷Rg1及三七皂苷R1的含量[J].中国当代医药,2014,21(10):9-15.
[7] 杨美丽,戴忠,胡晓茹,等.UPLC法同时测定三七伤药片中4个成分含量[J].药物分析杂志,2014,34(5):924-927.
[8] Zajac A,Hanuza J,Dymińska L.Raman spectroscopy in determination of horse meat content in the mixture with othermeats[J].Food Chem,2014,156:333-338.
[9] Haughey SA,Galvin-King P,Ho Y,etal.The feasibility of using near infrared and Raman spectroscopic techniques to detect fraudulent adulteration of chili powders with Sudan dye[J].Food Control,2015,48:75-83.
[10] Özbalci B,Boyaci IH,Topcu A,et al.Rapid analysis of sugars in honey by processing Raman spectrum using chemometricmethods and artificial neural networks[J].Food Chem,2013,136(3/4):1444-1452.
[11] Nakashima S,Ogura T,Kitagawa T.Infrared and Raman spectroscopic investigation of the reaction mechanism of cytochrome c oxidase[J].Biochim Biophys Acta,2015,1847(1):86-97.
[12] Orelio CC,Beiboer SH,Morsink MC,et al.Comparison of Raman spectroscopy and twomolecular diagnostic
methods for Burkholderia cepacia complex species identification[J].JMicrobiol Methods,2014,107:126-132.
[13] Gao Q,Liu Y,Li H,et al.Comparison of several chemometric methods of libraries and classifiers for the analysis of expired drugs based on Raman spectra[J].J Pharm Biomed Anal,2014,94:58-64.
[14] Boiret M,Rutledge DN,Gorretta N,et al.Application of independent componentanalysis on Raman images of a pharmaceutical drug product:Pure spectra determination and spatial distribution of constituents[J].JPharm Biomed Anal,2014,90:78-84.
[15] McAughtrie S,Faulds K,Graham D.Surface enhanced Raman spectroscopy(SERS):Potential applications for disease detection and treatment[J].JPhotoch Photobio C,2014,21:40-53.
[16] Shiohara A,Wang Y,Liz-Marzán LM.Recent approaches toward creation of hot spots for SERS detection[J].JPhotoch Photobio C,2014,21:2-25.
[17] Lee PC,Meisel D.Adsorption and surface-enhanced Raman of dyes on silver and gold sols[J].J Phys Chem,1982,86:3391-3395.
[18] 尹利辉,张雁.正电性纳米银胶的表征及加入不同凝聚剂后的表面增强拉曼散射光谱[J].药物分析杂志,2010,30(12):2352-2355.
[19] 许以明.拉曼光谱及其在结构生物学中的应用[M].北京:化学工业出版社,2005:3-8.
[20] 柯以侃,董慧茹.分析化学手册:光谱分册[M].2版.北京:化学化工出版社,1998:1151-1161.
[21] 多林希FR,佛特利WG,本特利FF.有机化合物的特征拉曼频率[M].朱自莹,译.北京:中国化学会出版社,1980:8-9.
Rapid analysis of active ingredients in Panax notoginseng using surface enhanced Raman spectroscopy
WEICheng-hua,CHEN Juan,XU Man-ling,QIXue-yong
(School of Pharmacy,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To establish surface-enhanced Raman spectroscopy(SERS)method for rapid analysis of active ingredients in Panax notoginseng.M ethods:Panax notoginseng was pretreated simply,then we tested the powder,water and alcohol extracts of Panax notoginseng by SERS respectively.We also got the spectrum of single active ingredient of the alcohol extracts combined with TLC,and analyzed these spectrum.Results:The powder,water and alcohol extracts of Panax notoginseng only could obtain weak signals of SERS directly,but the single active ingredient of Panax notoginseng separated by TLC technology could obtain its SERS spectra ideally.Conclusion:Themethod established in this article for rapid analysis of Panax notoginseng was efficient,rapid,specific,and high sensitivity,it can be extended to quality control and analysis in the identification of other herbalmedicines.
surface-enhanced Raman spectroscopy;Panax notoginseng;rapid analysis
R282.5 [文献标志码] A [文章编号] 1671-7783(2015)03-0263-05
10.13312/j.issn.1671-7783.y150009
江苏省高等学校大学生实践创新训练计划项目(201410299029Z)
卫程华(1994—),女,本科生;戚雪勇(通讯作者),副教授,E-mail:qixyemail@163.com
2015-01-16 [编辑] 何承志
