硫酸铵梯度法制备重酒石酸长春瑞滨脂质体及其在大鼠体内的药动学参数
2015-08-08郑召磊李亚平陈伶俐
郑召磊,李亚平,,陈伶俐
(1.江苏大学药学院,江苏镇江212013;2.中国科学院上海药物研究所药物制剂中心,上海201203)
硫酸铵梯度法制备重酒石酸长春瑞滨脂质体及其在大鼠体内的药动学参数
郑召磊1,李亚平1,2,陈伶俐2
(1.江苏大学药学院,江苏镇江212013;2.中国科学院上海药物研究所药物制剂中心,上海201203)
目的:采用硫酸铵梯度法制备重酒石酸长春瑞滨脂质体,并研究其理化性质及在大鼠体内的药动学行为。方法:采用硫酸铵梯度法制备重酒石酸长春瑞滨脂质体,并考察其形态、粒径、包封率、稳定性;采用HPLC测定长春瑞滨在大鼠体内的血药浓度。结果:重酒石酸长春瑞滨脂质体的平均粒径为(88.7±11.2)nm(n=3);包封率为(90.71±0.16)%(n=3);在10%胎牛血清中48 h释放率低于20%;SD大鼠尾静脉注射重酒石酸长春瑞滨脂质体后,药物半衰期为(5.38±0.29)h;AUC0→t=(98.11±0.12)mg·h-1·L-1。结论:重酒石酸长春瑞滨脂质体包封率较高,在血清中的稳定性良好,能够显著延长体内循环时间,提高其生物利用度。
重酒石酸长春瑞滨;脂质体;硫酸铵梯度法;药动学
长春瑞滨(vinorelbine)是一种半合成的长春生物碱类抗肿瘤药物,其作用机制是阻止细胞有丝分裂过程中微管的形成,使细胞分裂停止在分裂中期。临床上多将该药作为治疗非小细胞肺癌的首选药物,并广泛用于治疗乳腺癌、卵巢癌、恶性淋巴瘤等[1]。骨髓抑制、白细胞下降、胃肠道反应等不良反应使其在临床中的应用受到限制[2]。
脂质体作为抗肿瘤药物的载体,能靶向增加药物在肿瘤组织中的蓄积,并减少药物在正常组织中的分布,从而具有增强疗效、降低毒性的作用[3-4]。实验室微量制备长春瑞滨脂质体多采用成膜法和挤出法[5-6]。硫酸铵梯度法是利用脂质体膜内外硫酸铵的浓度梯度差,实现对药物的主动包裹,操作简单方便。因此,本研究采用硫酸铵梯度法结合高压均质法制备长春瑞滨脂质体,并考察其理化性质及其在大鼠体内的药动学行为,为长春瑞滨的临床应用开创一个更广阔的前景。
1 仪器与试药
Angilent1100型高效液相色谱仪(美国Angilent公司);Nano-ZS90型粒径测定仪(英国Malvern公司);Mili-Q纯水仪(美国Millipore公司);JEM-2000Ex型透射电镜(日本Jeol公司);M110-EH型均质机(美国Microfluidics公司);透析袋(美国Sigma公司,截留相对分子质量8 000~14 000)。
长春瑞滨原药(广州白云山汉方现代药业有限公司,含量>99%,批号B4140030);氢化磷脂(批号RKL-MD231);胆固醇(南京新百药业有限公司,批号131101);二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000,上海艾伟特医药科技有限公司,批号B20204);葡聚糖凝胶Sephadex G-50(美国GE公司,批号17004301);胎牛血清(美国Gibco公司);甲醇为色谱纯(德国默克公司),无水乙醇为分析纯。
健康雄性SD大鼠,体质量(200±10)g,清洁级,由中国科学院上海药物研究所二期实验动物中心提供。
2 方法与结果
2.1 脂质体的制备
2.1.1 空白脂质体的制备 称取处方量氢化磷脂、胆固醇和DSPE-PEG2000,置具塞锥形瓶中,加入适量无水乙醇,超声使完全溶解,得脂质乙醇溶液。70℃条件下,将脂质乙醇溶液加入到60 mL硫酸铵溶液(300 mmol/L)中,经剪切分散后,高压均质形成空白脂质体初液。采用透析法除去脂质体外水相硫酸铵。
2.1.2 脂质体的载药 取空白脂质体10 mL,按药脂比(1∶10,w/w)滴加长春瑞滨水溶液,60℃恒温条件下孵育10 min,得浓度约为1 mg/mL的长春瑞滨脂质体。
2.2 长春瑞滨脂质体的透射电镜形态观察
取上述制备的脂质体加水适当稀释,采用2%磷钨酸负染后,用透射电镜观察形态(图1)。可见脂质体大小均一,均呈现规则球形或近球形。
2.3 长春瑞滨脂质体的粒度分布
取上述脂质体于测量池中,加水适量稀释后,采用粒径测定仪测定其粒径及分布。测定结果显示,脂质体平均粒径为(88.7±11.2)nm(n=3),粒径分布指数(PDI)为0.129,粒径分布较均匀(图2)。

图1 长春瑞滨脂质体的形态(透射电镜)
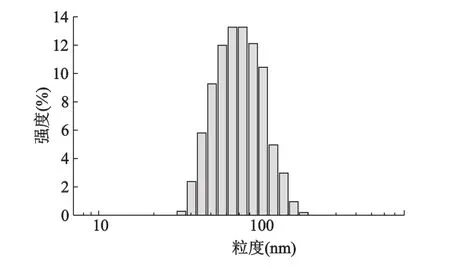
图2 长春瑞滨脂质体的粒度分布
2.4 长春瑞滨脂质体包封率的测定
2.4.1 色谱条件 色谱柱:Waters X-BridgeTMC18柱(4.6 mm×250 mm,5μm);流动相:0.05mol/L PBS(取磷酸二氢钾6.8 g,加水至800 mL溶解,加三乙胺10 mL,磷酸调pH至4.0,加水至1 L)∶乙腈(60∶40);检测波长:267 nm;柱温:40℃,流速:1.0 mL/min;进样量:20μL。
2.4.2 检测方法的方法学验证 精密称取长春瑞滨适量,以甲醇为溶剂,配制浓度为1,10,50,100,200和400 mg/L的溶液,按“2.4.1”项下条件测定。得浓度(c)对峰面积(A)的线性回归方程A= 20.818c-0.6481,r=0.999 7,表明在1~400 mg/L范围内,浓度与峰面积具有良好的线性关系。
配制浓度为1,50,100 mg/L长春瑞滨溶液,分别进行日内和日间精密度考察。日内和日间RSD分别为1.10%,0.76%,0.56%和1.89%,0.80%,0.67%(n=5),RSD值均小于2%。
配制浓度为100 mg/L长春瑞滨溶液,精密量取1,2,3 mL于10 mL容量瓶中,加入处方量的空白脂质体,甲醇破乳并定容,得10,20,30 mg/L的样品溶液,按“2.4.1”项下条件测定。计算得回收率分别为(99.60±0.31)%,(100.07±0.25)%,(100.23± 0.12)%,RSD值分别为0.30%,0.25%,0.12%(n=3)。
2.4.3 脂质体洗脱曲线的绘制 取葡聚糖凝胶Sephadex G-50适量,加水适量充分溶胀后,制备凝胶柱(1 cm×45 cm)。移液管量取长春瑞滨脂质体0.5 mL上柱,PBS(pH 7.4)洗脱,流速为0.8 mL/ min。用刻度EP管收集洗脱液,每管收集2 mL。不带乳光的直接按“2.4.1”项下条件测定峰面积;有乳光的样品加定量的甲醇破坏后,测定其峰面积。另配制浓度约为1 mg/mL的长春瑞滨溶液,量取0.5 mL上柱,每管2 mL,收集洗脱液。结果显示,脂质体集中在12~22 mL部分,游离药物集中在34~54 mL部分,脂质体部分与游离药物能完全分离,见图3。

图3 长春瑞滨脂质体以及游离药物洗脱曲线
2.4.4 葡聚糖凝胶法测定包封率 采用上述方法制备的凝胶柱,精密量取长春瑞滨脂质体0.5 mL上柱,根据洗脱曲线,收集脂质体部分(12~22 mL)洗脱液,置50 mL容量瓶中,用甲醇破乳并定容至刻度,再精密量取5 mL置10 mL容量瓶中,甲醇定容,按“2.4.1”项下条件测定,得脂质体中包裹的药量W。另外精密量取脂质体0.5 mL置于50 mL容量瓶中,甲醇破乳并定容,再精密量取5 mL置10 mL容量瓶中,甲醇定容,同法操作,得脂质体中的总药量W0。按公式包封率=W/W0×100%计算脂质体的平均包封率为(90.71±0.16)%(n=3)。
2.5 脂质体在胎牛血清中的释放度
精密量取长春瑞滨脂质体悬液0.5 mL置透析袋中,并将透析袋两端扎紧,置装有释放介质(10%胎牛血清溶液)20 mL的锥形瓶中,于摇床[(37± 0.5)℃、100次/min]中振荡,分别在0.5,1,2,4,6,8,12,24,48,72,96,120和148 h取出全部介质(同时用同温等量释放介质替换原先释放介质),按“2.4.1”项下条件测定,计算累积释放率Q,同时以游离药物为对照进行比较,以Q对时间(t)作图,结果见图4。结果显示,在10%胎牛血清溶液中长春瑞滨从脂质体中释放缓慢,48 h累积释放率低于20%,表明长春瑞滨脂质体在胎牛血清中的稳定性良好;120 h后,长春瑞滨从脂质体中释放完全。游离药物在相同条件下6 h内就释放96%以上,表明长春瑞滨脂质体具有显著缓释作用。

图4 长春瑞滨脂质体以及游离药物的体外释放曲线
2.6 长春瑞滨脂质体的药动学参数测定
2.6.1 药动学色谱条件及方法学验证 样品采用高效液相色谱(HPLC)方法测定。色谱条件:按“2.4.1”项下条件。
取空白血浆100μL置1.5 mL离心管中,加入已知浓度的长春瑞滨甲醇溶液400μL,涡旋30 s后离心(相对离心率12 000×g)10 min,取上清液测定长春瑞滨浓度。得线性回归方程为A=19.104c-18.271,r=0.9994,表明在0.25~80 mg/L的范围内,浓度与峰面积具有良好线性关系。
长春瑞滨在0.25,40和80 mg/L血样中的回收率分别为80.31%、84.33%和89.58%(n=3),均满足分析方法的要求(>75%);日内和日间RSD分别为1.57%,0.89%,0.93%和2.83%,3.06%,2.12%(n=5),均满足生物样品的分析要求。
2.6.2 实验方案和血样处理 取SD大鼠8只,随机分为两组(每组4只)。将长春瑞滨注射液(加生理盐水稀释成1 mg/mL的溶液)或脂质体按10 mg/ kg(按长春瑞滨计)从尾静脉注射入SD大鼠体内,分别于0.083,0.25,0.5,1,2,4,6,8,10,12和24 h眼眶取血0.5 mL于离心管中(每管加10μL 1%的肝素钠),离心(相对离心率5 000×g)5min,得上层血浆。取上述血浆样品100μL置1.5 mL离心管中,加入甲醇400μL,涡旋30 s后离心(相对离心率12 000×g)10 min,取上清液测定血药浓度。采用DAS 2.0药动学软件对血药浓度数据进行计算。采用非房室模型以统计矩计算药动学参数。
2.6.3 药动学实验结果 大鼠尾静脉注射长春瑞滨脂质体或长春瑞滨溶液后的药时曲线见图5。药动学参数见表1。
大鼠体内药动学实验表明,长春瑞滨脂质体的药时曲线下面积(AUC0→t)和半衰期分别是长春瑞滨溶液的17.2和3.2倍。

图5 长春瑞滨注射液以及脂质体的药时曲线
3 讨论
硫酸铵梯度法类似于pH梯度法,利用脂质体磷脂双分子层两侧硫酸铵梯度差,实现对药物的包封。其原理是内水相中氨分子扩散到外部,间接形成pH梯度,使药物进入脂质体内[7-8]。硫酸铵梯度法适合于弱碱性药物脂质体的制备,具有制备方法简单、包封率高的特点。长春瑞滨是一种半合成的弱碱性类抗癌药物。因此,本研究采用硫酸铵梯度法结合高压均质法制备的重酒石酸长春瑞滨脂质体,粒径均一,包封率高,稳定性好。

表1 脂质体与普通注射液主要药动学参数比较 n=4
目前,常用的脂质体包封率测定方法包括超滤法、离心法和凝胶过滤法等。离心法所需转速极高,条件苛刻,且不易分离游离药物与脂质体;超滤法所使用的超滤管对长春瑞滨截留严重,测定误差较大。本实验所使用的葡聚糖凝胶过滤法,可以将游离药物与脂质体完全分离,适合长春瑞滨脂质体包封率的测定,因此,测定结果准确可靠。
大鼠体内药动学研究结果表明,与市售长春瑞滨注射液相比,脂质体可明显延长药物的生物半衰期,大大提高了AUC。这可能是因为脂质体处方中加入了长循环材料DSPE-PEG2000,PEG类化合物用于修饰脂质体可形成空间位阻,增加脂质体在血液中的稳定性,逃避网状内皮系统的捕获,从而延长脂质体在血液中的循环时间。
[1] 习利平,宋新波,张丽娟.长春碱类抗癌药的研究进展[J].药物评价研究,2011,34(1):59-62.
[2] 盛滢,孙芙蓉,于爽.静脉注射重酒石酸长春瑞滨治疗非小细胞肺癌的护理观察[J].山西医药杂志,2005,34(5):534.
[3] Li CL,Cui JX,Wang CX,et al.Development of pegylated liposomal vinorelbine formulation using post-insertion technology[J].Int J Pharm,2010,391(1/2):230 -236.
[4] Yang SH,Lin CC,Lin ZZ,etal.A phaseⅠand pharmacokinetic study of liposomal vinorelbine in patient with advanced solid tumor[J].Invest New Drugs,2012,30(1):282-289.
[5] 王栋海,解李丽,张勇,等.PEG2000-DSPE含量不同的酒石酸长春瑞滨脂质体的制备和评价[J].中国医药工业杂志,2014,45(11):1046-1049.
[6] 黄微崴,李哲,张小飞,等.蔗糖八硫酸酯三乙胺梯度法制备重酒石酸长春瑞滨脂质体[J].中国新药杂志,2010,19(20):1903-1906.
[7] Barenholz Y.Amphipathic weak base loading into preformed liposomes having a transmembrane ammonium ion gradient:from the bench to approved Doxil[M]// Gregoriadis G.Liposome technology:volumeⅡEntrapment of drugs and other materials into liposomes.3rd ed.New York:Informa Healthcare USA,2007:1-25.
[8] Zhang H,Wang ZY,Gong W,et al.Development and characteristics of temperature-sensitive liposomes for vinorelbine bitartrate[J].Int JPharm,2011,414(1/2):56-62.
Preparation and pharmacokinetics in rat of vinorelbine biartrate liposomes by ammonium sulfate gradientmethod
ZHENG Zhao-lei1,LIYa-ping1,2,CHEN Ling-li2
(1.School of Pharmacy,Jiangsu University,Zhenjiang Jiangsu 212013;2.Center for Formulations System,Shanghai Institute ofMateria Medica,Chinese Academy of Sciences,Shanghai201203,China)
Objective:To prepare vinorelbine bitartrate(NVB)liposomes by ammonium sulfate gradient method,and to study the properties and pharmacokinetics of NVB liposomes.M ethods:NVB liposomes were prepared by ammonium sulfate gradientmethod.The mean diameter of liposomes was determined by dynamic light scattering.Encapsulation efficiency was determined by sephadex column,pharmacokinetics was evaluated in SD rats.Results:Mean particle size and encapsulation efficiency of NVB liposomeswere(88.7±11.2)nm(n=3)and(90.71±0.16)%(n=3).In addition,less than 20%of NVB liposomes was released in 48 hours.Themain pharmacokinetic parameters of NVB liposomes were as follows:t1/2=(5.38±0.29)h and AUC0→t=(98.11±0.12)mg·h-1·L-1.Conclusion:NVB liposomes exhibited high encapsulation efficiency.The pharmacokinetics of NVB liposomes showed prolonged elimination halflife and increased bioavailability.
vinorelbine biartrate;liposomes;ammonium sulfate gradientmethod;pharmacokinetics
R943 [文献标志码] A [文章编号] 1671-7783(2015)03-0256-04
10.13312/j.issn.1671-7783.y140321
郑召磊(1987—),男,硕士研究生;陈伶俐(通讯作者),高级工程师,E-mail:linglichen1872@hotmail.com
2014-12-10 [编辑] 陈海林
