弓形虫表面抗原1、棒状体蛋白18真核表达载体的构建与体外表达
2015-08-08吴腊梅吴婷吴亮王晓苏丹华刘原陶思佳魏逸青姜旭淦陈盛霞曹建平
吴腊梅,吴婷,吴亮,王晓,苏丹华,刘原,陶思佳,魏逸青,姜旭淦,陈盛霞,曹建平
(1.江苏大学医学院,江苏镇江212013;2.中国疾病预防控制中心寄生虫病预防控制所,上海200025)
弓形虫表面抗原1、棒状体蛋白18真核表达载体的构建与体外表达
吴腊梅1,吴婷1,吴亮1,王晓1,苏丹华1,刘原1,陶思佳1,魏逸青1,姜旭淦1,陈盛霞1,曹建平2
(1.江苏大学医学院,江苏镇江212013;2.中国疾病预防控制中心寄生虫病预防控制所,上海200025)
目的:构建刚地弓形虫(Toxoplasma gondii)表面抗原1(surface antigen 1,SAG1)及棒状体蛋白18(rhoptry protein 18,ROP18)的真核表达重组质粒,并在真核细胞中表达目的蛋白。方法:设计SAG1、ROP18的特异引物,采用RCR技术从弓形虫RH株基因组DNA中扩增编码SAG1、ROP18基因片段,经克隆至pTG19-T载体后,亚克隆至真核表达载体p3×FLAG-Myc-CMVTM-24,构建真核表达重组质粒p3×FLAG-Myc-CMVTM-24-SAG1和p3×FLAG-Myc-CMVTM-24-ROP18。将构建好的真核表达重组质粒转染人肾上皮细胞系293-T细胞,分析转染细胞的表达情况。结果:PCR扩增弓形虫SAG1和ROP18基因片段分别为1 011 bp和1 665 bp,与预期大小相符。重组质粒经PCR、酶切和测序鉴定结果均正确,通过RT-PCR和蛋白质印迹技术鉴定出重组质粒p3×FLAG-Myc-CMVTM-24-SAG1和p3× FLAG-Myc-CMVTM-24-ROP18在293-T细胞中表达。结论:成功构建了真核表达质粒p3×FLAG-Myc-CMVTM-24-SAG1和p3×FLAG-Myc-CMVTM-24-ROP18,该重组质粒能够在真核细胞中表达目的蛋白。
刚地弓形虫;SAG1;ROP18;真核表达质粒
弓形虫(Toxoplasma gondii)是一种专性细胞内寄生虫,可引起人兽共患弓形虫病[1]。弓形虫病也是最常见的机会性致病寄生虫病[2],肿瘤患者、HIV以及AIDS人群弓形虫抗体阳性率分别高达63%、44.8%和95.0%[3-4]。另有研究表明,弓形虫可影响患者的智力发育,与精神分裂症的发生存在联系[5]。常见的经济家畜如牛、羊和猪等普遍易感弓形虫,每年由弓形虫感染造成的家畜流产、早产和死胎给畜牧业生产造成了严重的经济损失[6-7]。猫、狗等宠物也易感染弓形虫,是人类感染弓形虫的重要传染源[8-9]。鉴于弓形虫病对人类健康造成的严重危害和对畜牧业生产造成的经济损失,研制具有免疫保护作用的疫苗成为防治弓形虫病的一种有效手段。速殖子表面抗原(surface antigen,SAG)1是最早被克隆表达的蛋白,虽然只占虫体总蛋白量的3%~5%,但其诱导机体产生的抗体量占总抗体量的50%,说明SAGl虽含量甚微,但为速殖子的主要抗原成分,是诱导宿主免疫应答的主要靶抗原。棒状体蛋白(rhoptry protein,ROP)18定位于纳虫泡中[10],是丝氨酸 苏氨酸激酶,是重要的毒力因子[11]。R0P18可改变其感染的宿主细胞的信号传导,使感染细胞的基因表达发生变化,阻止宿主细胞发生凋亡。当弓形虫进入宿主细胞时,会生成一层保护膜将自身包裹起来,R0P18的作用则是让宿主细胞的某些蛋白失效而无法破坏这层保护膜[12]。本研究旨在构建真核表达重组质粒p3×FLAG-Myc-CMVTM-24-SAG1和p3×FLAG-Myc-CMVTM-24-ROP18,为弓形虫DNA疫苗研制提供一定的基础。
1 材料与方法
1.1 虫株、质粒及菌株
弓形虫RH株速殖子、大肠埃希菌(E.coli)DH5α为本实验室保存,pTG19-T载体购至上海捷瑞生物技术有限公司,p3×FLAG-Myc-CMVTM-24真核表达载体由江苏大学医学院龚爱华副教授惠赠。
1.2 主要试剂和仪器
限制性内切酶、第1链cDNA合成试剂盒(美国Thermo公司),T4DNA连接酶Ver.2.0购于宝生物工程(大连)有限公司,PCR预混液(美国Promega公司),DNA提取纯化试剂盒、琼脂糖凝胶回收试剂盒购于上海捷瑞生物技术有限公司,RPMI 1640培养液购于赛默飞世尔生物化学制品(北京)有限公司,胎牛血清和新生牛血清购于杭州四季青公司,基因转染试剂Ronfect购于上海荣柏生物科技有限公司,SAG1和ROP18[13]多克隆抗体由本实验室制备。CO2培养箱(Forma seriesⅡ,美国Thermo公司),电泳仪(美国Bio Rad公司),冷冻型离心机(德国Eppendorf公司)。
1.3 虫体的培养及DNA的提取
参考沈进等[14]方法在HeLa细胞中传代培养弓形虫RH株速殖子。用含10%新生牛血清RPMI 1640培养液培养HeLa细胞,待细胞密度为70%~80%时,更换含1%胎牛血清的RPMI 1640培养液并感染虫体,待虫体涨破细胞后,收集虫体。参照捷瑞公司基因组DNA纯化试剂盒说明书提取弓形虫速殖子基因组DNA,-20℃冻存备用。
1.4 SAG1及ROP18基因的体外扩增和克隆
根据数据库ToxoDB弓形虫基因组中SAG1和ROP18基因序列设计引物。SAG1上游引物P1:5′-CCCAAGCTTATGTCGGTTTCGCTGCACC-3′,下游引物P2:5′-CGGAATTCGCCGCGACACAAGCTGCGAT A-3′。SAG1 PCR反应条件:94℃预变性10 s;94℃变性5 s,60℃退火30 s,72℃延伸1 min,共25个循环;72℃延伸7 min。ROP18上游引物P1:5′-GGCAAGCTTATGTTTTCGGTACAGCGGCCACCTCTTA-3′,下游引物P2:5′-GGCGGATCCGCTTCTGTGTGGAGATGTTCCTGCTGTTC-3′。ROP18 PCR反应条件:95℃预变性10 s;94℃变性5 s,60℃退火90 s,72℃延伸90 s,共30个循环;72℃延伸10 min。1%琼脂糖凝胶电泳分离PCR产物,并切胶回收后与pTG19-T载体于16℃连接过夜。转化E.coli DH5α感受态细胞,氨苄西林筛选,阳性克隆接种于3 mL LB液体培养基中培养过夜。抽提质粒,PCR、酶切鉴定,阳性克隆送上海尼桑生物科技有限公司测序。
1.5 SAG1及ROP18真核表达载体的构建
分别扩增阳性克隆菌株和含p3×FLAG-Myc-CMVTM-24的菌株,碱裂解法抽提并纯化质粒。SAG1和表达载体p3×FLAG-Myc-CMVTM-24分别用Hin dⅢ和Eco RⅠ进行双酶切,ROP18和表达载体p3×FLAG-Myc-CMVTM-24分别用Bam HⅠ和Hin dⅢ进行双酶切。1%琼脂糖凝胶电泳分离酶切后的目的片段和载体并回收,将酶切后的载体和目的片段进行连接,转化E.coli DH5α感受态细胞。抽提质粒DNA,用PCR和双酶切鉴定阳性重组质粒。
1.6 重组质粒转染人肾上皮细胞系293-T细胞
采用贴壁细胞的DNA转染法,按非脂质阳离子聚合物RonfectTMDNA转染试剂使用说明进行。于转染前1 d,将293-T细胞接种于6孔板中,置于37℃、5%CO2培养箱中培养,待细胞密度为60%~80%且状态良好时进行转染。在转染前2 h,吸除细胞原有的培养液,换为新鲜的含15%胎牛血清的DMEM。将2μg质粒DNA用100μL无血清DMEM稀释,充分混匀后制成DNA稀释液。向DNA稀释液中加入2μL RonfectTM,轻轻混匀,室温静置15~30min后,将转染复合物加入细胞培养液中,轻轻混匀。置于CO2培养箱中继续培养48 h后,收集细胞,于-80℃冻存备用。同时转染空质粒p3× FLAG-Myc-CMVTM-24作为阴性对照。
1.7 SAG1、ROP18的体外表达分析
1.7.1 RT-PCR分析SAG1、ROP18的表达 按RNA抽提试剂盒的使用说明提取细胞总RNA,溶于DEPC处理水中。将RNA与oligo(dT)18置于65℃反应15 min后冰浴30 s,再加入反应缓冲液、RNA酶抑制剂、dNTP混合物和M-MLVRT,轻轻混匀后置于42℃反应60 min,70℃灭活5 min,反转录成cDNA,直接用于PCR分析,扩增产物用1%琼脂糖凝胶电泳鉴定。
1.7.2 蛋白质印迹分析SAG1、ROP18的表达 收集转染的293-T细胞,重悬于20μL 2×SDS-PAGE上样缓冲液中,100℃水浴煮沸5 min,10 000×g离心5 min,取上清行SDS-PAGE电泳。先用80 V电泳15 min左右,待样本被压成一条直线后换成110 V。电泳结束后,取下凝胶,与PVDF膜紧贴,150 mA恒流电泳70min;转印后的PVDF膜经TBST洗涤后,用含5%脱脂奶粉的TBST封闭,室温下作用30 min。将兔多克隆抗体用5%脱脂奶粉1∶10稀释,于室温孵育2 h,TBST洗涤3次;与1∶5 000稀释的HRP标记羊抗兔IgG室温孵育1 h,TBST洗涤3次;将膜置于化学发光仪下,滴加ECL显色液观察结果。
2 结果
2.1 真核表达载体p3×FLAG-Myc-CMVTM-24-SAG1的鉴定
2.1.1 SAG1基因的扩增 PCR结果显示,弓形虫速殖子基因组DNA中扩增出SAG1的片段,其长度约1 011 bp,与预期结果一致(图1)。进一步的测序结果表明,SAG1的基因序列与基因库已发表的基因序列完全一致,开放阅读框正确。

图1 SAG1基因PCR扩增结果
2.1.2 真核表达载体p3×FLAG-Myc-CMVTM-24-SAG1的鉴定 以构建成功的重组质粒p3×FLAGMyc-CMVTM-24-SAG1为模板,特异性PCR引物扩增SAG1,成功扩增出目的片段,与预期结果相符(图2)。该质粒经Hin dⅢ和Eco RⅠ双酶切后得到与预期相同的两条条带,与理论数值完全符合(图3)。

图2 重组质粒p3×FLAG-M yc-CMVTM-24-SAG1 PCR扩增结果

图3 重组质粒p3×FLAG-M yc-CMVTM-24-SAG1双酶切电泳结果
2.1.3 p3×FLAG-Myc-CMVTM-24-SAG1体外表达分析 分别用转染有p3×FLAG-Myc-CMVTM-24-SAG1、p3×FLAG-Myc-CMVTM-24空质粒的293-T细胞提取的总RNA为模板行RT-PCR扩增,结果转染有p3×FLAG-Myc-CMVTM-24-SAG1的细胞扩增出约1 011 bp左右的条带,与SAG1基因片段长度相符(图4)。
蛋白质印迹结果显示,只有p3×FLAG-Myc-CMVTM-24-SAG1转染的293-T细胞有特异性条带,表明转染p3×FLAG-Myc-CMVTM-24-SAG1的293-T细胞表达了SAG1(图5)。

图4 RT-PCR鉴定转染细胞SAG1的表达
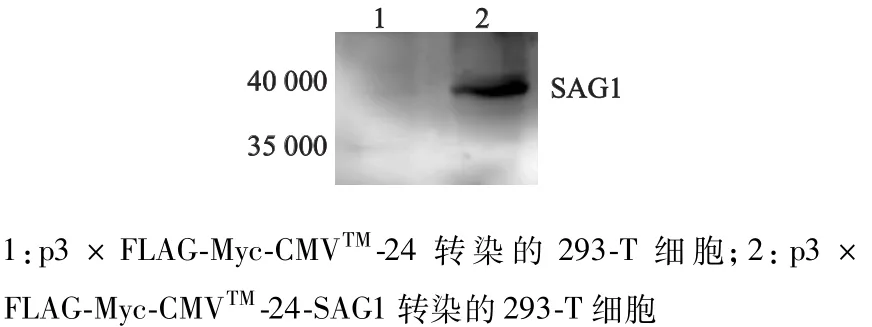
图5 蛋白质印迹鉴定转染细胞SAG1的表达
2.2 真核表达质粒p3×FLAG-Myc-CMVTM-24-ROP18的鉴定
2.2.1 ROP18基因的扩增 从刚地弓形虫基因组DNA中扩增ROP18的PCR结果见图6。PCR扩增出ROP18的DNA片段长度约1 665 bp,与预期结果一致。进一步的测序结果表明,ROP18基因序列与基因库已发表的基因序列完全一致,开放阅读框正确。

图6 ROP18基因PCR扩增结果
2.2.2 真核表达质粒p3×FLAG-Myc-CMVTM-24-ROP18的鉴定 以构建成功的重组质粒p3× FLAG-Myc-CMVTM-24-ROP18为模板,特异性PCR引物扩增ROP18,成功扩增出目的片段,与预期结果相符(图7)。真核表达质粒p3×FLAG-Myc-CMVTM-24-ROP18经Hin dⅢ和Bam HⅠ双酶切之后得到与预期相同的2条条带(图8)。

图7 重组质粒p3×FLAG-M yc-CMVTM-24-ROP18 PCR扩增结果
2.2.3 p3×FLAG-Myc-CMVTM-24-ROP18体外表达分析 分别用转染有p3×FLAG-Myc-CMVTM-24-ROP18和p3×FLAG-Myc-CMVTM-24空质粒的293-T细胞提取的总RNA作模板行RT-PCR扩增,只有转染有p3×FLAG-Myc-CMVTM-24-ROP18的细胞扩增出约1 665 bp左右的条带,与ROP18基因片段长度相符(图9)。
蛋白质印迹结果表明,只有p3×FLAG-Myc-CMVTM-24-ROP18转染的293-T细胞有特异性条带,表明转染p3×FLAG-Myc-CMVTM-24-ROP18的293-T细胞表达了ROP18(图10)。

图9 RT-PCR鉴定转染细胞ROP18的表达

图10 蛋白质印迹鉴定转染细胞ROP18的表达
3 讨论
弓形虫病疫苗研制经历了全虫疫苗、虫体特异组分疫苗、基因工程疫苗和核酸疫苗4个阶段,其中核酸疫苗以其优异性能成为当前弓形虫疫苗研制的热点。核酸疫苗是编码免疫原或与免疫原相关的真核表达质粒DNA(有时也可是RNA),其可经一定的途径进入动物体内,经宿主细胞摄取后,通过转录和翻译表达出抗原蛋白,刺激机体产生非特异性和特异性两种免疫应答反应,从而起到免疫保护作用。
速殖子是弓形虫的主要致病阶段,在侵入细胞的过程中,可溶性蛋白SAG1可以直接结合到宿主细胞表面。速殖子表膜是宿主细胞免疫防御识别和杀伤虫体的主要作用部位。占国清等[15]用重组真核表达质粒PBK-P30肌肉注射免疫BALB/c小鼠,诱导其产生了体液及细胞免疫应答。高世同等[16]用构建的pVAX1-SAG2免疫小鼠,诱导其产生了特异性的IgG抗体。ROPs对弓形虫入侵宿主细胞起重要作用,目前已知有30多种ROPs蛋白,Chen等[17]用构建的ROP1基因重组质粒免疫小鼠,诱导其产生了细胞免疫及体液免疫。Wang等[18]用构建的真核表达质粒PVAX-ROP13制成DNA疫苗,用肌肉注射的方法免疫小鼠,小鼠特异性抗体IgG水平明显升高,弓形虫感染后小鼠的存活率显著提高。上述研究结果表明,弓形虫表面蛋白SAG、ROPs对于弓形虫感染具有良好的免疫保护作用,是研制弓形虫核酸疫苗有力的候选基因。
本研究采用的真核表达载体p3×FLAG-Myc-CMVTM-24含有人巨细胞病毒(CMV)高效启动子/增强子序列,是能够使外源基因在哺乳动物细胞内高效表达的良好载体,常用于构建核酸疫苗。本研究用基因工程的方法,将弓形虫SAG1、ROP18基因分别连接至真核表达载体,成功构建了真核表达质粒p3×FLAG-Myc-CMVTM-24-SAG1和p3×FLAGMyc-CMVTM-24-ROP18,为弓形虫核酸疫苗的研制奠定了基础。
[1] Black MW,Boothroyd C.Lytic cycle of Toxoplasma gondii[J].MicrobiolMol Biol Rev,2000,64(3):607 -623.
[2] Dubey JP.Advances in the life cycle of Toxoplasma
gondii[J].Int J Parasitol,1998,28(7):1019 -1024.
[3] Yazar S,Yaman O,Eser B,etal.Investigation of anti-Toxoplasma gondii antibodies in patients with neoplasia[J].J Med Microbiol,2004,53(Pt 12):1183 -1186.
[4] Nissapatorn V,Lee C,Quek KF,et al.Toxoplasmosis in HIV/AIDSpatients:a currentsituation[J].Jpn JInfect Dis,2004,57(4):160-165.
[5] Flegr J,Preiss M,Klose J,et al.Decreased level of psychobiological factor novelty seeking and lower intelligence inmen latently infected with the protozoan parasite Toxoplasma gondii Dopamine,a missing link between schizophrenia and toxoplasmosis[J].Biol Psychol,2003,63(3):253-268.
[6] Dubey JP.Status of toxoplasmosis in sheep and goats in the United States[J].JAm VetMed Assoc,1990,196(2):259-262.
[7] Buxton D.Protozoan infections(Toxoplasma gondii,Neospora caninum and Sarcocystis spp.)in sheep and goats:recent advances[J].Vet Res,1998,29(3/4):289-310.
[8] Etheredge GD,Michael G,Muehlenbein MP,et al.The roles of cats and dogs in the transmission of Toxoplasma infection in Kuna and Embera children in eastern Panama[J].Rev Panam Salud Publica,2004,16(3):176-186.
[9] Smielewska-Los'E,PacońJ.Toxoplasma gondii infection of cats in epizootiological and clinical aspects[J].Pol JVet Sci,2002,5(4):227-230.
[10] Sinai AP.The toxoplasma kinase ROP18:an active member of a degenerate family[J].PLoSPathog,2007,3(2):e16.
[11] Saeij JP,Boyle JP,Coller S,et al.Polymorphic secreted kinases are key virulence factors in toxoplasmosis[J].Science,2006,314(5806):1780-1783.
[12] Fentress SJ,Behnke MS,Dunay IR,et al.Phosphorylation of immunity-related GTPases by a Toxoplasma gondii-secreted kinase promotes macrophage survival and virulence[J].Cell Host Microbe,2010,8(6):484 -495.
[13] 鞠爱萍,吴亮,沈进,等.弓形虫棒状体蛋白18的原核表达及鉴定[J].江苏大学学报:医学版,2013,23(3):207-211.
[14] 沈进,陈颖婷,吴亮,等.弓形虫速殖子感染对HeLa细胞凋亡的影响[J].江苏大学学报:医学版,2014,24(5):399-402,407.
[15] 占国清,吴少庭,李国光,等.弓形虫表面抗原P30DNA疫苗免疫小鼠诱导细胞免疫应答的研究[J].中国寄生虫病防治杂志,2001,14(4):257-259.
[16] 高世同,吴少庭,龙彩虹,等.弓形虫pVAX1-SAG2真核表达质粒的构建及其诱导的小鼠免疫应答[J].中国人兽共患病杂志,2004,20(8):658-661.
[17] Chen G,Guo H,Lu F,etal.Construction ofa recombinant plasmid harbouring the rhoptry protein 1 gene of Toxoplasma gondii and preliminary observations on DNA immunity[J].Chin Med J(Engl),2001,114(8):837-840.
[18] Wang PY,Yuan ZG,Petersen E,et al.Protective efficacy of a Toxoplasma gondii rhoptry protein 13 plasmid DNA vaccine in mice[J].Clin Vaccine Immunol,2012,19(12):1916-1920.
Construction and in vitro expression of Toxoplasma gondii SAG1,ROP18 eukaryotic expression plasm ids
WU La-mei1,WU Ting1,WU Liang1,WANG Xiao1,SU Dan-hua1,LIU Yuan1,TAO Si-jia1,WEIYi-qing1,JIANG Xu-gan1,CHEN Sheng-xia1,CAO Jian-ping2
(1.School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013;2.National Institute of Parasitic Diseases,Chinese Center for Disease Control and Prevention,Shanghai200025,China)
Objective:To construct two recombinant eukaryotic expression plasmids containing the surface antigen(SAG)1 and rhoptry protein(ROP)18 gene of Toxoplasma gondii,and express SAG1 and ROP18 proteins in the eukaryotic system.Methods:The gene fragments encoding SAG1 and ROP18 were amplified by PCR with special primers from Toxoplasma gondii genomic DNA respectively,and were cloned into pTG19-T vector.The rightgene fragmentswere subcloned into p3×FLAG-Myc-CMVTM-24 vector to construct the eukaryotic expression plasmids p3×FLAG-Myc-CMVTM-24-SAG1 and p3×FLAG-Myc-CMVTM-24-ROP18.The recombinant plasmidswere transfected into human renal epithelial 293-T cell lines respectively,and the expression of SAG1 and ROP18 in transfected cellswere detected by RT-PCR and Western blotting.ResultsThe gene fragments encoding SAG1,ROP18 were 1 011 bp and 1 665 bp respectively,which were consistantwith the expected size.The analysis of enzyme digestion,PCR and sequencing showed that the recombinant eukaryotic expression plasmids p3×FLAG-Myc-CMVTM-24-SAG1,p3×FLAG-Myc-CMVTM-24-ROP18 were constructed correctly.RT-PCR and Western blotting analysis of cells transfected SAG1,ROP18 gene displayedpositive bands.Conclusion:Recombinant eukaryotic expression plasmids of SAG1,ROP18 have been successfully constructed,the recombinant plasmids can express SAG1,ROP18 proteins in a eukaryotic system.
Toxoplasma gondii;SAG1;ROP18;eukaryotic expression plasmid
R382.5 [文献标志码] A [文章编号] 1671-7783(2015)03-0246-05
10.13312/j.issn.1671-7783.y140294
国家自然科学基金资助项目(81301453);卫生部寄生虫病原与媒介生物学重点实验室开放课题(WSBKTKT201302);中国博士后科学基金资助项目(2014M561598);江苏省博士后科研资助计划项目(1402171C);江苏大学高级人才启动基金资助项目(13JDG023,13JDG127)
吴腊梅(1989—),女,硕士研究生;陈盛霞(通讯作者),教授,博士生导师,E-mail:chensxia@ujs.edu.cn
2014-11-17 [编辑] 刘星星
