结直肠腺癌组织Caveolin-1表达与微淋巴管密度的关系及临床意义
2015-08-08郭飞薛军武雪亮宇宏峰屈明张鹏程孙光源胡晓峰王立坤
郭飞,薛军,武雪亮,宇宏峰,屈明,张鹏程,孙光源,胡晓峰,王立坤
(河北北方学院附属第一医院血管腺体外科,河北张家口075000)
结直肠腺癌组织Caveolin-1表达与微淋巴管密度的关系及临床意义
郭飞,薛军,武雪亮,宇宏峰,屈明,张鹏程,孙光源,胡晓峰,王立坤
(河北北方学院附属第一医院血管腺体外科,河北张家口075000)
目的:探索结直肠腺癌中Caveolin-1和微淋巴管密度(lymphatic microvessel density,LMVD)的关系及其与肿瘤临床病理特征和预后的关联。方法运用免疫组织化学法测定90例结直肠腺癌和45例正常结直肠组织中Caveolin-1的表达,并以D2-40为标记物,测定结直肠腺癌组织的LMVD,分析Caveolin-1和LMVD与临床病理参数之间的关联。结果:结直肠腺癌中Caveolin-1蛋白的阳性表达率(73.33%)明显高于正常结直肠组织(11.11%,P<0.01);结直肠腺癌中的LMVD值(18.25±2.36)明显高于正常结直肠组织(3.14±1.58,P<0.01);Caveolin-1表达程度和LMVD与肝转移、肿瘤浸润深度、淋巴结转移和TNM分期具有相关性(P<0.01);Caveolin-1表达阴性组的LMVD值明显低于阳性组(P<0.01);结论Caveolin-1在结直肠癌中的表达与微淋巴管生成密切相关,其表达和LMVD是结直肠癌患者的独立预后指标。
结直肠腺癌;Caveolin-1;微淋巴管密度;免疫组织化学
结直肠癌严重威胁人类的健康,是较常见的消化道恶性肿瘤,其发病率和病死率呈逐年上升趋势[1]。肿瘤的转移是决定患者预后的重要影响因素,而淋巴结转移是肿瘤转移的重要途径。微淋巴管密度(lymphaticmicrovessel density,LMVD)作为微淋巴管新生能力的重要指标,能够反映恶性肿瘤的进展程度[2]。Caveolin-1参与调控细胞的物质转运、信号转导、增殖分化、迁移、凋亡等,与肿瘤的发生发展密切相关,在肿瘤细胞侵袭转移过程中起重要作用[3]。D2-40是淋巴管内皮细胞特异性最高的标志物[4-5]。本研究拟采用免疫组织化学法测定Caveolin-1在结直肠腺癌组织和正常结直肠组织中的表达,同时在结直肠腺癌组织中运用D2-40标记LMVD,分析Caveolin-1和LMVD与临床病理参数及结直肠癌患者预后的关联。
1 材料与方法
1.1 材料来源
采集河北北方学院附属第一医院2012年7月至2014年7月胃肠肿瘤外科手术切除的90例结直肠癌组织。癌组织取自癌灶中心,另取其标本残端切缘,经病理证实为正常肠组织,共45例。全部病例都是原发性肿瘤,且术前未行新辅助放化疗及免疫治疗。结直肠癌组织中,男57例,女33例,年龄36~74(55.0±2.6)岁;正常结直肠组织中,男28例,女17例,年龄39~71(56.0±2.1)岁;2组一般资料比较差异均无统计学意义。
1.2 免疫组织化学方法及试剂
鼠抗人单克隆浓缩型Caveolin-1抗体(克隆号ab40278 R3-5G4)购于香港Abcam公司;鼠抗人单克隆D2-40抗体购自北京中杉金桥生物技术有限公司。
将部分取材标本速冻于液氮中,之后于-80℃保存;标本用10%甲醛固定,石蜡包埋,切片,厚3 μm。随后行HE染色,光镜下观察记录后作出病理诊断。切片于80℃烤箱烤30 min;然后脱水,枸橼酸缓冲液于140℃高压修复抗原,3%过氧化氢灭活内源性过氧化物酶;PBS洗3次,加一抗,4℃孵育过夜;PBS洗3次,加二抗,室温孵育20min;DAB工作液显色,显微镜下观察,苏木素复染,1%盐酸乙醇分化、流水冲洗、梯度乙醇脱水及松节油透明,最后树胶封片。阴性对照以PBS代替一抗,阳性对照则为已知的阳性片。
1.3 阳性结果的判定标准
1.3.1 Caveolin-1表达的判定 细胞质内和(或)细胞膜上出现棕黄色颗粒者为阳性细胞,结果判定借鉴Dorudi等[6]方法,综合考虑染色水平和阳性细胞数:阳性细胞所占百分比≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>76%为4分;观察着色水平并记录分值,无着色:0分,浅黄色:1分,黄色:2分,深黄色:3分。两者相乘,0分为(-),1~4分为(+),5~8分为(++),9~12分为(+++),(+)~(+++)均视为阳性。
1.3.2 LMVD检测 D2-40标记并计数LMVD,其阳性表达为棕黄色颗粒,定位于淋巴管内皮细胞的胞质和(或)胞膜。先于40倍视野选出热点区(4个脉管最密集的区域),然后于400倍视野将着色的单个及成簇的内皮细胞记为微淋巴管,并随机计数5个视野的微淋巴管数,取其平均值即为LMVD值。由2名病理高年资主治医师单独阅片后一并得出判定结果。
1.4 统计学方法
运用SPSS 17.0统计软件处理数据,计数资料用百分率表示,采用χ2检验,计量资料用±s表示,采用t检验,假设检验水平α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 Caveolin-1蛋白表达及LMVD值
结直肠癌组织中Caveolin-1蛋白的阳性表达率(73.33%,66/90)明显高于正常结直肠组织(11.11%,5/45),差异有统计学意义(χ2=33.56,P=0.000),见图1。结直肠癌组织中LMVD值(18.25±2.36)明显高于正常结直肠组织(3.14± 1.58),差异有统计学意义(t=32.00,P=0.000)。进一步相关分析显示,Caveolin-1的表达与LMVD值具有明显相关性(r=0.874,P=0.000)。
2.2 Caveolin-1蛋白的表达水平及LMVD值与临床病理参数间的关联
Caveolin-1蛋白的表达水平及LMVD值与患者肿瘤大小、分化程度、组织学类型、病变部位等临床病理参数无相关性(P均>0.05),而与肿瘤浸润深度、肝转移、淋巴结转移、肿瘤TNM分期相关(P<0.05或P<0.01)。见表2。
2.3 Caveolin-1在结直肠腺癌组织中的表达与LMVD的关联
在结直肠癌组织中,Caveolin-1表达阳性组LM-VD值(17.81±2.15)明显高于阴性组(6.15± 2.21),差异有统计学意义(t=21.42,P=0.000)。

图1 不同组织中Caveolin-1的表达(免疫组化×400)
3 讨论
Caveolin-1基因定位于染色体7q31上,系Caveolin-1家族成员之一,有α和β2个亚型,含有178个氨基酸残基,相对分子质量为22 000。Caveolin-1具有特殊的结构域,高度保守的疏水性氨基酸残基形成发夹结构嵌入细胞膜内,亲水的N端和C端分别位于细胞质两侧,N端氨基酸内含与多种信号分子活化中心相似的Caveolin结合序列,即Caveolin-1脚手架区(Caveolin-1 saffolding domain,CSD),能特异性地结合多种细胞信号蛋白,如G蛋白亚单位、Src、Fyn、HA2Ras、EGF受体、胰岛素受体、eNOS、PKC等,抑制其相关的作用及活性,并形成多条信号传导通路的枢纽,在细胞增殖、分化、迁移和凋亡等方面起重要的调控作用[7-8]。其C末端区域内含Tyr14磷酸化位点,Ab1、Frn、Src等酪氨酸激酶能使Tyr14位点磷酸化,在胞内信号的转导、细胞吞噬、迁移和黏附等过程中起调控作用[9]。此外,Caveolin-1能够抑制Ras/ERK、MAPK/ERK激酶系统,介导细胞过度增殖和凋亡,促进肿瘤细胞形成[10];Caveolin-1还可通过Ras-GRF1、P13K/Akt等途径致细胞周期停滞,诱导细胞凋亡。
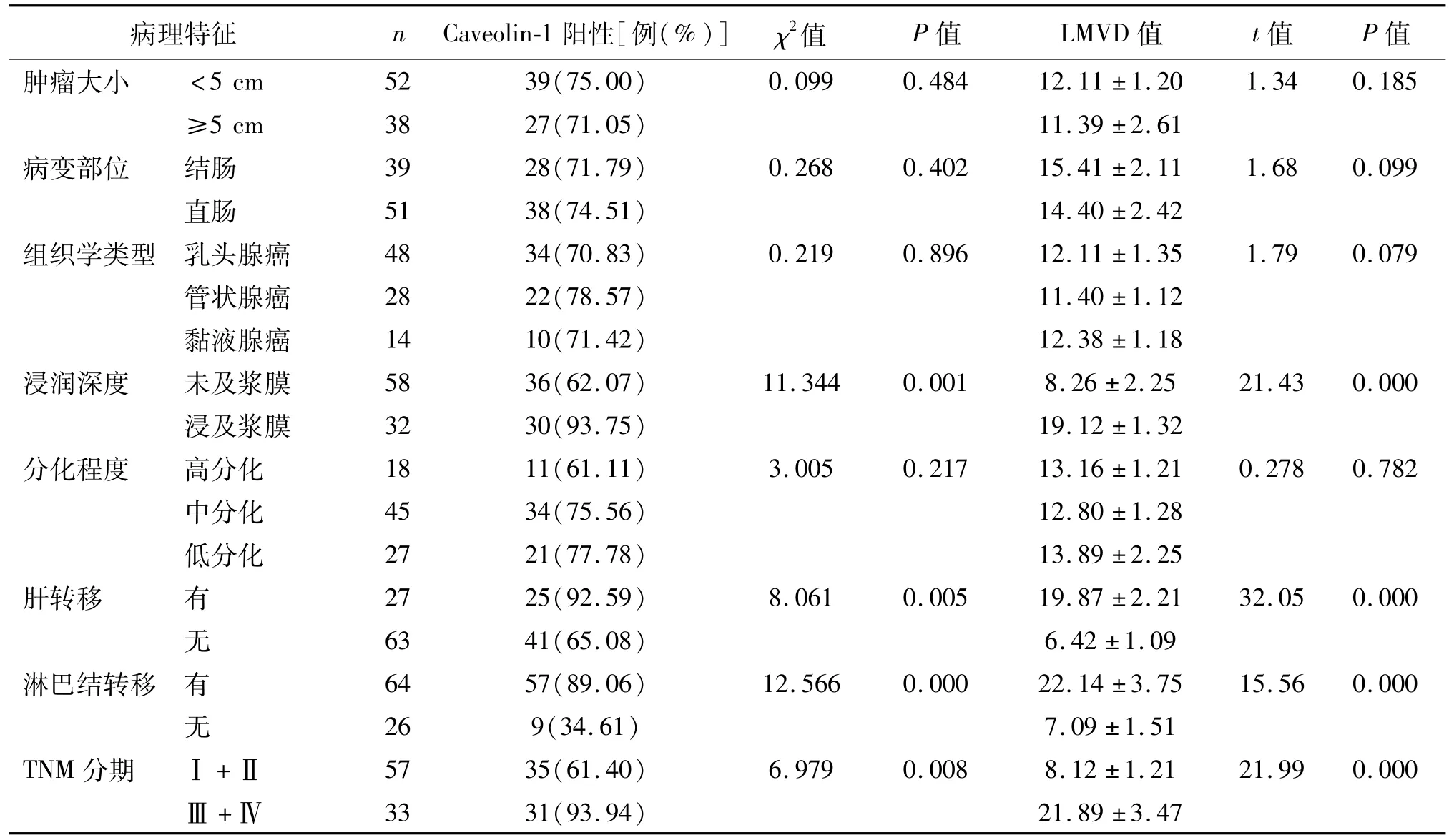
表2 结直肠癌组织中Caveolin-1、LMVD的表达与临床病例参数间的关系
本研究结果显示,Caveolin-1在结直肠腺癌组织中的阳性表达率高于正常结肠癌组织;且结直肠癌组织中Caveolin-1表达阳性组LMVD值明显高于阴性组,提示Caveolin-1蛋白高表达可能与结直肠腺癌的浸润、淋巴结转移密切相关。进一步研究显示,Caveolin-1阳性表达组LMVD值明显高于阴性组,考虑Caveolin-1在结直肠癌中可诱导淋巴管生成,增加肿瘤内LMVD,从而增强肿瘤的浸润性和侵袭力。
本实验结果显示,Caveolin-1蛋白表达与患者肿瘤大小、组织学类型、分化程度、病变部位等临床病理参数无关,而与肿瘤浸润深度、淋巴结转移、肝转移、肿瘤的TNM分期有关,这与杨胜兰等[11]研究结果大致相同;同样,LMVD值与患者肿瘤大小、组织学类型、分化程度、病变部位等临床病理参数无关,而与肿瘤浸润深度、淋巴结转移、肝转移、肿瘤的TNM分期有关,这与徐卫国等[12]的研究结果基本一致。
综上所述,Caveolin-1和LMVD是结直肠癌患者的独立预后指标,通过检测结直肠癌患者Caveolin-1水平和LMVD值有助于判断肿瘤的恶性程度,从而指导临床诊疗;然而Caveolin-1促进肿瘤淋巴管生成的具体机制目前尚不明确,尚需进一步研究。
[1] 代珍,郑荣寿,邹小农,等.中国结直肠癌发病趋势分析和预测[J].中华预防医学杂志,2012,46(7):598-603.
[2] 方义湖,黄琼,邓红,等.微淋巴管和微血管密度对结直肠癌的预后意义[J].临床与实验病理学杂志,2007,23(1):17-20.
[3] Ha TK,Chi SG.CAV1/Caveolin-1 enhances aerobic glycolysis in colon cancer cells via activation of SLC2A3/GLUT3 transcription[J].Autophagy,2012,8(11):1684-1685.
[4] 詹彦平,吕新玲,叶尔布拉提,等.微淋巴管密度与乳腺浸润性导管癌淋巴结转移的相关性研究[J].医学综述,2011,17(8):1246-1249.
[5] Saad RS,Kordunsky L,Liu YL,et al.Lymphatic microvessel density as prognosticmarker in colorectal cancer[J].Mod Pathol,2006,19(10):1317-1323.
[6] Dorudi S,Kinrade E,Marshall NC,et al.Genetic detection of lymph node micrometastases in patients with colorectal cancer[J].Br J Surg,1998,85(1):98-100.
[7] Nam Kh,Lee BL,Park JH,et al.Caveolin-1 expression correlateswith poor prognosis and focal adhesion kinase expression in gastric cancer[J].Pathobiology,2013,80(2):87-94.
[8] Basu Roy UK,Henkhaus RS,Loupakis F,etal.Caveolin-1 is a novel regulator of K-RAS-dependentmigration in colon carcinogenesis[J].J Int JCancer,2013,133(1):43-57.
[9] Zhou L,Ercolano E,Ammoun S,et al.Merlin-deficient human tumors show loss of contact inhibition and activation ofWnt/β-catenin signaling linked to the PDGFR/Src and Rac/PAK pathways[J].Neoplasia,2011,13(12):1101.
[10] Goetz JG,Lajoie P,Wiseman SM,et al.Caveolin-1 in tumor progression:the good,the bad and the ugly[J].Cancer Metastasis Rev,2008,27(4):715-735.
[11] 杨胜兰,黄璐,吴嫣然,等.CAV-1在结直肠癌患者肠黏膜中的表达及其意义探讨[J].中国中西医结合杂志,2014,22(8):430-433.
[12] 徐卫国,王宇鹏,郭志义,等.大肠癌组织中神经纤毛蛋白2的表达及其与肿瘤淋巴管生成和淋巴道转移的相关性[J].中华医学杂志,2012,92(46):3274-3278.
Correlation of Caveolin-1 expression w ith m icrolym phatic density in colorectal adenocarcinoma tissues and its clinical significance
GUO Fei,XUE Jun,WU Xue-liang,YU Hong-feng,QU Ming,ZHANG Peng-cheng,SUN Guang-yuan,HU Xiao-feng,WANG Li-kun
(Department of Vascular Gland Surgery,the First Affiliated Hospital of Hebei North University,Zhangjiakou Hebei075000,China)
Objective:To study the expression of Caveolin-1 in colorectal adenocarcinoma tissues and its correlation with microlymphatic density(LMVD),and to investigate the clinical pathological prognostic significance of Caveolin-1 and LMVD in patientswith colorectal cancer.M ethods:The expression of Caveolin-1 and LMVD in 45 specimens of normal colorectal tissues,and 90 specimens of colorectal adenocarcinoma tissueswere detected by immunohistochemistry technique.We also investigated the correlation between their expression and the clinicopathologic tissues features.ResultsThe positive rates of Caveolin-1 in colorectal adenocarcinoma(73.33%)were significantly higher than those in normal colorectal tissues(11.11%,P<0.01);The positive rates of LMVD in colorectal adenocarcinoma tissues(18.25±2.36)were significantly higher than those in normal colorectal tissues(3.14±1.58,P<0.01).Expression of Caveolin-1 and LMVD value was correlated with liver metastasis,lymph node metastasis,TNM stage and the depth of tumor invasion.Themean LMVD in group with Caveolin-1 positivity expression was significantly higher than in that with Caveolin-1 negativity expression.Conclusion:The expression of Caveolin-1 in colorectal cancer was closely related to lymphaticmicrovessel of tumor,and its expression and LMVD were independent prognostic indicators for patientswith colorectal cancer.
colorectal neplasms;Caveolin-1;microlymphatic density;immunohistochemistry
郭飞(1981—),男,主治医师,硕士,主要从事乳腺及消化系恶性肿瘤的基础与临床诊疗;薛军(通讯作者),主任医师,E-mail:yfyxuejun@163.com
R735.3 [文献标志码] A [文章编号] 1671-7783(2015)03-0225-04
10.13312/j.issn.1671-7783.y150015
张家口市科技局2013指令性计划(1311055D)
2015-01-27 [编辑]刘星星
