病毒载体介导β折叠阻断肽的表达及其对β淀粉样蛋白神经毒性的抑制作用
2015-08-08王兵刘晴晴夏春林刘朝晖
王兵,刘晴晴,夏春林,刘朝晖
(苏州大学医学部人体解剖与组织胚胎学系,江苏苏州215123)
病毒载体介导β折叠阻断肽的表达及其对β淀粉样蛋白神经毒性的抑制作用
王兵,刘晴晴,夏春林,刘朝晖
(苏州大学医学部人体解剖与组织胚胎学系,江苏苏州215123)
目的:通过病毒载体转染体外培养的海马神经元,观察后者表达分泌性的β折叠阻断肽(β-sheet breaker peptide,BSB)的生物活性。方法:采用分子克隆技术构建编码神经营养素4(neurotrophin-4,NT4)信号肽-BSB融合基因的重组腺伴随病毒(recombinant adeno-associated vrius,rAAV)载体,AAV在包装细胞系293细胞中进行包装,蔗糖梯度离心法纯化病毒颗粒,斑点杂交法测定重组病毒滴度。MTT检测及电镜观察BSB的生物学效应。结果:成功构建pSSHG/NT4-BSB质粒载体,纯化后获得滴度为3.6×1012~1.8×1013/m L的病毒颗粒。通过病毒感染培养的神经元分泌表达的BSB有效地抑制了β-淀粉样蛋白(Aβ)的纤维化聚集,明显降低了Aβ在体外的神经元毒性。结论:采用AAV载体介导的BSB短肽的分泌表达在体外培养的海马神经元中显示了良好的生物活性。
阿尔茨海默病;β折叠阻断肽;信号肽;腺伴随病毒
阿尔茨海默病(Alzheimer′s disease,AD)是一种神经退行性疾病,同时也归为蛋白质构象病[1]。蛋白质构象病是一类由于组织中特定的蛋白质发生了构象变化进而聚集并沉积所引起的疾病。除AD外,帕金森病、亨廷顿病、人海绵状脑病以及传统疾病镰刀型红细胞贫血等均属于蛋白质构象病[2]。虽然不同构象病的临床和病理表现各异,但共同特征表现为蛋白质的一级结构与正常相同,而二级结构或三级结构发生改变;与生理性蛋白质相比,异常蛋白质中含有较高的β折叠结构,且易聚集形成蛋白质低聚化体和聚集体。构象病所涉及的变构蛋白质包括AD中的β-淀粉样蛋白(Aβ)、帕金森病中的α-突触核蛋白(α-synuclein)、海绵状脑病中的朊蛋白以及镰刀细胞贫血中的血红蛋白等[3]。生理状态的可溶性Aβ为非淀粉样的无规则卷曲构象,而病理状态则为独特的二级结构,即β-折叠构象,易集聚,从而产生沉积并引起AD[4]。由此可见,可通过抑制或者逆转组织蛋白质的变构来防治该类疾病,如设计一种相关构象的短肽类似物,与蛋白质中发生构象改变的核心部位部分同源并结合,稳定靶构象的生理结构不向β折叠结构转变,从而抑制Aβ自聚形成聚合体,该短肽类似物称为β折叠阻断肽(βsheet breaker peptide,BSB)[5-6]。为此,我们构建腺伴随病毒(adeno-associated virus,AAV)载体重组信号肽与BSB基因,并通过AAV载体实现基因的有效转移和长期表达,现报告如下。
1 材料与方法
1.1 材料
1.1.1 试剂 Aβ25~35(北京肽合成中心),MTT、低聚赖氨酸(Sigma公司),DMEM、胰蛋白酶(Gibco公司),pGEM-T Easy质粒(Promega公司),胎牛血清、Bcl-2抗体、脑源性神经营养因子抗体及免疫组织化学染色试剂盒(武汉博士德生物工程公司),E co RⅠ、B am HⅠ限制性内切酶、Taq DNA聚合酶、T4DNA连接酶(华美生物工程公司)。
1.1.2 实验动物 取新出生的SD大鼠,无菌取脑并分离神经元。
1.2 设计NT4信号肽-阻断肽分泌表达框
将阻断肽KLVFF与神经营养素4(neurotrophin 4,NT4)信号肽序列拼接,构建重组AAV载体质粒pSSHG/NT4-KLVFF。根据目的序列:NaeⅠ克隆酶切位点-内肽酶裂解点-阻断肽KLVFF序列-终止密码子TAG-PvuⅡ鉴定酶切位点 Bam HⅠ克隆酶切位点(GC-GCCGGC-GTGGG-AAATTGGTGTTCTTT-TAGCAGCTG-GGATCC-CG,两端各为两个保护碱基)设计引物。序列如下:上游引物,GCGCCGGCGTGGGAAATTGGTGTTCTT;下游引物,CGGGATCCCAGCTGCTAAAAGAACACC。T4DNA连接酶连接PCR产物与质粒pGEM-T Easy,转钙化菌、提质粒并酶切鉴定,挑选阳性pGEM-T/KLVFF克隆,进行序列测定和分析。已构建好的pBV220/NT4质粒和pGEM-T/KLVFF质粒分别用NaeⅠ和Bam HⅠ行双酶切,得到含黏性末端的pBV220/NT4信号肽载体和KLVFF目的基因片段,T4DNA连接酶连接,得到NT4信号肽-内肽酶裂解点-阻断肽KLVFF-终止子的阻断肽真核分泌专用表达质粒(NT4-KLVFF),连接产物转钙化菌、提质粒并酶切鉴定,挑选阳性克隆,最后装入重组AAV载体质粒pSSHG/NT4-KLVFF。
1.3 包装重组AAV
复苏人胚肾293病毒包装细胞,至细胞生长至80%成片时,用磷酸钙沉淀法将重组质粒pSSHG/ NT4-KLVFF、包装质粒pAAV/Ad及腺病毒辅助质粒pFG140共转染293细胞,3 d后收集病毒,蔗糖梯度离心法进行纯化。
1.4 斑点杂交法确定病毒滴度
取50μL纯化的病毒液,加入蛋白酶K溶液降解病毒衣壳蛋白,提取病毒DNA。以确定浓度的标准pSSHG/NT4-KLVFF质粒梯度稀释作为对照,与提取的病毒DNA梯度稀释点样于NC膜上,用合成的地高辛标志CMV启动子探针进行杂交(PCMV,病毒载体质粒pSSHG中采用CMV启动子作为外源基因的启动子),68℃,20 h,地高辛与酶复合物于37℃作用30 min,显色液显色,与标准质粒对照比较确定病毒DNA浓度。根据1 bp DNA相对分子质量为635,pSSHG/NT4-KLVFF质粒为5.3 kb,则pSSHG/ NT4-KLVFF核酸相对分子质量为5 300×635= 3.37×106,10 ng病毒DNA样品摩尔量为1×10-8g/3.37×106=3×10-15mol,根据1 mol为6.02× 1023个分子,推算10 ng病毒DNA的分子数目为3× 10-15mol×6.02×1023=1.81×109。
1.5 电镜观察分泌表达的阻断肽抑制Aβ的纤维化聚集
取新生大鼠的脑并分离出海马,0.25%胰蛋白酶消化。收集分离的海马神经元并重悬于DMEM中,按1×106/mL的密度接种于培养瓶。第2天在培养基中加入AAV颗粒进行感染,2 d后换液,再次换液时离心取上清液,微孔滤膜过滤去除杂质,将常规培养的神经元上清液与Aβ40肽混合作为对照,将分泌表达阻断肽KLVFF上清液与Aβ40肽混合,37℃孵育72 h,磷钨酸负染,电子显微镜下观察细胞纤维化状态。
1.6 MTT检测分析阻断肽对Aβ神经元毒性的保护作用
同“1.5”将分离的海马神经元接种于96孔板,24 h后添加阿糖胞苷以抑制非神经元生长。将细胞随机分为对照组、Aβ损伤组和BSB保护组,BSB保护组在培养第3天于培养液中加入AAV颗粒感染神经元,对照组和Aβ损伤组常规换液;3 d后,BSB保护组和Aβ损伤组添加10μL/孔Aβ,使终浓度为20μmol/L。2 d后加MTT,20μL/孔,37℃孵育4 h。每孔加入150μL二甲基亚砜,溶解蓝色结晶,振荡,多孔扫描分光光度计于490 nm波长测定光密度值(D)。
1.7 统计方法
用SPSS 10.0数理统计软件处理数据,运用组间单因素方差分析检验,数据用±s表示。P<0.05为差异有统计学意义。
2 结果
2.1 NT4信号肽-阻断肽分泌表达框的设计
根据所需的基因元件及酶切克隆位点,同时符合开放阅读框(ORF)的原则,设计NT4信号肽-阻断肽分泌表达框,见图1。

图1 NT4信号肽-阻断肽真核分泌表达框
2.2 KLVFF阻断肽与NT4信号肽序列的拼接
将pBV220/NT4质粒和pGEM-T/KLVFF质粒分别用NaeⅠ和Bam HⅠ双酶切,连接后得到阻断肽真核分泌(NT4-KLVFF)专用表达质粒NT4信号肽-内肽酶裂解点-阻断肽KLVFF-终止子,见图2。pBV220/NT4-KLVFF质粒用Eco RⅠ和Bam HⅠ双酶切鉴定,得到3.63 kb pBV220载体片段和270 bp目的基因片段,用PvuⅡ酶切鉴定,得到3.9 kb线性化基因片段,与预期结果相符。见图3。

图2 阻断肽表达质粒pBV220/NT4-KLVFF的构建
2.3 重组AAV载体质粒pSSHG/NT4-BSB的构建
将pBV220/NT4-KLVFF质粒和pSSHG-CMV质粒分别用限制性内切酶Eco RⅠ和Bam HⅠ双酶切,得到NT4-BSB基因片段及线性化的pSSHG载体,T4DNA连接酶连接获得pSSHG/NT4-KLVFF(图4)。pSSHG/NT4-KLVFF质粒用Eco RⅠ和Bam HⅠ双酶切鉴定,结果如图5所示,得到预期的5 020 bp pSSHG载体片段和270 bp目的基因片段,Bam HⅠ单酶切鉴定,得到5 300 bp线性化基因片段。基因序列测定结果显示,NT4-KLVFF与设计序列完全相符。

图3 pBV220/NT4-KLVFF质粒酶切鉴定结果
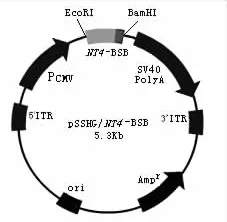
图4 重组AAV载体质粒pSSHG/NT4-BSB

图5 pSSHG/NT4-BSB质粒酶切鉴定结果
2.4 病毒滴度的斑点杂交结果
结果显示,病毒DNA样品的显色深度在pSSHG/NT4-BSB质粒标准品的50~100 ng/μL之间(图6),推算病毒DNA浓度在50~100 ng/μL之间时病毒数量为3.6×109~1.8×1010病毒颗粒/ μL,即病毒滴度为3.6×1012~1.8×1013病毒颗粒/mL。
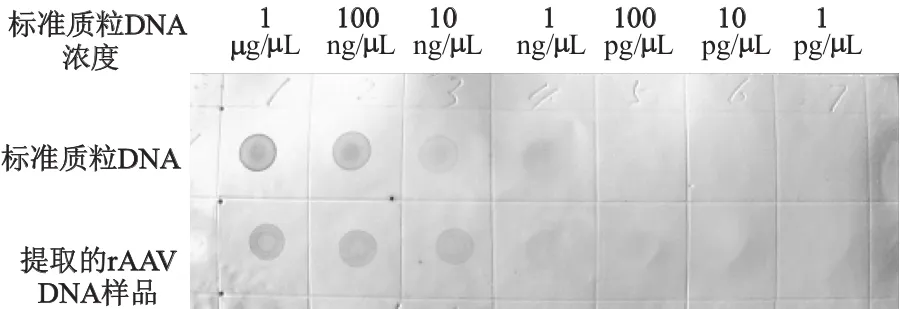
图6 病毒滴度的DNA斑点杂交结果
2.5 BSB抗Aβ的神经元保护效应
图7结果显示,与对照组相比,Aβ损伤组存活率明显降低(t=9.37,P<0.05);BSB保护组细胞存活率较Aβ损伤组增高(t=8.45,P<0.05),显示了分泌表达的BSB对Aβ神经元损伤的抑制作用。图8显示,Aβ40肽单独孵育组孵育7 d后可见Aβ肽凝集形成,以淀粉样纤维结构为主;共同孵育组中BSB有效地减少了Aβ40肽的聚集,仅有少量淀粉样纤维相互聚集,纤维周围伴随大量的无定形结构,表明分泌表达的BSB能有效地抑制Aβ的纤维化。
3 讨论
AD发病机制的中心事件是Aβ以不溶性纤维的形式聚集于细胞外并沉积形成神经炎斑块[7]。生理情况下,Aβ为可溶性肽,存在于人的体液循环中并具有正常的生理功能,但在AD患者脑内,Aβ含量增高和异常的Aβ增多致其集聚并产生神经毒性。Aβ1-42肽的全长氨基酸序列为DAEFR HDSGY EVHHQ KLVFF AEDVG SNKGA IIGLM VGGVV IA,氨基端为中心疏水区,第16~20个氨基酸残基为KLVFF,是Aβ分子间相互作用的重要部位。在聚集的淀粉样纤维中,相邻Aβ肽链的KLVFF序列紧密靠拢形成平行或反向平行的β折叠结构。用亲水氨基酸取代KLVFF序列的疏水氨基酸显示Aβ纤维化能力降低;一些可在体外调节Aβ淀粉样聚集物形成的调节剂,如金属离子、蛋白多糖、ApoE等,也是通过KLVFF序列及邻近的氨基酸残基而发挥调节作用[8]。研究表明,五肽配基是识别结合序列的最小长度且能通过相似的分子间相互作用有效结合于Aβ,竞争性抑制Aβ分子间的结合,阻止Aβ形成淀粉样纤维[9]。Tjernberg等[10]和Findeis等[11]等研究证实,五肽配基KLVFF亲和力最强,能抑制纤维形成及其引起的细胞毒性。阻断淀粉样形成的治疗方案优势在于其不影响任何已知的生物学作用,即不会干扰正常的组织和细胞功能[12-13]。
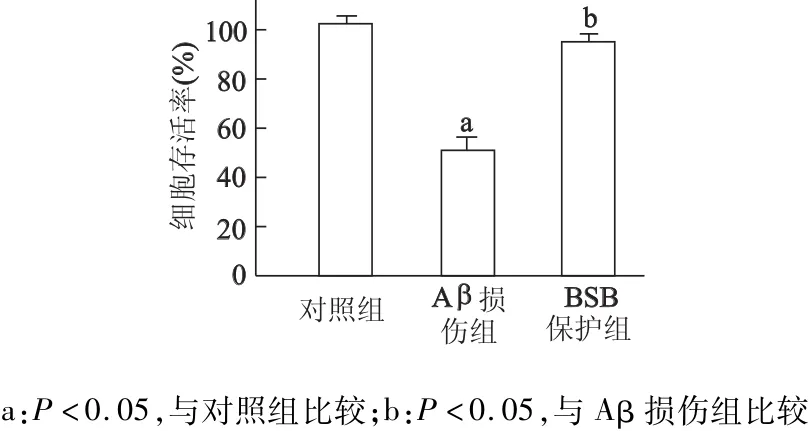
图7 各组细胞存活率的比较
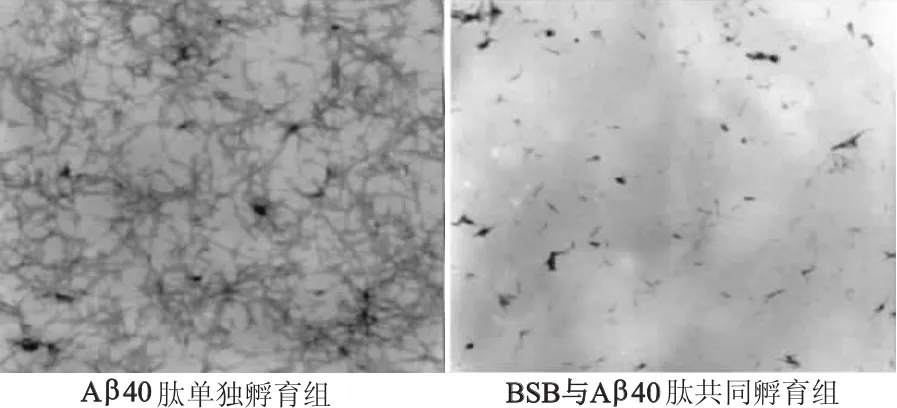
图8 BSB对Aβ纤维化的抑制作用(电镜×5 000)
许多生物活性肽的含量极低但生理作用非常强,是多种疾病的良好的临床治疗药物。但是,肽的人工合成成本高,在体内易被分解,生物利用度差,血脑脊液屏障通过率低,大多数不能口服需注射给药。对此,研究人员在对中枢神经系统疾病肽类治疗药物的开发中进行了多项改善工作,包括进行末端保护、改变手性结构、引入非天然氨基酸等提高稳定性,延长其半衰期;用多胺对肽进行共价修饰提高其透过血脑脊液屏障的能力[14]。本研究中,我们避开肽类药物的结构改造,尝试使用病毒载体介导短肽基因在神经元内的表达,以期寻找新的给药方式使治疗短肽能在脑内长期表达起到治疗AD的作用。
Aβ发生聚集进而沉积并产生神经毒性主要发生在细胞外,那么我们首先需要解决阻断肽的分泌表达,致其能够分泌至细胞外与Aβ作用。为此,我们设计了NT4信号肽与BSB融合表达的策略。NT4信号肽是NT4成熟肽于胞外分泌表达时的一段前导肽,可引导成熟肽出胞并在经过胞膜时通过内肽酶切点切下信号肽,从而将成熟肽分泌至胞外。通过基因序列分析,在NT4内肽酶切点前找到了合适的克隆酶切位点NaeⅠ,可将NT4自身序列切下并连入设计的外源基因。我们已经利用NT4的信号肽进行了多个肽的分泌表达,表明NT4的信号肽序列是一个非常好的引导短肽分泌到细胞外的前导序列[15-16]。AAV载体是近年来采用的高效基因转移载体,几乎能感染所有组织来源的分裂和非分裂细胞,尤其神经元这种分化终末细胞最为常用,可将携带的目的基因整合至宿主细胞的基因组并得以长期表达。
本实验中,我们通过构建AAV的阻断肽分泌表达载体,成功转染了大鼠海马神经元,BSB的表达能有效抑制Aβ的纤维化聚集,减轻Aβ对神经元的损伤。基于此,我们以后将进一步探讨AAV介导的BSB分泌表达在AD转基因动物模型中的生物学作用。
[1] Tiwari SK,Chaturvedi RK.Peptide therapeutics in neurodegenerative disorders[J].Curr Med Chem,2014,21(23):2610-2631.
[2] Clippingdale AB,Wade JD,Barrow CJ.The amyloid-β peptide and its role in Alzheimer′s disease[J].JPept Sci,2001,7(5):227-249.
[3] Kuner P,Bohrmann B,Tjernberg LO,etal.Controlling polymerization ofβ-amyloid and prion-derived peptides with synthetic smallmolecule ligands[J].JBiol Chem,2000,275(3):1673-1678.
[4] Liu J,WangW,Zhang Q,et al.Study on the efficiency and interaction mechanism of a decapeptide inhibitor ofβ-amyloid aggregation[J].Biomacromolecules,2014,15(3):931-939.
[5] Lin LX,Bo XY,Tan YZ,et al.Feasibility ofβ-sheet breaker peptide-H102 treatment for Alzheimer′s disease based onβ-amyloid hypothesis[J].PLoSOne,2014,9(11):e112052.
[6] Chini MG,Scrima M,D′Ursi AM,et al.Fibril aggregation inhibitory activity of theβ-sheetbreaker peptides:amolecular docking approach[J].JPept Sci,2009,15(3):229-234.
[7] Soto C.Unfolding the role of protein misfolding in neurodegenerative diseases[J].Nat Rev Neurosci,2003,4(1):49-60.
[8] Hetényi C,Körtvélyesi T,Penke B.Mapping of possible binding sequences of twoβ-sheet breaker peptides onβamyloid peptide of Alzheimer′s disease[J].Bioorg Med Chem,2002,10(5):1587-1593.
[9] Murvai U,Soós K,Penke B,et al.Effect of theβsheet-breaker peptide LPFFD on oriented network of amyloidβ25-35 fibrils[J].J Mol Recognit,2011,24(3):453-460.
[10] Tjernberg LO,Näslund J,Lindqvist F,et al.Arrest of β-amyloid fibril formation by a pentapeptide ligand[J].JBiol Chem,1996,271(15):8545-8548.
[11] Findeis MA,Musso GM,Arico-Muendel CC,et al.Modified-peptide inhibitors of amyloidβ-peptide polymerization[J].Biochemistry,1999,38(21):6791-6800.
[12] Bieler S,Soto C.β-sheet breakers for Alzheimer′s disease therapy[J].Curr Drug Targets,2004,5(6):553-558.
[13] Soto C,Estrada L.Amyloid inhibitors andβ-sheet breakers[J].Subcell Biochem,2005,38:351-364.
[14] Lauta VM.Pharmacological elements in clinical application of synthetic peptides[J].Fundam Clin Pharmacol,2000,14(5):425-442.
[15] 祝康,郑国玺,韦俊荣,等.重组腺相关病毒rAAVNT4-ADNF-9的构建及其对体外培养的大鼠耳蜗组织的转染[J].江苏大学学报:医学版,2008,18(4):277-280.
[16] 杨宇,杨欣,孙欣,等.可分泌表达神经保护肽的重组慢病毒对闭合性脑损伤小鼠的神经保护作用[J].吉林大学学报:医学版,2010,36(4):616-619.
A viral vector expressing secretoryβsheet breaker peptide inhibited Aβneuronal toxicity
WANG Bing,LIU Qing-qing,XIAChun-lin,LIU Zhao-hui
(Department of Human Anatomy&Histology and Embryology,Medical School of Soochow University,Suzhou Jiangsu 215123,China)
Objective:To observe biological activity of secretoryβsheet breaker peptide(BSB)expressed via a viral vector in cultured hippocampal neurons.M ethods:We constructed the recombinantadeno-associated virus(rAAV)encoding fusion gene of neurotrophin-4(NT-4)signal peptide and BSB bymolecular cloning technique.The viruswere produced in 293 packaging cell lines of the AAV and purified by sucrose gradient centrifugation.The viral titer was determined by dot blot hybridization.The biological effects of expressive BSB in vitro were observed by MTT assay and electron microscopy.Results:The pSSHG/NT4-BSB plasmid was constructed successfully.The physical titer of recombinant AAV was 1×1011-1×1012virions/mL after purification.The BSB,secretive expression in AAV transfected cultured hippocampal neuron,inhibited Aβfibrosis aggregation and significantly decreased the neurotoxicity of Aβin cultured hippocampal neuron.Conclusion:AAV vectormediated secretive expression of BSB peptide displayed effective biological effect in vitro cultured neurons.
Alzheimer′s disease;β-sheet breaker peptide;signal peptide;adeno-associated virus
R393;R749.16 [文献标志码] A [文章编号] 1671-7783(2015)03-0212-05
10.13312/j.issn.1671-7783.y150051
王兵(1988—),男,硕士研究生;刘朝晖(通讯作者),教授,博士生导师,E-mail:zhliu@suda.edu.cn
2015-03-19 [编辑] 刘星星
