滇楸幼苗无性系光合特性的比较1)
2015-08-08黄国伟陈慧玲包一鸣刘少锋张新叶
黄国伟 陈慧玲 包一鸣 刘少锋 张新叶
(湖北省林业科学研究院,武汉,430079) (湖北省林科院石首杨树研究所) (湖北省林业科学研究院)
楸树(Catalpa bungei C.A.MeY.)是紫葳科(Bignoniaceae)梓树属(Catalpa Scop.)落叶乔木,为我国著名的优质珍贵用材树种和园林观赏树种,分布范围位于北纬 22°~42°,东经 88°~123°之间,豫西地区为中心分布区[1]。由于过度砍伐,目前存在的楸树天然片林极少。为了更好的保护和利用这一珍贵资源,国内很多适种地区进行了引种试验,并开展了多方面相关研究,其中不乏光合特征方面的研究。麻文俊等[2]研究表明,楸树受到低N胁迫时,净光合速率比正常水平下降50%以上;王改萍等[3]采用盆栽控水和PEG(聚乙二醇)人工模拟干早胁迫的方法,证明随着干早胁迫程度的逐渐增加,楸树净光合速率、气孔导度、水分利用效率均明显下降,胞间CO2浓度逐渐上升;孙嘏等[4]的研究结果表明,楸树光饱和点为 1 200 μmol·m-2·s-1,光补偿点50~90 μmol·m-2·s-1;赵曦阳等[5]发现,楸树的光合日变化为双峰曲线,气孔限制是光合“午休”的主要调节因素;王力朋等[6]测量分析表明,8月份的楸树净光合速率和水分利用效率分别为12~17 μmol·m-2·s-1、3.5~4.6 mmol·mol-1。这些研究从不同角度阐述了楸树光合特征变化及对外界影响因子的响应,但涉及楸树苗期在自然条件下,遭遇严重干旱胁迫时,对光合特征的变化规律的研究鲜有报道。
从2009年开始,湖北省林业科学研究院先后引进了楸树(Catalpa bungei)、灰楸(Catalpa fargesii Bur)、滇楸(Catalpa duclouxii)以及杂交子代等丰富的楸树遗传资源,在江汉平原进行引种试验,并开展适宜本地区生长的楸树优良品种选育研究。2013年江汉平原遭遇罕见的伏天大旱,室外30℃以上高温和晴天持续30 d以上,楸树幼苗生长缓慢近乎停滞。鉴于尚未对江汉平原引种的楸树遗传资源做过光合特征方面的研究与评价。因此,本研究以江汉平原引种且生长良好的滇楸无性系作为试验材料,以两个楸树无性系为对照,对其苗期遭受干旱高温胁迫下的光合响应进行研究。旨在评价江汉平原引种的滇楸无性系的光合能力和适应性,为江汉平原选育抗性强、生长迅速的优良新品种提供理论基础和依据。
1 材料与方法
1.1 试验材料
试验材料由“国家林木种质资源平台——云杉种质资源保存库”提供。从引种的滇楸无性系中选出苗期表现较好的5个无性系,编号分别为:Y-023-2,Y-011-4,Y-011-1,YN-014-5,Y-020-6。2012年在江汉平原(湖北石首)嫁接繁育,2013年挑选生长良好一致的单株,按4株小区3次重复随机区组排列,截干后大田栽植,株行距为4 m×2 m。以中国林业科学研究院选育的优良无性系8402和008-1作为对照,常规田间管理。8月上旬进行光合和生长数据测量,12月份落叶后再次进行生长数据测量,光合特征测量叶片为树干中部南面由上至下的3片叶子。
1.2 测量指标与方法
苗高和基径:苗高是指从嫁接口到顶稍的高度,基径是指留下的萌芽形成主干的基部直径,6次重复。
光合有效辐射(PAR)、净光合速率(Pn):采用美国里格公司生产的LI-6400XT光合测定系统,选择晴朗无风的天气,在8:30—11:30和14:30—16:30,测定光合有效辐射值,PAR值在 0~2 000 μmol·m-2·s-1范围内,设定 13 个梯度,即:2 000、1 500、1 000、800、600、400、200、120、80、60、40、20、0 μmol·m-2·s-1。从 7:00—17:00,每隔 2 h测量 Pn1次。采用透明叶室,仪器同时记录的有PAR、叶片温度、空气相对湿度、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)等,通过系统自动测量程序测定相应的Pn,3 次重复。
1.3 数据处理
用Excel2007进行数据处理,通过SPSS19.0统计软件进行方差分析和多重比较(采用Duncan新复极差法)及相关性分析。
瞬时水分利用效率(WUE)计算公式为:
WUE=Pn/Tr。
式中:WUE为瞬时水分利用效率;Pn为净光合速率;Tr为叶片蒸腾速率。
单位叶面积光合特征日总量:
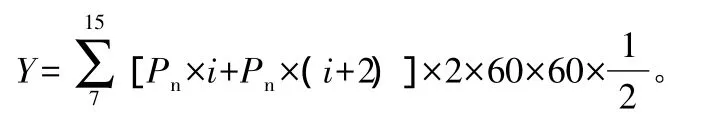
式中:Pn×i指一天中i时的净光合速率;Y为单位面积净光合日总量(7:00~17:00),i=7,9,11,13,15;Pn换为Gs时,Y为气孔导度单位面积日总量(7:00~17:00)[7]。
选用的光响应曲线拟合方程为[8-9]:
Pn=(PΦPAR/[1+(PΦPAR/Pnmax)P]1/P)+Rd。
式中:Pn为净光合速率;Pnmax为最大净光合速率;PΦ为叶片在低光下的光合速率,对于碳3植物为0.05[10];PAR为光合有效辐射;P 为曲角,它描述了光响应曲线的弯曲程度,即表观量子光合效率(AQY);Rd为暗呼吸速率。PAR在 0~200 μmol·m-2·s-1的Pn测量值近似一条直线,利用直线拟合可求出光补偿点(LCP)和光饱和点(LSP)[11-13]。
2 结果与分析
2.1 不同无性系生长性状比较
对各无性系8月份和12月份的苗高和基径进行比较发现(见表1):8月份苗高范围在69.33~125.33 cm,8402值最小,且与除 Y-011-1外的无性系差异显著,5个滇楸无性系之间无显著差异;12月份008-1与其余无性系苗高差异均显著,5个滇楸无性系之间无显著差异;8月到12月苗高生长量范围为88.5~298 cm。8月份和12月份各无性系的基径多重比较发现,均无显著性差异,4个月的生长量范围为8.84~12.19 mm,基径生长缓慢。各无性系苗高和基径基本都明显小于楸树在非干旱胁迫下的生长速度。
2.2 不同无性系气体交换特征日变化比较
从图1可以看出,早上7:00时,叶片温度即达到了34℃左右,从9:00到17:00,叶片温度更是持续高达38℃以上;空气相对湿度从早上7:00的65.73%一路下滑至15:00的43.08%,之后17:00微升至 50.29%;全天 PAR也基本维持在 1 200 μmol·m-2·s-1以上,可以看出,幼苗受到了高温、干旱和强光照的长时间胁迫。
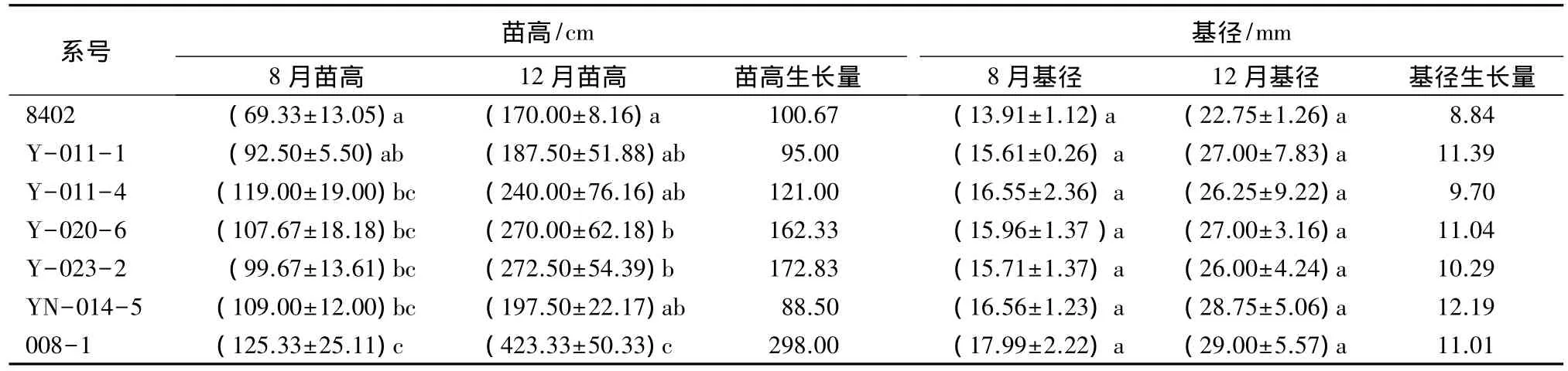
表1 各无性系苗高和基径比较
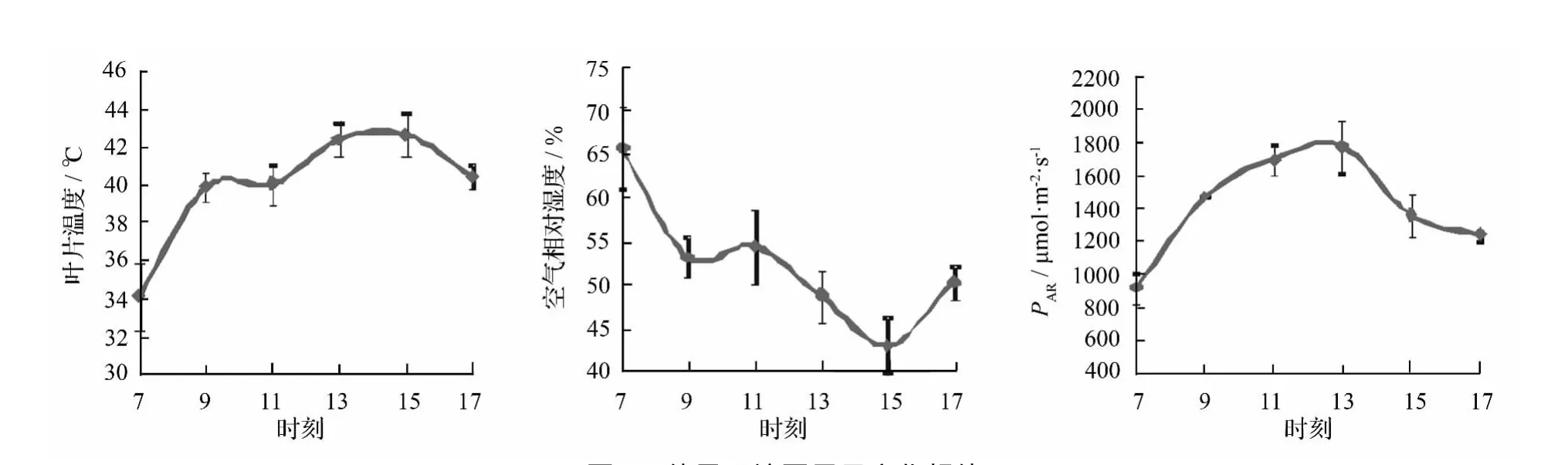
图1 外界环境因子日变化规律
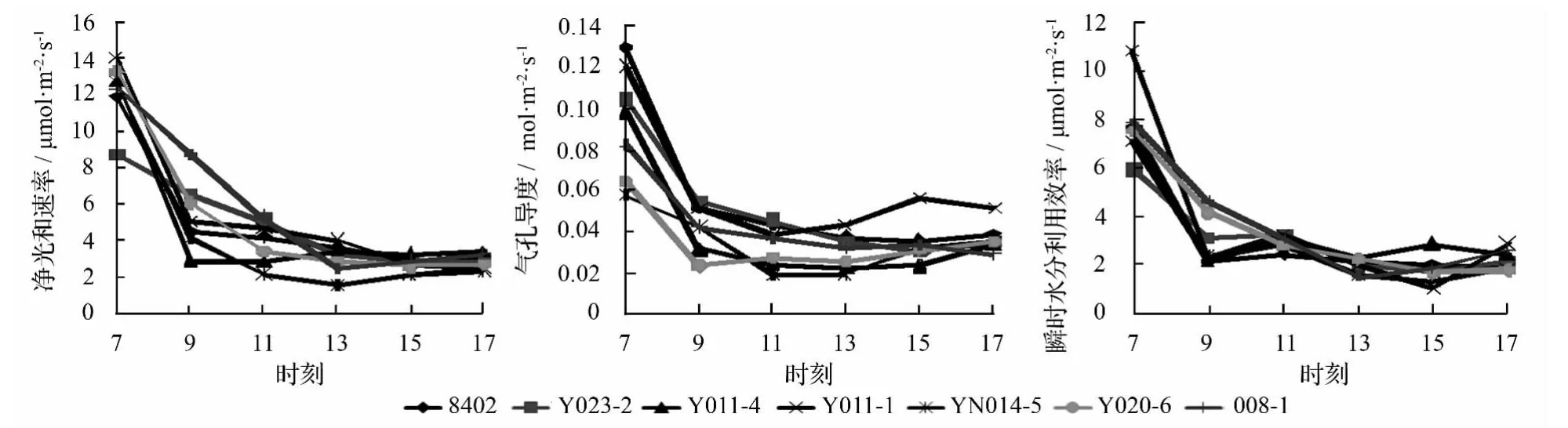
图2 各无性系光合特征日变化规律
各无性系 Pn、Gs、WUE日变化规律几乎一致,可见Pn的变化主要是因为气孔因素引起的(见图2)。所有无性系的 Pn早上 7:00 在 8~14 μmol·m-2·s-1,之后直线下滑,从9:00—17:00全部维持在2~6 μmol·m-2·s-1的低位,表现出严重的胁迫现象;所有无性系Gs均是 7:00时最大,范围在 0.06~0.13 mol·m-2·s-1,随温度和光照强度升高,9:00 时气孔已大量关闭,从9:00—17:00 Gs均在0.05 mol·m-2·s-1以下;WUE同样在 7:00 时最大,范围为 8~14 μmol·mmol-1,9:00 后下降至 3.2 μmol·mmol-1以下。各无性系光合特征的日变化规律与楸树苗期正常条件下的日变化规律表现出明显的差异。
由于Pn日变化差异较大,而单位面积净光合日总量则反映了一天中单位面积叶片利用光能生产有机物的总量,是光合能力的重要指标。对Pn、Gs进行日积累计算,WUE则用一天的平均值表示(见表2),比较发现,各无性系Pn日总量由大到小的顺序为:008-1、Y011-1、Y023-2、Y020-6、8402、Y011-4、YN014-5;WUE日均值由大到小的顺序为:008-1、Y011-4、YN014-5、Y020-6、Y011-1、Y023-2、8402。
2.3 不同无性系光合—光响应曲线分析
总体趋势上符合光合—光响应曲线变化规律,当 PAR从 0~200 μmol·m-2·s-1时,各无性系 Pn呈线性增加,PAR在 200~600 μmol·m-2·s-1时,Pn增加速度明显放缓,超过 600 μmol·m-2·s-1后,部分无性系既表现出明显的光抑制现象,所有无性系Pn趋于平缓甚至减小,光抑制现象比正常环境下生长的楸树有所提前。相对来说,008-1和Y020-6表现出更好的光合能力和光强适应性,而Y023-2和8402则表现出较差的光合能力和光强适应性。
对各无性系光合—光响应曲线拟合特征值比较发现(见表3):不同系号各特征值变化范围较大,LSP在 324 ~796 μmol·m-2·s-1,大大低于楸树苗期正常条件下 LSP(1 200 μmol·m-2·s-1);LCP在 16~80 μmol·m-2·s-1,对照 008-1 对弱光的利用能力较强;AQY反映了光能转化效率,不同无性系间由大到小的顺序为:008-1、8402、Y023-2、Y011-4、Y020-6、Y011-1、YN014-5;所有系号中 Y011-1 暗呼吸速率最小(Rd=0.93 μmol·m-2·s-1),仅为暗呼吸速率最高系号 Y023-2(Rd=2.04 μmol·m-2·s-1)的46%;Pnmax作为反映光合潜力的重要指标,各系号间由大到小的顺序表现为:008-1、Y020-6、Y011-4、Y011-1、YN014-5、8402、Y023-2。
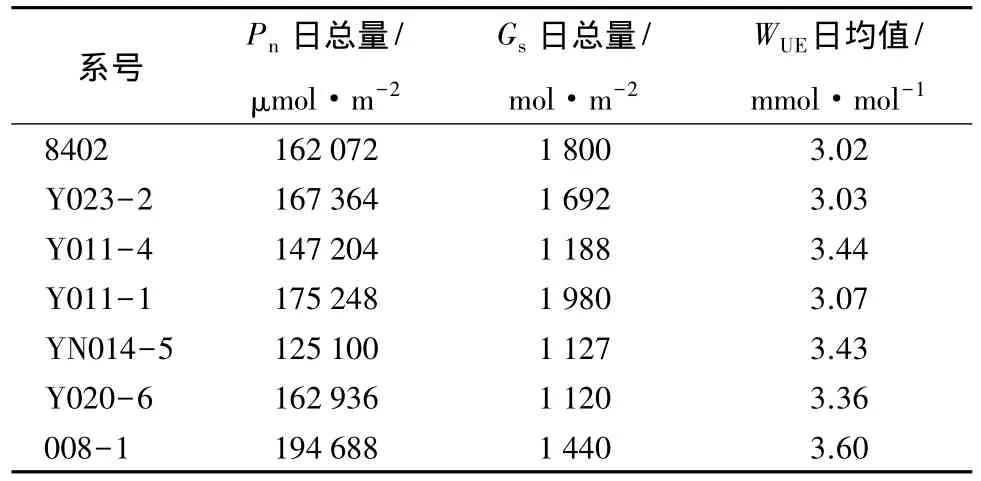
表2 各无性系Pn日总量、Gs日总量、WUE日均值的比较
2.4 生长性状与光合特征相关性分析
进一步对生长性状和光合特征进行相关分析发现:苗高与基径、WUE日均值呈极显著正相关(P<0.01),与 LSP、Pnmax呈显著正相关(P<0.05),与 Gs日积累显著负相关(P<0.05);基径与WUE日均值呈极显著正相关(P<0.01),与 LSP、Pnmax呈显著正相关(P<0.05);Gs日积累与WUE日均值呈显著负相关(P<0.05),与 LSP呈极显著负相关(P<0.01);WUE日均值与LSP和Pnmax呈显著和极显著正相关(P<0.05)。从结果可以看出,各无性系生长性状和光合特征均与WUE密切相关,当受到干旱胁迫时,WUE高低变得尤为重要。
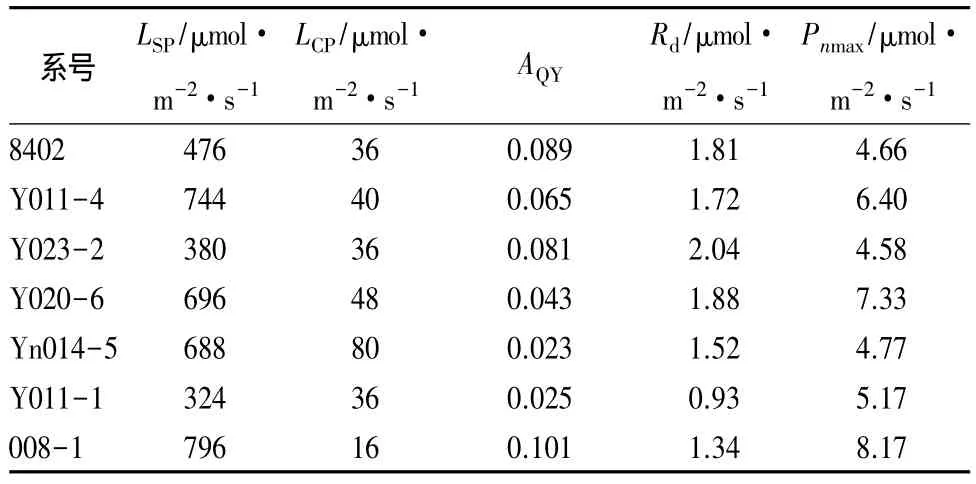
表3 各无性系光合—光响应曲线拟合特征值比较
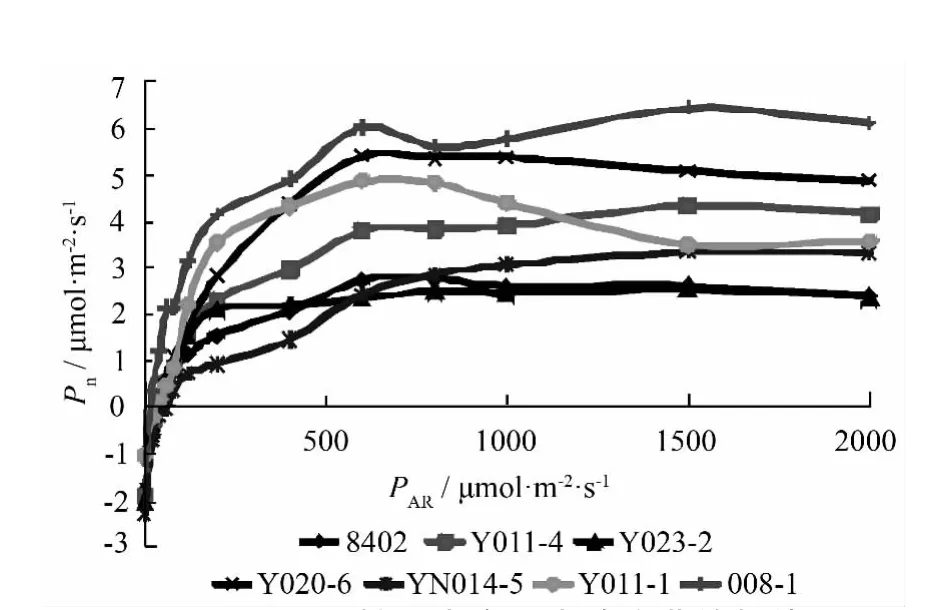
图3 不同无性系光合—光响应曲线规律
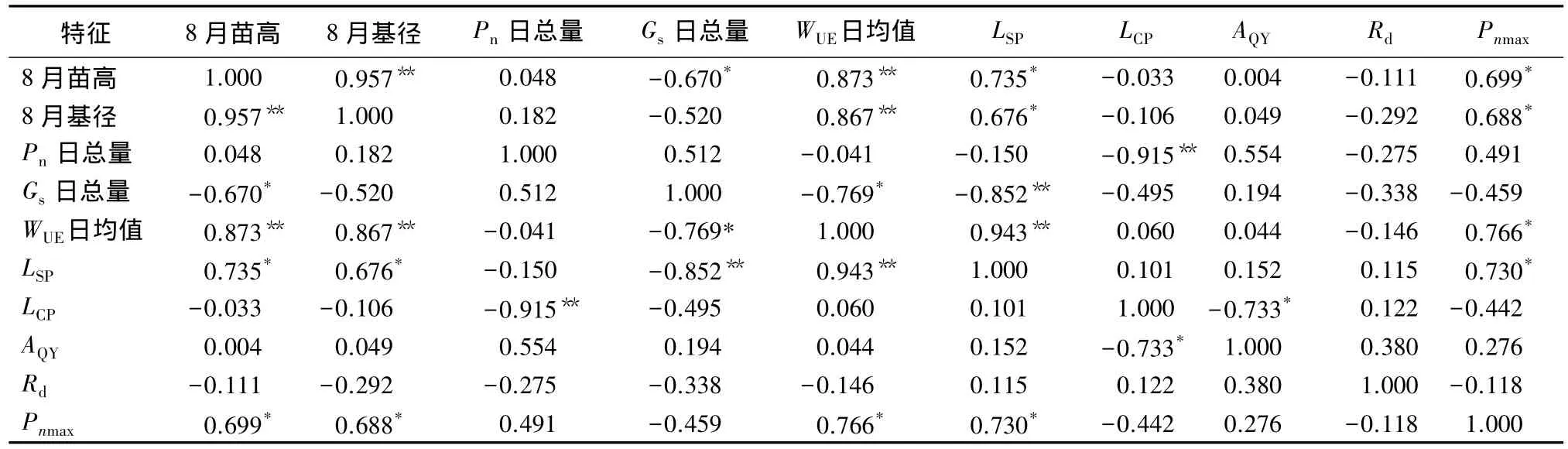
表4 生长性状和光合特征相关分析
3 结论与讨论
从各无性系的生长性状上看,由于受到严重的干旱胁迫,苗高和基径生长缓慢,特别是不同系号基径均值都较小,没有表现出显著差异,8—12月的生长量 8.84~12.19 mm,远小于江汉平原正常情况下20 mm以上的生长量。不同系号显著差异只在苗高上有所表现,但苗高也明显小于正常值。5个滇楸无性系生长性状间均无显著差异,表现较稳定。干旱严重制约了楸树苗期的生长量,这与他人的人工模拟干旱试验结果一致[3]。
持续的高温天气(38℃)和强烈的光强辐射(1 400 μmol·m-2·s-1),空气湿度大大降低,从光合日变化规律可以看出,Pn、Gs和WUE变化规律一致,均没有表现出单峰或者双峰型曲线,仅在早晨短时间内,空气温度较低,湿度较大时,可以正常的进行光合作用,随温度和光强的快速升高,叶片气孔大量关闭,Pn快速下降,主要是受气孔因素限制[14],通过关闭气孔减少蒸腾散失,保留水分以维持生命需要。通过Pn日积累以及WUE日均值化作用极为显著;无机盐质量分数与培养条件对花芽分化率影响显著,适宜的无机盐质量分数与适宜的培养条件可有效提高花芽分化率,但并非诱导春石斛(Dendrobium nobile‘Huoniao’)由营养生长向生殖生长的充要条件。培养基成分中还有其他种类外源激素、不同碳源、蔗糖浓度、琼脂浓度等因素也有可能影响春石斛(Dendrobium nobile‘Huoniao’)花芽分化,在后续的试验中,可以进一步探索其他因素对其试管开花的影响。
[1] 李秋玲,李青,刘燕,等.春石斛继代培养主要影响因素[J].东北林业大学学报,2014,42(7):69-73.
[2] 何静茹.春石斛离体快繁体系的优化与试管内开花的研究[D].雅安:四川农业大学,2013.
[3] 贾梦雪,徐瑾,叶香娟,等.春石斛优良品种‘森禾2006’组培快繁体系的建立[J].植物生理学报,2013,49(12):1363-1367.
[4] 李媛,朱丹红,潘会堂,等.3种石斛兰以茎段为外植体的离体快繁技术[J].东北林业大学学报,2013,41(8):77-81.
[5] 吴高杰,赖钟雄.春石斛试管苗离体再生体系的优化研究[J].园艺与种苗,2012,39(12):29-31.
[6] 孟金玲.春石斛(Dendrobium nobile)组织培养快繁体系的构建[D].杭州:浙江农林大学,2011.
[7] 李璐,赖钟雄,翁浩.春石斛和铁皮石斛试管苗壮苗生根条件的优化[J].福建农林大学学报:自然科学版,2011,40(1):31-36.
[8] 张爱香,左利兵,刘会清,等.春石斛兰愈伤组织的诱导及分化培养基的筛选[J].河北北方学院学报:自然科学版,2011,27(1):36-37.
[9] 吴高杰,赖钟雄.春石斛离体培养条件优化及其试管开花研究[J].热带作物学报,2013,34(3):451-458.
[10] 邢琳.石竹、月季、春石斛试管开花组培技术研究[D].北京:北京林业大学,2010.
[11] Iain S D,Dennis F.Experimental control of floral reversion in isolated shoot apices of the long-day plant Silene coei-rosa[J].Physiologia Plantarum,2006,92(2):329-335.
[12] Duan J X,Yazawa S.In vitrofloral development in×Dorielln Tiny(Doritis pulcherrima×Kingiella philippinensis)[J].Scientia Horticulturae,1994,59:253-264.
[13] 李丙智,郭立.TDZ对苹果叶片光合功能、开花座果及果实发育的影响[J].北京农学院学报,1999,14(3):11-14.
[14] 李璐.石斛兰试管开花及其分子机制研究[D].福州:福建农林大学,2010.
[15] 萧浪涛,王三根.植物生理学[M].北京:中国农业出版社,2004.
[16] Zeng S,Liang S,Zhang Y Y,et al.In vitroflowering red miniature rose[J].Biologia Plantarum,2013,57(3):401-409.
[17] 褚剑峰,郑琪,孙叶芳,等.玫瑰试管花技术研究及商品化生产[J].上海农业学报,2008,24(1):130-132.
[18] 刘燕,陈训.影响西洋杜鹃离体试管苗开花的几个因素[J].安徽农业科学,2008,36(22):9405-9407.
[19] 师素恩,张曦良.香石竹试管内开花现象初报[J].植物生理学通讯,1995,31(4):281-285.
[20] 王军玲,陆方方,陈晓梅,等.鸡冠花试管开花初探[J].热带农业科技,2007,30(4):34-35,44.
[21] 余沛涛,何剑锋.诱导何氏凤仙试管内开花的几种生理因素[J].植物生理学通讯,2000,36(6):532.
[22] 郑丽屏,王玲仙,孙一丁,等.重瓣丝石竹试管花的诱导[J].西南农业学报,2004,17(增刊):58-61.
[23] 冯莹.石斛兰ACS反义基因的遗传转化及离体开花的研究[D].福州:福建农林大学,2008.
[24] 孙朝辉,龙美珍,段秀梅,等.‘香槟’月季的组织培养和试管开花诱导[J].植物生理学报,2013,49(11):1261-1266.
[25] 周俊辉,杨寅桂,刘义存,等.微型月季的试管开花诱导研究[J].江西农业大学学报,2008,30(3):504-508.
[26] 王再花.金钗石斛和细茎石斛试管开花研究[D].广州:华南师范大学,2005.
[27] 王琳.金钗石斛试管开花研究[D].广州:华南师范大学,2004.
[28] Tee C S,Maziah M,Tan C S.Induction of in vitroflowering in the orchid Dendrobium sonia 17[J].Biologia Plantarum,2008,52(4):723-726.
[29] 陈达菊.兰花试管开花的诱导及其发生机理的研究[D].广州:华南农业大学,2006.
[30] Vaz A P A,Kerbauy G B.Effects of mineral nutrients on in vitro growth and flower formation of Psymorchispusilla(Orchidaceae)[J].Acta Hort(ISHS),1998,520(2000):149-156.
[31] 王利琳,庞基良,胡江琴,等.温度对植物成花的影响[J].植物学通报,2002,19(2):176-183.
[32] Wang Y.Phalaenopsis orchid light requirement during the induction of spiking[J].HortScience,1995,30:59-61.
[33] 陈肖英,徐明全,郑平,等.兰花试管开花研究进展[J].华南热带农业大学学报,2006,12(4):27-31.
