荧光光谱法研究香豆素-3-羧酸与牛血清白蛋白的相互作用
2015-08-08郁有祝郭玉华牛永生石蔚云申艳红
郁有祝,王 芳,郭玉华 ,牛永生,石蔚云,申艳红
(安阳工学院 化学与环境工程学院,河南 安阳 455000)
0 引言
香豆素及其衍生物具有抗癌、抗HIV治疗[1-2]、抗菌[3]、消炎[4]、抗凝血[5]等多种生物活性.血清白蛋白是血浆中含量最丰富,并且具有一系列重要的生理功能的蛋白质,它可以和许多内源性、外源性小分子物质结合,在有机体内起着储存、转化、运输等重要生理功能.研究药物与蛋白质之间的相互作用,可以为药物在体内的运转、代谢提供有用信息,对于新药设计开发、从分子水平上阐明药物的作用机理有重要意义[6-7].研究药物与蛋白质之间的相互作用常用的光谱方法有荧光光谱法、紫外-可见吸收光谱法、圆二色谱法、核磁共振光谱法等.荧光光谱法由于具有操作简单、分析速度快、灵敏度高、选择性好等优点而被广泛应用[8-10].我们在模拟人体生理pH条件下利用荧光光谱法和紫外光谱法研究了香豆素-3-羧酸与牛血清白蛋白(BSA)的相互作用机理,为香豆素类新药的开发、利用及从分子水平上研究药物的作用机理提供一些有用的信息.
1 实验部分
1.1 仪器与试剂
日立F-7000荧光分光光度计,日立高新技术公司;T6-新世纪紫外-可见分光光度计,北京普析通用仪器有限责任公司;pHS-3C型精密pH计,上海雷磁仪器厂;CP214电子天平,奥豪斯仪器上海有限公司.
香豆素3-羧酸,实验室合成,配成浓度为1.0×10-3mol·L-1溶液;牛血清白蛋白(BSA),Roche公司,用pH=7.4 Tris-HCl缓冲溶液(内含0.05 mol·L-1NaCl)配制成1.0×10-4mol·L-1溶液;其余试剂均为分析纯,实验用水为二次石英蒸馏水.
1.2 实验方法
1.2.1 荧光光谱
于10 mL比色管中分别加入一定体积1.0×10-4mol·L-1BSA溶液,1.0 mL pH=7.4 Tris-HCl缓冲溶液及不同体积1.0×10-3mol·L-1香豆素-3-羧酸溶液,定容.分别在298 K和310 K恒温水浴中反应5 min.固定激发波长为280 nm,激发与发射狭缝宽度为5 nm,扫描290~480 nm的发射光谱.在298 K时测香豆素-3-羧酸与BSA相互作用的同步荧光光谱,考察香豆素-3-羧酸对BSA结构的影响.
1.2.2 紫外吸收光谱
分别向5支10 mL比色管中加入1.0 mL 1.0×10-3mol·L-1香豆素-3-羧酸溶液,1.0 mL pH=7.4 Tris-HCl缓冲溶液及不同体积1.0×10-4mol·L-1BSA溶液,定容,298 K水浴中恒温5 min.以相应试剂为参比,测定其在200~400 nm范围内的紫外吸收光谱.
2 结果与讨论
2.1 荧光猝灭光谱分析
不同温度下香豆素-3-羧酸与BSA相互作用的荧光猝灭光谱如图1a、b所示,在310 K时的BSA荧光猝灭光谱与298 K时相似,最大荧光发射峰的位置未变.由文献[8]知,BSA的构象不随温度的变化而变化,所以在所测温度下不需要考虑BSA构象的变化.由图1可见:随着体系中香豆素-3-羧酸浓度的增加,BSA的最大荧光发射峰位置不变,但其荧光峰强度有规律的降低,即发生了荧光猝灭,表明香豆素-3-羧酸与BSA之间发生了相互作用[9].
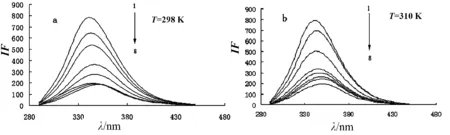
图1 不同温度下香豆素-3-羧酸对 BSA的荧光猝灭光谱Fig.1 Fluorescene quenching spectra of coumarin-3-carboxylic acid to BSA at different temperatures
CBSA=5×10-6mol·L-1,C香豆素-3-羧酸(1-8):0, 1, 2, 4, 5, 6, 7, 8 ×10-5mol·L-1
2.2 荧光猝灭机理
荧光猝灭过程常见的有静态猝灭和动态猝灭,猝灭机制可以通过Stern-Volmer方程[10]来研究.
F0/F=1+Ksv[Q]=1+Kqτ0[Q] ,
(1)
式中:F0和F分别为猝灭剂不存在和存在时体系的荧光强度;Ksv为Stern-Volmer猝灭常数;[Q]为猝灭剂的浓度;Kq为猝灭速率常数;τ0为无猝灭剂时荧光分子的平均寿命(生物大分子的荧光寿命大约为1×10-8s).
绘制不同温度下的香豆素-3-羧酸对BSA荧光猝灭的Stern-Volmer曲线,见图2. 由式(1)计算得到298 K、310 K时的Kq分别为4.117×1012、3.403×1012L·moL-1·s-1,所求得Kq均远远大于荧光猝灭剂对生物大分子的最大扩散碰撞猝灭速率常数(2.0×1010L/(mol·s)),可以初步判断香豆素-3-羧酸对BSA的荧光猝灭为形成复合物的静态猝灭.

图2 不同温度下,香豆素-3-羧酸对BSA荧光猝灭的Stern-Volmer曲线Fig.2 The Stern-Volmer curve of coumarin-3-carboxylic acid to BSA at different temperatures
动态与静态猝灭也可依据不同温度下的猝灭常数来判断,动态猝灭是激发态荧光分子和其他分子之间碰撞造成能量损失而形成的,温度越高猝灭越明显,即猝灭常数随温度的升高而增大;而静态猝灭是荧光基团和猝灭剂分子相互作用形成了不产生荧光的基态复合物而造成的,则温度升高将降低缔合物的稳定性,使猝灭常数减小.由图2可知,猝灭常数随着温度的升高而减小,这进一步说明香豆素-3-羧酸对BSA的荧光猝灭为形成复合物的静态猝灭.
2.3 结合常数及热力学参数
香豆素-3-羧酸与BSA的结合作用可由式(2)表示[11]:
lg[(F0/F)-1]=lgKA+nlg[Q] ,
(2)
式中:n为结合位点数,KA为结合常数.绘制不同温度下的lg[(F0/F)-1]~lg[Q]曲线,由曲线的斜率和截距求出香豆素-3-羧酸与BSA相互作用的结合常数KA及结合位点数n,结果见表1.由表1可见,在不同温度时,相关系数R>0.99,表明各曲线线性良好;结合位点数n均约为1,表明香豆素-3-羧酸与BSA结合形成 1∶1复合物;结合常数随温度升高而降低,符合静态猝灭的特征.
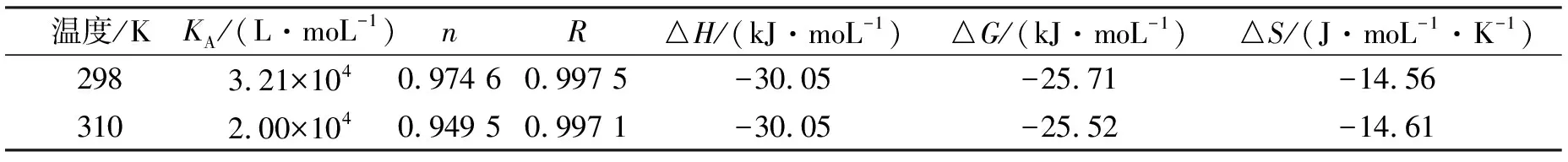
表1 香豆素-3-羧酸与BSA作用的结合常数和热力学参数Tab.1 Binding constant and thermodynamic parameters of coumarin-3-carboxylic acid and BSA
药物小分子与蛋白质之间的相互作用力主要有氢键、静电作用力、疏水作用和范德华力等.而作用过程中的热力学参数是判断作用力类型的主要标准.当温度变化范围不大时,可认为作用过程的ΔH为一定值.根据热力学方程ln(K2/K1)=ΔH(1/T1-1/T2)/R和ΔG=-RTlnK=ΔH-TΔS,由表1结合常数KA数据,可计算出香豆素-3-羧酸与BSA作用的热力学参数,结果如表1所示.
Ross等[12]根据大量实验现象总结出了判断生物大分子与小分子作用力类型的热力学规律:ΔH>0,ΔS>0,其作用力主要为疏水作用;ΔH<0,ΔS<0,其作用力主要为氢键和范德华力;ΔH<0,ΔS>0,其作用力主要为静电引力.香豆素-3-羧酸与BSA相互作用的过程ΔH<0,ΔS<0,可以推测两者的作用力主要为氢键和范德华力.
2.4 同步荧光光谱分析
蛋白质的荧光主要来自于色氨酸、酪氨酸,所以通过对色氨酸、酪氨酸同步荧光的测定,可以探讨色氨酸或酪氨酸的构象变化或周围环境是否变化.Δλ=15 nm和Δλ=60 nm时分别显示的是酪氨酸和色氨酸残基的荧光特征[13],图3a、b分别为Δλ=15 nm和Δλ=60 nm时BSA在香豆素-3-羧酸作用下的同步荧光光谱图.

图3 香豆素-3-羧酸与BSA相互作用的同步荧光光谱Fig.3 Synchronous fluorescene spectra of coumarin-3-carboxylic acid and BSA
由图3可知,固定BSA的浓度,随香豆素-3-羧酸浓度的增加,色氨酸残基荧光显著猝灭,且其最大发射波长发生了红移,而酪氨酸残基的最大发射波长基本不变,说明香豆素-3-羧酸与BSA作用时,主要是通过改变牛血清白蛋白中色氨酸残基的构象或其周围环境,而对酪氨酸残基的构象或周围环境没有明显的影响[14].
2.5 紫外吸收光谱分析
通常靶向药物分子与血清蛋白结合后会导致吸收峰发生红移及减色、增色效应,这些效应的产生说明血清白蛋白与小分子之间发生了不同类型的相互作用.

图4 香豆素-3-羧酸与BSA作用的紫外吸收光谱图Fig.4 UV absorption spectra of coumarin-3-carboxylic acid and BSA
C香豆素-3-羧酸=1×10-4mol·L-1,CBSA(1-5):0,
0.5, 1, 1.5, 2.0 ×10-6mol·L-1
由图4可知,向香豆素-3-羧酸中加入不同浓度BSA后,其最大吸收峰强度逐渐降低,表现为减色效应,且最大吸收峰发生明显红移.红移的原因是嵌入药物分子与蛋白质碱基对π电子堆积,作用药物的π*空轨道与碱基对的π轨道偶合,使能量降低,导致π→π*跃迁能量降低[15].现象表明,香豆素-3-羧酸可能与BSA发生了相互作用,生成了新的物质[16].
3 结论
利用荧光光谱和紫外吸收光谱法两种方法研究了香豆素-3-羧酸与BSA的相互作用,这两种方法得到了相互验证,研究结果一致,对于香豆素类新药的设计、开发、利用及从分子水平上探讨药物的作用机理有一定的指导意义.
