Zn掺杂对TiO2晶相及光催化性能的影响
2015-08-08徐向军邢晓轲卫世乾
徐向军,邢晓轲,卫世乾
(1.银川能源学院 石油化工学院,宁夏 银川 750001;2.许昌职业技术学院 园林园艺系,河南 许昌 461000;3.许昌学院 学报编辑部,河南 许昌 461000)
0 引言
TiO2作为一种重要的半导体材料,其高光催化活性、稳定的化学性质、耐化学和光学腐蚀以及无毒等特性,使其成为研究较多的光催化剂之一[1-3].但单一TiO2在光催化过程中也存在着一些缺陷,如带隙较宽,只能吸收紫外光和光催化效率较低等.为此,将TiO2与其他半导体材料复合的研究逐渐增多[4].TiO2与其他半导体材料复合后,所合成的复合材料往往比单体具有更好的物理化学性质和光催化活性[5-7].
因为ZnO和TiO2两者具有相近的禁带宽度(Eg= 3.2 eV)与交错能带位置,所以引入ZnO后可抑制TiO2晶型转变和粒子生长,使得ZnO-TiO2复合半导体吸收紫外线的能力较单一ZnO或TiO2的有所提高[8].同时,ZnO独特的光学和电学性使其在光催化降解有机污染物的应用中也有着显著的表现.它与TiO2间的电荷转移,也能提高复合材料的光催化效率[9].
本文采用改进的溶胶-凝胶法制备ZnO-TiO2复合纳米催化剂,反复摸索其制备条件,利用XRD、UV-Vis DRS对其进行表征.以甲基橙为降解物,考察制备条件对ZnO-TiO2复合物的光催化性能影响.
1 实验部分
1.1 ZnO- TiO2的制备
取5 mL无水乙醇于烧杯中,室温下缓慢滴加3.8 mL钛酸丁酯,搅拌30 min配成A液;取3 mL无水乙醇、2.3 mL醋酸和适量水于另一烧杯中,加入0.67 g硝酸锌固体,室温下搅拌使固体完全溶解制成B液;将B液缓慢滴加到A液中并不断搅拌,滴加时间约10 min,形成溶胶后,再继续搅拌1 h,静置陈化8 h,形成果冻状凝胶.100 ℃下干燥12 h,得到黄色固体颗粒,500 ℃下焙烧2 h就可以得到n(Zn)∶n(Ti)=3∶15的ZnO-TiO2复合材料.保持钛酸丁酯的量不变,改变硝酸锌的量,分别制得n(Zn)∶n(Ti)= 3∶5、3∶10、3∶20、3∶25的ZnO-TiO2复合物.
1.2 ZnO- TiO2复合物的表征
采用德国D8 Advance型X射线衍射仪(XRD)分析样品的晶相和组成 (CuKα 射线,石墨单色器,电压40 kV,电流30 mA);样品的光吸收性能 (UV-Vis DRS) 在美国安捷伦cary 5000型紫外-可见光谱仪上进行,漫反射谱选用小积分球,BaSO4参比.
1.3 光催化性能测试
甲基橙是一种较难降解的有色化合物,具有多种染料化合物的主体结构、即偶氮结构和蒽醌结构,故本实验选择具有代表性的甲基橙为降解的模型化合物.
在50 mL甲基橙溶液中加入50 mg催化剂,在室温下搅拌,避光吸附30 min.开启30 W紫外灯照射,每隔30 min取一次样,上层清液用T22S可见分光光度计测量其在最大吸收波长(462 nm)处的吸光度.光催化活性用降解率R来表示:
R=(A0-At)/A0×100%,
式中:At表示在光照时间t时的吸光度;A0避光吸附后光照前的吸光度.
2 结果与讨论
2.1 结构与性能表征
图1为500 ℃焙烧下所得不同复合比ZnO-TiO2的XRD图.可以看出,在2θ= 25.4°、37.9°、48.3°、53.9°、55.1°、62.6°、68.8°、70.4°、75.3°、82.8°位置处均出现了明显的衍射峰,可分别对应锐钛矿型TiO2的(101)、(004)、(200)、(105)、(211)、(204)、(116)、(220)、(215)、(224)晶面的贡献.在n(Zn)∶n(Ti)=3∶5、3∶10、3∶15的样品中,分别在30.1°、35.3°、43.0°、56.8°处出现的特征衍射峰,可直接对应于立方Zn2TiO4晶体的(220),(311),(400),(511)晶面,其他复合比的XRD图中则观察不到明显的Zn2TiO4晶体的衍射峰,这说明在n(Zn)∶n(Ti)≥ 3∶15时才有大量Zn2TiO4晶体产生,而在ZnO-TiO2复合催化剂中Zn主要以TiO2和Zn2TiO4晶体的形式存在.据文献报道[10-11],在本样品配比下应优先形成ZnO晶相.本实验中并未观察到ZnO衍射峰,这可能是由于采用溶胶-凝胶法制备固体材料时,通过溶解混合使Zn2+与Ti(OC4H9)4在分子水平上接触,从而为生成Zn2TiO4晶相提供了有利条件[12].
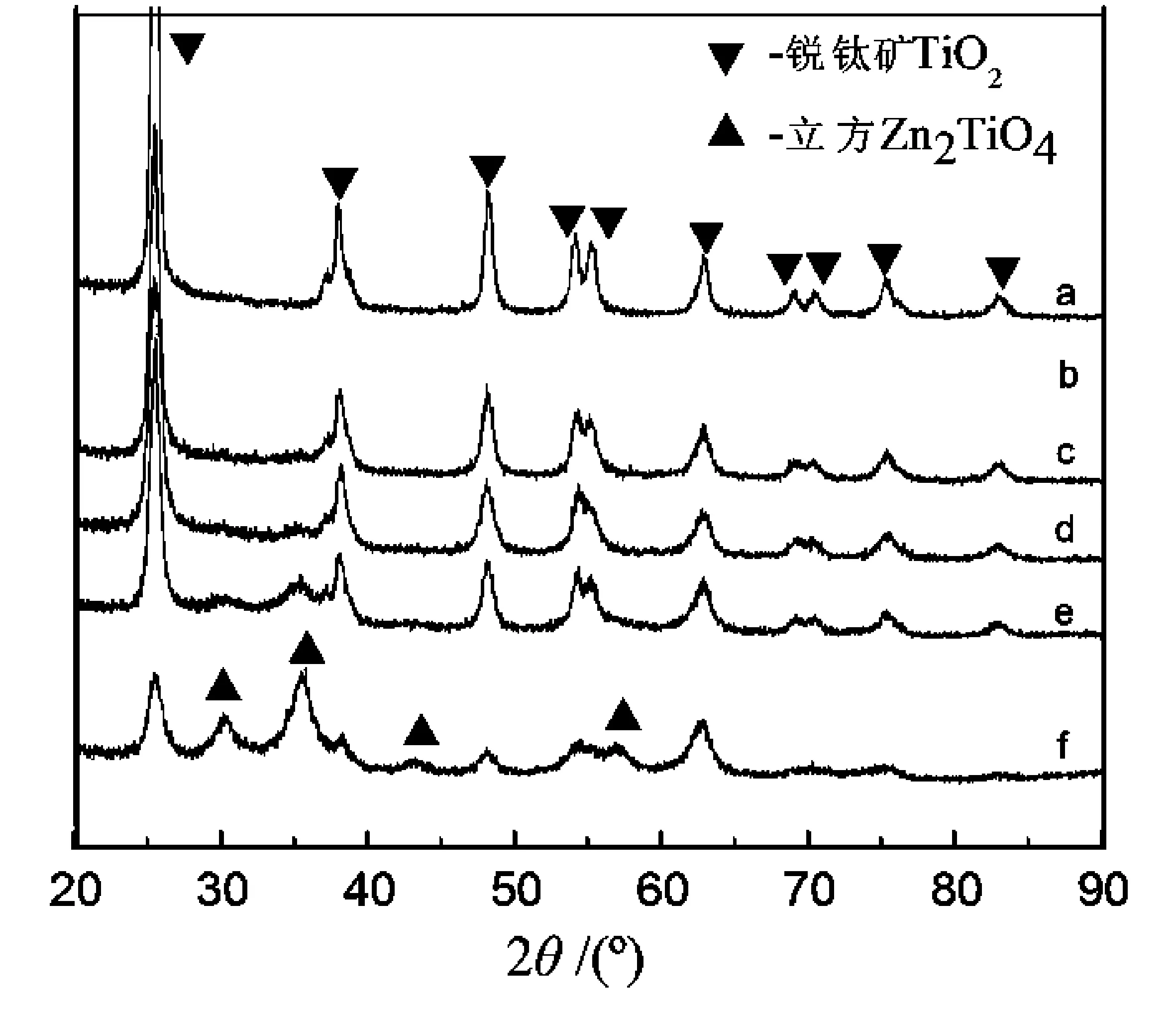
图1 不同复合比ZnO-TiO2的XRD图Fig.1 XRD patterns of n(Zn)∶n(Ti) of a) 0; b) 3∶25; c) 3∶20; d) 3∶15; e) 3∶10; f) 3∶5
利用谢乐(Scherrer)公式D=0.89λ/(Bcosθ)计算晶粒垂直于晶面方向的平均厚度D(nm),B为实测样品衍射峰半高宽度(rad),θ为衍射角(°),λ为X射线波长,约为0.154 056 nm,以2θ= 25.4 °为准,计算不同比例的ZnO-TiO2复合催化剂中TiO2颗粒的尺寸.通过计算得纯TiO2晶体晶粒的平均厚度D为13.7 nm,大于不同比例的ZnO-TiO2晶粒的厚度,其中n(Zn)∶n(Ti) = 3∶15时平均厚度D= 8.6 nm,说明复合适量的Zn能抑制TiO2晶粒的长大.
图2为n(Zn)∶n(Ti)=3∶15时改变焙烧温度所得ZnO-TiO2的XRD图.可以看出,在300 ℃、400 ℃焙烧条件下,仅能观察到锐钛矿TiO2的衍射峰且强度很弱,即低温下样品的结晶度差.而当600 ℃焙烧时,可观察到有很多其他衍射峰出现,部分峰可归属于金红石相TiO2和Ti2O3、Ti3O5,除此,仍有相当数量的衍射峰无法辨认,说明在600 ℃下发生了复杂的化学反应,而如果无Zn复合,一般不会形成类似晶相,具体原因还需借助其他表征手段进行分析.降解实验证明500 ℃焙烧所得ZnO-TiO2的活性最佳,由此可以认为600 ℃焙烧下复合物催化活性明显降低与生成这些杂相有关.
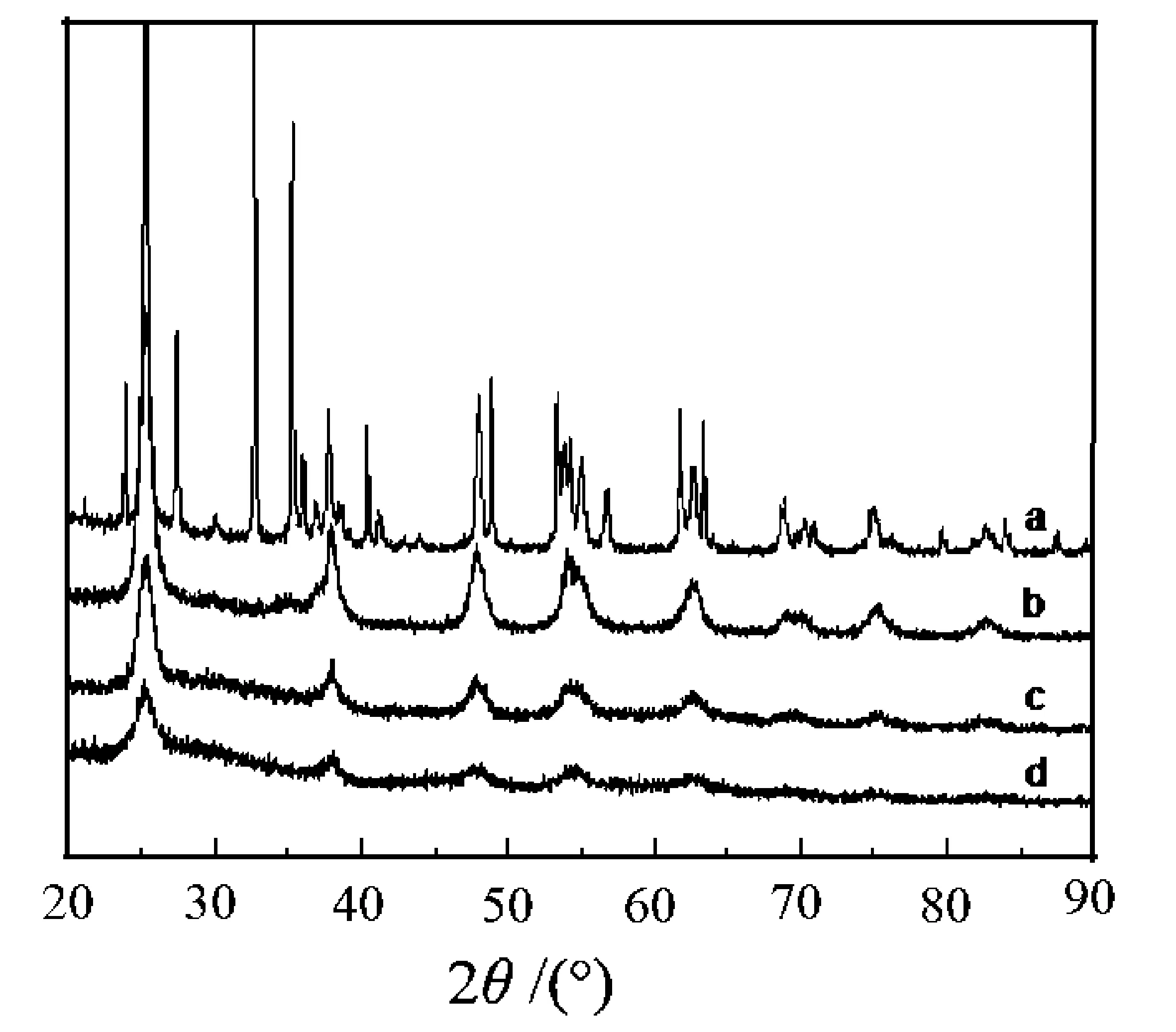
图2 不同焙烧温度制备的ZnO-TiO2的 XRD图Fig.2 XRD patterns of ZnO-TiO2 with calcination temperature of a)600 ℃; b)500 ℃; c)400 ℃; d)300 ℃
图3为TiO2与ZnO-TiO2的紫外-可见漫反射吸收光谱.可见,两个样品在波长小于340 nm时吸收略有增加,且吸收边带出现较小幅度蓝移.即经过复合后ZnO- TiO2相比TiO2吸收紫外光的能力增强,对应的光催化活性也会提高.此外,复合材料在可见光区的吸收也有增强,这可能与Zn-Ti之间的电荷转移降低光电子-空穴复合率有关.
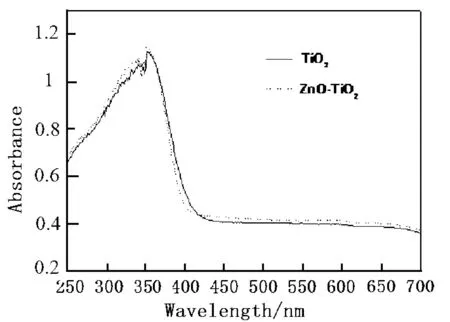
图3 催化剂的UV- Vis DRS图谱Fig.3 UV-Vis spectra of catalysts
2.2 光催化活性
在制备B液中,起初所加水的量较小,将B液滴于A液后室温下静置陈化2 d仍未形成凝胶.后来逐渐增加水的量发现陈化形成凝胶的时间大大缩短,但水量过多会导致溶胶立刻变成凝胶,降解实验证明没有经过静置陈化立刻形成的凝胶,在干燥焙烧后制得的催化剂活性较低,因此要想获得活性较好的ZnO-TiO2复合催化剂,在此步骤中应控制好加入的水量.
但由于不同的比例所加水的量不一样,也无明显的规律性.因此可先在B液中加少量的水,保证加入A液后不会很快形成凝胶,需保证至少静置陈化6 h后形成凝胶,若此时仍未形成凝胶,则可以在搅拌条件下逐滴加水,这时溶胶很快变成凝胶.仅改变制备B液中所加水的量,记录陈化时间,所得产品以光照90 min计算降解率,结果如表1所示.
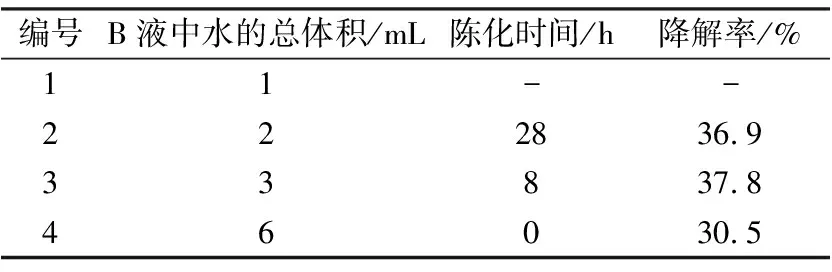
表1 B液中水量对陈化时间和催化活性的影响Tab.1 The influence of the water amount in B solution on aging time and catalytic activity
由表1可以看出,当A液组分为3.8 mL钛酸丁酯、5 mL乙醇,B液组分为0.67 g硝酸锌、3 mL乙醇、2.3 mL乙酸时,在B液中需要再加水的量为1 mL时得不到凝胶,6 mL时溶胶会立即形成凝胶,但是活性比较低.水量分别为2 mL、3 mL时活性差别不大,但由溶胶形成凝胶所需陈化时间差别很大,故选择所需陈化时间较短的3 mL为最佳水量.
图4为不同Zn-Ti复合比的ZnO-TiO2在光照5 h下甲基橙的光降解活性.
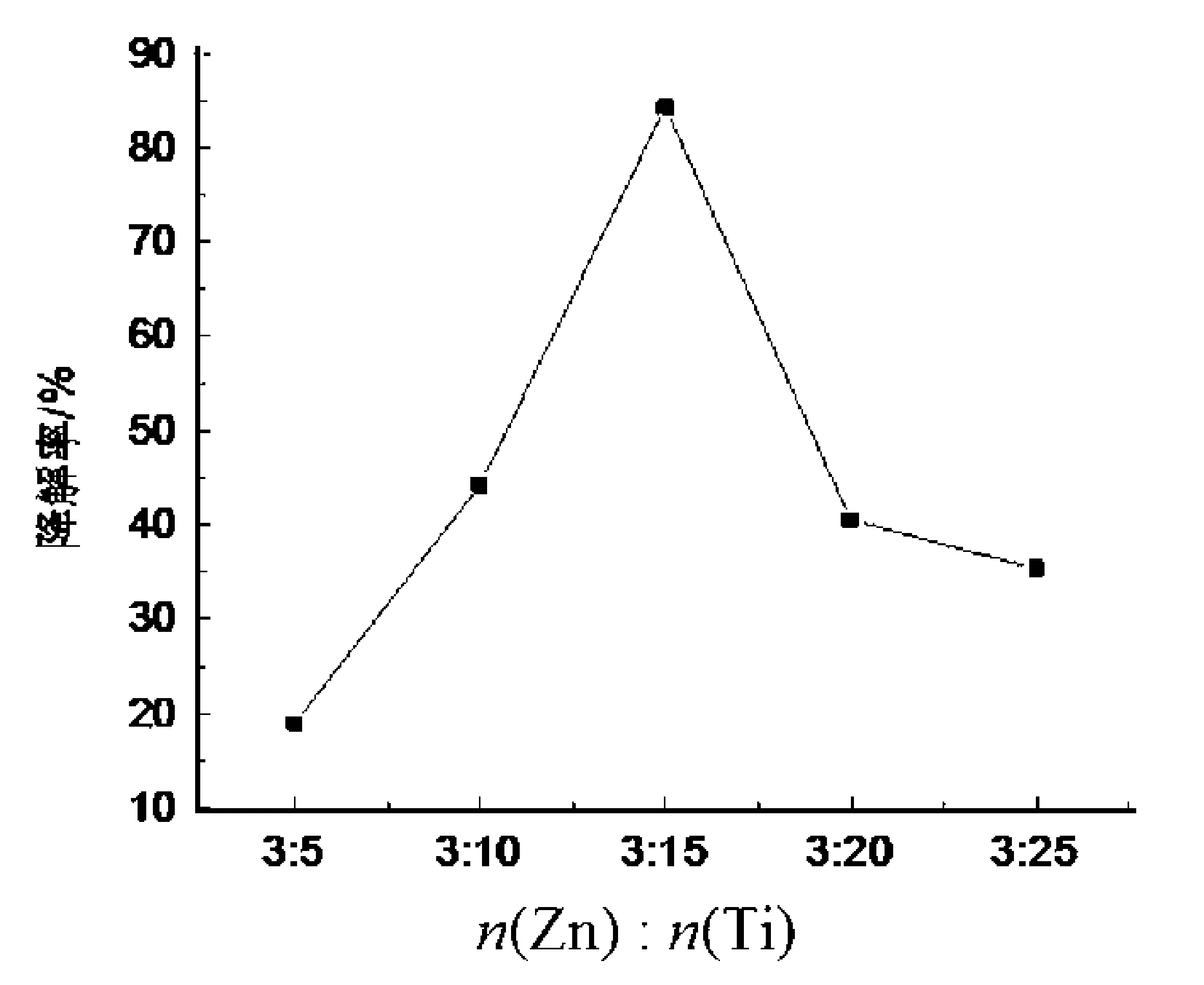
图4 不同n(Zn )∶n(Ti)的ZnO-TiO2的光催化性能Fig.4 Photodegradation curve of ZnO-TiO2with different n(Zn )∶n(Ti)
由图4可以看出,ZnO-TiO2复合催化剂的活性先增加后减小,在n(Zn )∶n(Ti )= 3∶15时则达到最大值,降解率约为84.5%,然而单纯TiO2催化剂在相同条件下的催化效率为73.8%,即只有在合适的Zn掺杂比下才会有明显的促进作用.结合XRD和紫外-可见漫反射吸收光谱的表征结果,n(Zn )∶n(Ti ) = 3∶15时复合材料的活性最高与形成适量比的TiO2和Zn2TiO4混晶及产生混晶效应有密切关系[11].此外平均晶粒较小,对光的吸收边发生红移也是不可忽视的因素.
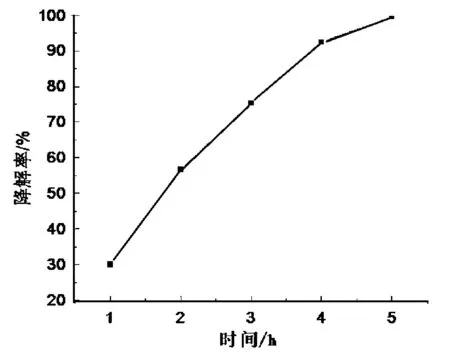
图5 光照时间对甲基橙降解率的影响Fig.5 The influence of time under UV light on degradation rate of metyl orange
图5为n(Zn)∶n(Ti )= 3∶15,500 ℃焙烧制得的ZnO-TiO2复合催化剂在最佳催化剂用量下(3 g/L)光照时间对甲基橙降解率的影响.由图5可以看出,当光照时间延长时降解率逐渐增大,但增加速率逐渐变慢,这很可能是由于时间的增加催化剂催化活性逐渐达到饱和的缘故.光照5 h后甲基橙基本降解完全,表现出良好的应用前景.
3 结论
本文采用改进的溶胶凝胶法制备ZnO-TiO2复合催化剂,在制备过程中控制所加水的量,则可以控制合适的溶胶向凝胶陈化的时间.当n(Zn)∶n(Ti) 为3∶15、焙烧温度为500 ℃时复合物催化效率最高,紫外光照5 h,甲基橙基本降解完全.ZnO-TiO2复合催化剂中主要为锐钛矿相TiO2和 立方Zn2TiO4,且Zn2TiO4晶相在n(Zn)∶n(Ti)≥3∶15时才会出现.该催化剂对于降解有机污染物具有应用价值.
