NLRP3炎性小体研究进展
2015-08-07程晓曙
魏 祺,程晓曙
(南昌大学 第二附属医院 心血管内科, 江西 南昌 330006)
短篇综述
NLRP3炎性小体研究进展
魏 祺,程晓曙*
(南昌大学 第二附属医院 心血管内科, 江西 南昌 330006)
炎性小体是一种多蛋白复合体,它能够识别多种病原微生物及应激相关内源性信号分子,在固有免疫中发挥重要作用。炎性小体可通过活化半胱氨酸天冬氨酸酶- 1(caspase- 1)诱导促炎因子IL- 1β和IL- 18的成熟、释放,引起炎性反应,参与多种疾病如家族性周期性自身炎性反应、缺血再灌注损伤和动脉粥样硬化等的发生发展过程。
炎性小体;NLRP3;IL- 1β
炎性小体是大分子质量的多蛋白复合体,作为固有免疫的一部分,炎性小体通过模式识别受体(pattern recognition receptor,PRR)识别病原微生物及内源性危险信号,即病原相关分子模式(pathogen associated molecular pattern,PAMP)和危险相关分子模式(damage associated molecular pattern,DAMP),招募并激活caspase- 1,剪切IL- 1β和IL- 18前体,产生相应的成熟细胞因子,参与机体对病原体的清除及适应性免疫应答的产生。目前发现能够形成炎性小体的PRR主要有NOD样受体(NOD-like receptor,NLR)及PYHIN蛋白家族受体,前者包括NLRP1、NLRP3、NLRP6、NLRP7、NLRP12、NLRC4以及NAIP[1]。其中NLRP3炎性小体能够识别多种类型的病原体及危险分子,是目前研究最多的炎性小体。
1 NLRP3炎性小体分子结构
NLRP3炎性小体由NLRP3、凋亡相关斑点样蛋白(apoptosis associated speck-like protein containing a CARD domain,ASC)以及pro-caspase- 1组成(图1)。NLRP3主要包含3部分,即C端的亮氨酸重复序列(leucine-rich-repeat domain,LRR),其作用是识别微生物及内源性危险信号, 中段特征性的核苷酸寡聚
化结构域(nucleoside triphosphatase domain,NACTH),介导NLR寡聚化并形成炎性小体的核心结构,以及N端的效应结构域,主要包括热蛋白结构域(pyrin domain,PYD)、胱天蛋白酶募集结构域(caspase recruitment domain,CARD)及杆状病毒凋亡抑制重复结构域(baculovirus inhibitor of apoptosis repeat domain,BIR)等,参与信号传导过程[2]。ASC是细胞内一类重要的接头蛋白,由PYD和CARD两部分组成,它能够通过同型的PYD与NLR的PYD相互作用,并通过CARD结构域招募pro-caspase- 1,从而介导NLRP3激活caspase- 1。
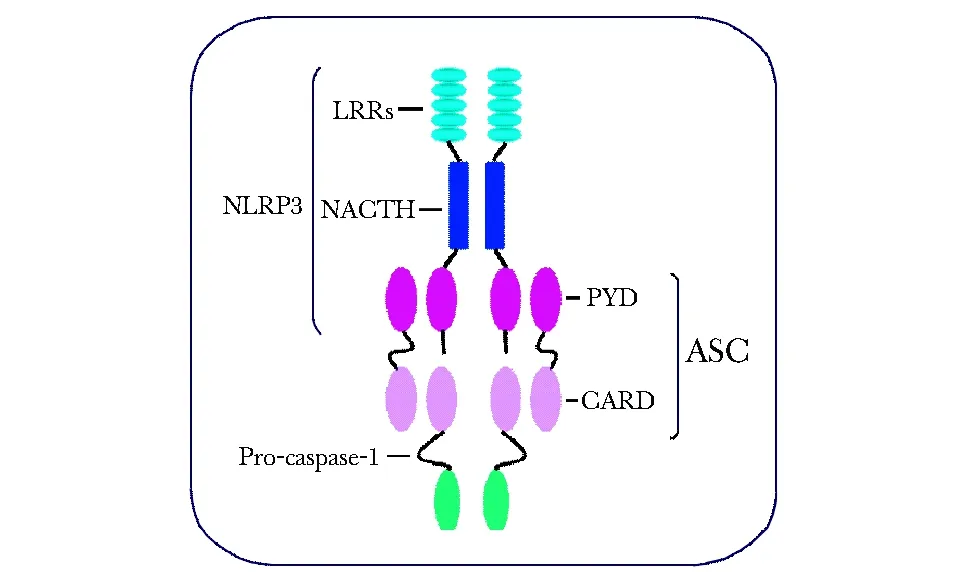
图1 NLRP3炎性小体结构示意图Fig 1 The schematic diagram of NLRP3 inflammasome
2 NLRP3炎性小体活化途径
多数情况下,NLRP3炎性小体通过双信号模式进行激活。在静息细胞中,NLRP3炎性小体的各成分(NLRP3、ASC和pro-caspase- 1)及其作用底物(pro-IL- 1β和pro-IL- 18)处于不能测及的极低水平。当模式识别受体如Toll样受体与相应配体结合后,作为第一信号,能够介导核转录因子NF-κB向核内转位,启动NLRP3、pro-IL- 1β和pro-IL- 18等的转录过程,从而上调其表达水平。第二信号介导NLRP3炎性小体的组装、caspase- 1的活化以及pro-IL- 1β和pro-IL- 18的加工,最终引起成熟IL- 1β和IL- 18的分泌[3]。多种内源性和外源性刺激物都能够引起NLRP3炎性小体的组装,包括微生物成分如细菌、病毒及真菌的DNA或RNA,细菌成孔毒素如尼日利亚菌素,晶体物质如胆固醇和二氧化硅,环境刺激物如石棉和紫外线,内源性危险信号如ATP、尿酸钠和β-淀粉样蛋白等[4]。尽管NLRP3能够广泛识别多种刺激物,但是尚无证据表明它能与之直接结合,提示它们可能通过共同的上游信号介导NLRP3炎性小体的活化。
目前提出的NLRP3炎性小体激活途径主要有3种:1)钾离子外流。刺激物诱发细胞释放ATP,作用于细胞表面的P2X7嘌呤受体,引起胞内钾离子外流,随后招募泛连接蛋白pannexin- 1介导开放跨膜通道,使相应配体进入细胞内激活NLRP3炎性小体[5]。钙离子动员在NLRP3炎性小体活化过程中也起重要作用,升高的胞内钙离子以及降低的cAMP共同介导NLRP3炎性小体活化[6]。此外,流感病毒感染时,病毒表达M2离子通道,酸化的高尔基体通过该通道向胞质释放H离子,引起NLRP3炎性小体的活化[7]。以上发现提示,NLRP3炎性小体的活化可能与细胞内离子环境的改变有关。2)溶酶体破坏。晶体或颗粒物质通过内吞作用进入细胞,降低吞噬溶酶体膜稳定性,引起溶酶体蛋白水解酶的释放,从而激活NLRP3炎性小体。在此过程中,组织蛋白酶cathepsin-B的释放起关键性作用。然而此机制仅对晶体具有特异性,ATP和细菌毒素介导的炎性小体激活并不依赖于溶酶体的破坏[8]。3)线粒体活性氧(reactive oxygen species,ROS)生成。所有已知的NLRP3炎性小体激活剂都能导致ROS的产生,线粒体来源的ROS是调节NLRP3炎性小体活化的关键信号[9]。目前,关于ROS激活NLRP3炎性小体的机制尚不明确,可能与一种能够与硫氧还蛋白(thioredoxin,TRX)相互作用的蛋白(thioredoxin interacting protein,TXNIP)有关。当细胞遭受氧化压力时,ROS的产生促进TXNIP与胞质中的TRX1解离,并使之与NLRP3 结合,从而活化NLRP3炎性小体。同时,TXNIP转位进入线粒体,与线粒体中的TRX2结合,导致线粒体功能紊乱,氧化的线粒体DNA能够直接激活NLRP3炎性小体[10]。
除了以上3种主要机制之外,尚有其他分子机制参与炎性小体激活,如微生物的Ⅲ型或Ⅳ型分泌系统(type Ⅲ/type Ⅳ secretion systems,T3SS/T4SS)、双链RNA依赖性蛋白激酶(double-stranded RNA-dependent protein kinase,PKR)以及鸟苷酸结合蛋白- 5(guanylate binding protein,GBP)等[3,11]。
3 NLRP3炎性小体活化的调控
一方面,炎性小体在宿主防御过程中发挥重要作用,而另一方面,过度分泌的炎性因子以及炎性细胞死亡(pyroptosis)能够对宿主造成潜在损伤,因此,炎性小体的严密调控至关重要。多重机制参与机体对炎性小体功能的调控。特异性的肿瘤坏死因子受体超家族成员如CD40配体能够介导CD4+效应T细胞和记忆T细胞抑制NLRP3炎性小体,在适应性免疫应答激活后起到协助关闭固有免疫应答的作用;而T细胞来源的IFN-γ则可通过激活诱导型一氧化氮合酶,抑制NLRP3炎性小体活化,避免炎性反应过度激活[1]。病原微生物也能通过多种机制抑制或逃避炎性小体的活化。病毒主要通过分泌炎性小体抑制物的类似物发挥抗炎性小体作用。痘病毒表达M013和gp013L,与ASC结合抑制炎性小体活化;而卡波氏肉瘤相关疱疹病毒则通过Orf63与NLRP3相互作用,抑制炎性小体激活,从而实现免疫逃避并在体内长期潜伏。与病毒不同,病原菌能够下调PAMP,干扰炎性小体与相应配体的识别,从而负性调控炎性小体的激活。假结核耶尔森菌外膜蛋白K能够与T3SS的易位子相互作用,抑制炎性小体对该病原菌的识别[12]。另外,炎性小体和自噬途径之间也存在复杂的相互作用关系。自噬缺陷小鼠血清IL- 1β和IL- 18水平明显增高,其机制可能是自噬缺陷小鼠难以清除受损的线粒体,导致ROS过度累积,同时线粒体DNA释放到胞质,两者共同触发NLRP3炎性小体的活化。自噬体隔绝pro-IL- 1β并使之降解在避免IL- 1途径过度活化过程中也起重要作用[13]。
4 NLRP3炎性小体与相关疾病
4.1 NLRP3炎性小体与Cryopyrin相关周期性综合征
NLRP3炎性小体基因功能获得性突变最初被发现与cryopyrin相关周期热综合征(cryopyrin-associated periodic syndromes,CAPS)密切相关,这是一组罕见的常染色体显性遗传的自身炎性反应疾病,由3种严重程度递增的炎性功能紊乱构成连续的临床过程,分别是家族性寒冷性自身炎性综合征(familial cold autoinflammatory syndrome,FCAS)、Muckle-well综合征(Muckle-Wells syndrome, MWS)以及婴儿慢性神经皮肤关节综合征(chronic infantile cutaneous neurological articular syndrome,CINCA)[4]。突变主要发生在NACTH结构域,造成NLRP3结构改变,使其在静息状态下不能自我抑制,始终处于激活状态,,从而引起持续性的NF-κB、caspase- 1途径激活,最终导致自发性的IL- 1β和IL- 18分泌,引起CAPS患者相应的临床症状。CAPS患者对IL- 1β拮抗剂如阿那白滞素(anakinra)、康纳单抗(canakinumab)以及caspase- 1拮抗剂反应良好。另外,pyrin 和PSTPIP1的突变也与CAPS有所关联[14]。
4.2 NLRP3炎性小体与缺血再灌注损伤
在缺血基础上恢复血流后组织损伤反而加重,甚至发生不可逆性损伤的现象称为缺血再灌注损伤(ischaemia-reperfusion injury,I/R)。I/R的发生机制尚未完全阐明,目前认为自由基的作用、细胞内钙超载和白细胞的激活是I/R重要的发病环节。NLRP3炎性小体也参与介导心肌缺血再灌注损伤。心肌缺血再灌注后NLRP3在心肌细胞尤其是成纤维细胞中表达明显上调,IL- 1β和IL- 18水平明显增高;而NLRP3缺陷型小鼠梗死面积明显缩小,心脏收缩功能增强[15]。受损心肌细胞释放ATP,激活NLRP3炎性小体形成,促进IL- 1β和IL- 18释放,引起炎性损伤[16];炎性反应进一步刺激其他趋化因子和细胞因子释放,诱发缺血心肌炎性细胞浸润,反过来加重心肌损伤;同时,炎性小体激活导致的炎性细胞死亡也参与心肌损伤过程。
4.3 NLRP3炎性小体与动脉粥样硬化
炎性反应是动脉粥样硬化(atherosclerosis,AS)重要的发病机制之一。胆固醇结晶可激活NLRP3炎性小体,导致IL- 1β的成熟与分泌,而IL- 1β在AS始动环节中起重要作用[17]。对低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)基因敲除的AS易感小鼠在致命照射后进行骨髓移植,分别移植NLRP3、ASC和IL- 1α/β基因敲除小鼠的骨髓,再给予富含胆固醇饮食,可观察到骨髓移植组小鼠主动脉粥样硬化病变面积较对照组减少69%,并且移植组血清IL- 18水平显著低于对照组。另外,NLRP3炎性小体在AS斑块中高表达,其活化受到巨噬细胞内ox-LDL的调控,提示NLRP3炎性小体可能参与介导AS炎性过程[18]。
4.4 NLRP3炎性小体与2型糖尿病
2型糖尿病(Type II diabetes,T2D)以胰岛素抵抗和胰岛β细胞功能障碍为特征。T2D时,升高的血糖能直接诱发炎性反应,增加IL- 1β分泌,IL- 1β对胰岛β细胞有强烈的细胞毒性作用,可引起胰岛β细胞损伤和死亡, 加重胰岛β细胞功能障碍,增加胰岛素抵抗,从而促进T2D发展。胰岛淀粉样多肽(islet amyloid polypeptide,IAPP)能够直接活化NLRP3炎性小体诱导巨噬细胞IL- 1β的产生[4]。另外,TXNIP能够以一种ROS依赖性模式激活NLRP3炎性小体,导致IL- 1β释放和胰岛素抵抗,TXNIP或NLRP3缺陷型小鼠的糖耐受能力和胰岛素敏感性有所提高,对于葡萄糖诱导的β细胞损害亦有明显的保护作用[19]。许多体内外实验已经证实,IL- 1β拮抗剂能明显降低T2D患者的血糖水平,改善胰岛素抵抗,减轻炎性反应。
此外,NLRP3炎性小体还与其他许多疾病有关。尿酸钠及二水焦磷酸钙结晶激活NLRP3炎性小体,产生IL- 1β,引起中性粒细胞向滑膜和关节液中聚集,参与痛风的发病过程[20];β-淀粉样蛋白激活NLRP3炎性小体,引发炎性反应和脑组织损伤,这可能是阿尔茨海默病发生的重要机制[21];NLRP3炎性小体也参与急慢性肾脏病的发生发展[22]。另外,NLRP3基因单核苷酸多态性与1型糖尿病、乳糜泻和牛皮癣等疾病相关,并能增加机体对HIV病毒感染和炎性反应肠病的易感性[23]。
5 展望
尽管关于NLRP3炎性小体的研究已经取得了很大进展,但是尚有很多问题亟待解决,包括不同生理条件下NLRP3炎性小体的作用,NLRP3炎性小体调控的具体途径,炎性小体与其他信号通路之间的相互关系,以及NLRP3炎性小体在炎性反应疾病中具体的作用机制等。炎性小体研究的进一步深入可能为各种相关疾病提供新的治疗思路和靶点。
[1] Latz E,Xiao TS,Stutz A.Activation and regulation of the inflammasomes[J].Nat Rev Immunol,2013,13:397- 411.
[2] Bauernfeind F, Hornung V.Of inflammasomes and pathogens-sensing of microbes by the inflammasome[J].EMBO Mol Med,2013,5:814- 826.
[3] Kim JJ,Jo EK.NLRP3 inflammasome and host protection against bacterial infection[J].J Korean Med Sci,2013,28:1415- 1423.
[4] Yang CS,Shin DM,Jo EK.The role of NLR-related protein 3 inflammasome in host defense and inflammatory diseases[J].Int Neurourol J,2012,16:2- 12.
[5] Gombault A,Baron L,Couillin I.ATP release and purinergic signaling in NLRP3 inflammasome activation[J].Front Immunol,2012,3:414.
[6] Murakami T,Ockinger J,Yu J,etal. Critical role for calcium mobilization in activation of the NLRP3 inflammasome[J].Proc Natl Acad Sci U S A,2012,109:11282- 11287.
[7] Rathinam VA,Vanaja SK,Fitzgerald KA.Regulation of inflammasome signaling[J].Nat Immunol,2012,13:333- 332.
[8] Lima H Jr,Jacobson LS,Goldberg MF,etal.Role of lysosome rupture in controlling Nlrp3 signaling and necrotic cell death[J].Cell Cycle,2013,12:1868- 1878.
[9] Tschopp J,Schroder K.NLRP3 inflammasome activation:the convergence of multiple signalling pathway on ROS production?[J].Nat Rev Immunol,2010,10:210- 215.
[10] Lane T,Flam B,Lockey R,etal.TXNIP shuttling: missing link between oxidative stress and inflammasome activation[J].Front Physiol,2013,4:50.
[11] Cunha LD,Zamboni DS.Subversion of inflammasome activation and pyroptosis by pathogenic bacteria[J].Front Cell Infect Microbiol,2013,3:76.
[12] Broz P,Monack DM.Molecular mechanisms of inflammasome activation during microbial infections[J].Immunol Rev,2011,243:174- 190.
[13] Nakahira K,Haspel JA,Rathinam VA,etal.Autophagy proteins regulate innate immune response by inhibiting NALP3 inflammasome-mediated mitochondrial DNA release[J].Nat Immunol,2011,12:222- 230.
[14] Schroder K,Tschopp J.The inflammasomes[J].Cell,2010,14:821- 32.
[15] Sandanger Ø,Ranheim T,Vinge LE,etal.The NLRP3 inflammasome is up-regulated in cardiac fibroblasts and mediates myocardial ischaemia-reperfusion injury[J].Cardiovasc Res,2013,99:164- 74.
[16] Takahashi M.NLRP3 in myocardial ischaemia-reperfusion injury:inflammasome-dependent or-independent role in different cell types[J].Cardiovasc Res,2013,99:4- 5.
[17] Duewell P,Kono H,Rayner KJ,etal.NLRP3 inflamasomes are required for atherogenesis and activated by cholesterol crystals that form early in disease[J].Nature,2010,466:652.
[18] Frostegård J.Immunity,atherosclerosis and cardiovascular disease[J].BMC Med,2013,11:117.
[19] Oslowski CM,Hara T,O’Sullivan-Murphy B,etal.Thioredoxin-interacting protein mediates ER stress-induced βcell death through initiation of the inflammasome[J].Cell Metab,2012,16:265- 73.
[20] Cronstein BN,Sunkureddi P.Mechanistic aspects of inflammation and clinical management of inflammation in acute gouty arthritis[J].J Clin Rheumatol,2013,19:19- 29.
[21] Parajuli B,Sonobe Y,Horiuchi H,etal.Oligomeric amyloid β induces IL- 1β processing via production of ROS:implication in Alzheimer’s disease[J].Cell Death Dis,2013,4:e975.
[22] Turner CM,Arulkumaran N,Singer M,etal.Is the inflammasome a potential therapeutic target in renal disease?[J].BMC Nephrol,2014,15:21.
[23] Zhong Y,Kinio A,Saleh M.Functions of NOD-like receptors in human diseases[J].Front Immunol,2013,4:333.
新闻点击
公鼠交配前摄取高脂肪饮食会增加后代体质量与体脂
据美国国家科学院学报(PNAS)网站2013-06- 24报道,最近一项美国俄亥俄大学在对小鼠的研究中发现,父亲的饮食其实也会影响其后代健康,尤其是雄性后代。
这个研究将雄性小鼠分为两组喂食13周,实验组为饮食总热量的45%是从脂肪中摄取,而控制组的该比例降为10%,但两组总热量都相同,结果摄取高脂肪食物的小鼠变胖。研究再让所有小鼠与摄取低脂肪饮食的雌鼠交配繁殖,并让所有后代小鼠都吃标准的实验饲料,再分别在它们出生后的20d、6周、6个月及12个月测量体质量与体脂。
结果发现,与控制组相比较,实验组的雄性后代在出生后6周时体质量已经比较重,且体质量增加情形在第6个月及第12个月都持续不变,而体脂部分同样也在出生后6个月,出现比控制组的雄性后代较高的状况。研究解释,两组呈现差异有可能是表观基因改变所致,也就是说内在与外在环境因素对基因产生影响。
实验组的雄性后代在第6周开始变得活跃,雌性后代状况在出生后第6个月及第12个月比雄性后代表现更佳,这可能有助于停止体脂的增加,并降低糖尿病及心脏病的风险,而研究也正在了解出现性别差异背后的原因。
研究表示,越来越多小孩及青少年、青少女受肥胖影响,如果我们能提早找出能侦测与预测肥胖与糖尿病的标记,将会有助于人们选择健康的生活型态、及有效介入以延缓或避免相关疾病的发生。
该研究刊载于第95届内分泌学会年会(The Endocrine Society’s 95th Annual Meeting in San Francisco)。
科学家探索如何阿用司匹林预防癌症
2013-06-20《美国新闻与世界报道·每日健康新闻》(U.S.News & World Report·HealthDay Reporter)报道,有研究报告说,阿司匹林似乎能减缓可导致疾病的基因突变率,未来也许可以用来对付癌症。
美国加州大学研究人员分析了13例称为Barrett食管的可导致食道癌的组织样本,患者被随访6~19年之间,患者在研究过程中在不同的时间服用阿司匹林。在采集组织样本对比中发现,服用阿司匹林患者其组织基因突变比没有服用阿司匹林的患者平均慢了10倍,说明阿司匹林可能有减缓可导致疾病基因突变率的作用,然而,这项研究并没有证明阿司匹林和基因突变的速率较慢的原因和效果之间的联系。
该研究 在线发表于PLoS遗传学杂志(journal PLoS Genetics)。
Research advances in NLRP3 inflammasome
WEI Qi,CHENG Xiao-shu*
(Dept. of Cardiology,the Second Affliated Hospital of Nanchang University,Nanchang 330006,China)
Inflammasomes are multiprotein complexes that can recognize pathogenic microorganisms and stress-associated endogenous molecules and play an important role in innate immune system.Inflammasomes cause inflammation response by inducing maturation of inflammatory cytokines interleukin(IL)- 1β and IL- 18 through activation of caspase- 1,and involve in the pathogenesis of various diseases such as cryopyrin-associated periodic syndrome, ischemia-reperfusion injury and atherosclerosis.
inflammasome;NLRP3;IL- 1β
2014- 04- 08
2014- 07- 18
国家“十二五”科技支撑计划(2013BAI05B10)
1001-6325(2015)01-0117-05
R5
A
*通信作者(corresponding author):xiaoshumenfan@126.com
