上调miR- 200a的表达减弱TGF-β1刺激的大鼠胰腺星状细胞活化和胶原合成
2015-08-07张尤历王国英
张尤历,王国英,赵 义,李 萍,刘 鑫,倪 鑫,徐 岷
(江苏大学 附属医院 消化内科, 江苏 镇江 212000)
研究论文
上调miR- 200a的表达减弱TGF-β1刺激的大鼠胰腺星状细胞活化和胶原合成
张尤历,王国英,赵 义,李 萍,刘 鑫,倪 鑫,徐 岷*
(江苏大学 附属医院 消化内科, 江苏 镇江 212000)
目的探讨miR- 200a对转化生长因子β1(TGF-β1)刺激的大鼠胰腺星状细胞(PSCs)活化和胶原蛋白合成的影响。方法用组织块法培养分离PSCs,免疫荧光染色检测结蛋白(desmin)、神经胶质原纤维酸性蛋白(GFAP)和α-平滑肌肌动蛋白(α-SMA)的表达鉴定PSCs;取新鲜培养的第2代PSCs,设空白对照组、TGF-β1组、TGF-β1+miR- NC组、TGF-β1+miR- 200a mimic组,Western blot法和细胞免疫荧光染色法检测α-SMA和Ⅰ型胶原蛋白(collagen Ⅰ)的表达,荧光定量PCR检测α-SMA、collagen Ⅰ mRNA及miR- 200a的表达。结果TGF-β1可刺激大鼠PSCs活化及促进胶原蛋白的合成(P<0.05),且呈时间依赖性;转染miR- 200a mimic后,在相同浓度的TGF-β1刺激下,α-SMA和collagen Ⅰ的蛋白和mRNA表达明显降低(P<0.01)。结论上调miR- 200a的表达,可减弱TGF-β1对大鼠PSCs活化和胶原蛋白合成的刺激作用,其可能的机制是抑制TGF-β1的生物学作用。
TGF-β1;PSCs;miR- 200a;纤维化
慢性胰腺炎(chronic pancreatitis,CP)主要的病理学改变是胰腺组织纤维化和细胞外基质(extracellular matrix,ECM)异常沉积[1]。胰腺星状细胞(pancreatic stellate cells,PSCs)是纤维化过程中主要的始动和效应细胞。正常情况下,PSCs呈静息状态;当胰腺受到刺激时,PSCs可活化为肌成纤维样细胞,失去维生素A脂滴,表达特异性标志物α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA),合成大量ECM,主要有Ⅰ、Ⅲ型胶原蛋白(collagen Ⅰ,Ⅲ)和纤维连接蛋白(fibronectin,FN)等[2]。
MicroRNA(miRNA)通过调节靶基因调控一系列细胞功能,如增殖、分化和致癌等[3- 4]。研究表明miR- 200a在器官纤维化中起了重要作用,但是在胰腺纤维化中的作用尚不清楚[5]。本研究旨在探讨miRNA- 200a对TGF-β1刺激的大鼠PSCs活化和胶原合成的影响,为胰腺纤维化的基因治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级SD雄性大鼠(江苏大学实验动物中心提供,合格证号:scxk(苏)2013- 0011),体质量200~250 g,实验前12 h禁食,自由饮水。
1.1.2 试剂:重组TGF-β1(Pepro Tech公司),神经胶质原纤维酸性蛋白(GFAP)、结蛋白(desmin)、α-SMA和collagen Ⅰ单克隆抗体(Abcam公司),HRP标记的二抗和Cy3标记的荧光二抗(北京康为世纪生物公司),miR- 200a mimic(广州锐博生物公司)。
1.2 组织块贴壁培养分离PSCs
腹腔注入苯巴比妥钠麻醉大鼠,75%乙醇消毒后超净台内快速分离出胰腺组织,磷酸缓冲盐溶液(PBS)洗3次,剪成约1 mm×1 mm×1 mm大小组织块,加入培养基均匀接种于培养瓶中,置于37 ℃、5% CO2培养箱孵育1 h后更换新的培养基。培养24 h后有细胞爬出,5~7 d细胞开始快速增殖,进行传代,取第2代PSCs作为研究对象。
1.3 细胞转染
转染前1天,接种1×105/孔的PSCs至6孔板中,加入不含抗生素的培养基,用LipofectamineTM2000介导转染。转染方法按照说明书进行,miR- NC及miR- 200a mimic用量(50 nmol/L)为推荐的最适浓度。转染72 h后观察转染率及细胞形态,并收集细胞备用。
1.4 免疫荧光染色法鉴定PSCs及检测α-SMA和collagen Ⅰ蛋白表达
将细胞接种于24孔板(1×103个/孔),贴壁后4%多聚甲醛4 ℃固定过夜, 0.3% TritonX- 100作用8 min,加3% BSA 37 ℃孵育1 h,一抗4 ℃过夜,荧光标记二抗37 ℃孵育1 h,核荧光染色37 ℃ 30 min,甘油封片荧光显微镜下观察。
1.5 Western blot检测α-SMA和collagen Ⅰ蛋白表达
取对数增殖期PSCs以3×105个接种于培养瓶中,贴壁后加入TGF-β1使其终浓度为10 μg/L。分别作用24、48和72 h后收集细胞总蛋白,BCA法定量,各取等量样品经10%聚丙烯酰胺凝胶电泳分离后电转移至PVDF膜上,5%脱脂奶粉室温摇床上封闭2 h,一抗(α-SMA 抗体1∶1 000稀释、collagen Ⅰ抗体1∶500稀释,β-actin抗体1∶1 000稀释)4 ℃孵育过夜,二抗37 ℃温箱孵育1 h, ECL化学发光显色,凝胶成像系统分析处理,取各目的蛋白与内参照吸光度的比值作为目的蛋白的相对表达量,实验重复3次。
1.6 荧光定量PCR检测α-SMA、collagenⅠ mRNA和miR- 200a的表达量
按照Trizol试剂说明书提取各组细胞的总RNA,合成cDNA,进行荧光定量PCR。目的基因α-SMA、collagen Ⅰ和内参基因β-actin引物(表1)由上海生物工程公司设计合成。反应条件为:95 ℃预变性30 s,95 ℃ 5 s,60 ℃退火20 s,72 ℃延伸1 min,40个循环。miR- 200a及内参U6引物由广州锐博生物公司设计合成。反应条件为:95 ℃预变性20 s,95 ℃ 10 s,60 ℃退火20 s,72 ℃延伸10 s,40个循环。所有数据均采用2-ΔΔCt法进行相对定量分析,实验重复3次。
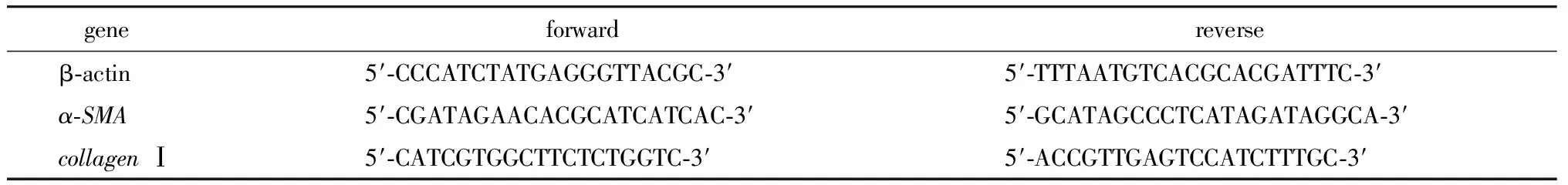
表1 定量PCR引物
1.7 统计学分析
2 结果
2.1 大鼠PSCs的鉴定
新鲜分离的PSCs在倒置显微镜下观察向四周伸出突起,呈星形或不规则状,细胞系与质比例较大,可见到贮脂颗粒,接种72 h后细胞星形外观最明显,1周后体积变大,约60%~70%汇合,脂滴基本消失(图1)。免疫荧光染色后镜下观察约90%的细胞阳性表达Desmin和GFAP,而α-SMA几乎不表达(图2)。
2.2 PSCs中 α-SMA和collagen Ⅰ的差异表达
与空白对照组相比,TGF-β1刺激24、48和72 h后,PSCs中α-SMA和collagen Ⅰ蛋白表达量随着刺激时间的延长逐渐增多(图3A); TGF-β1刺激72 h后,α-SMA、collagen ⅠmRNA表达量显著高于对照组(图3B)。
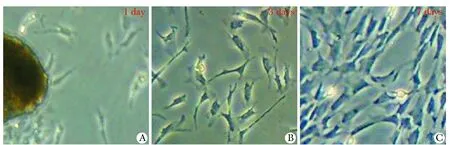
A,B,C.represent the form of PSCs cultured after 1, 3, 7 days
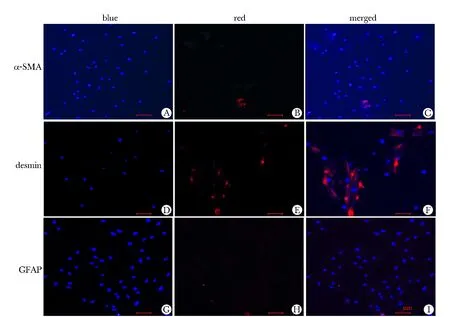
A, B, C.represent the expression of α-SMA; D, E, F.represent the expression of desmin; G, H, I. represent the expression of GFAP, results of each were presented with Hoechst33342 labeled blue fluorescence, Cy3 labeled red fluorescence and blue-red merged fluorescence
图2 免疫荧光染色检测α-SMA、Desmin、GFAP的表达鉴定PSCs
Fig 2 PSCs were identified by testing α-SMA, Desmin and GFAP with immunofluorescence(×100)
2.3 荧光定量PCR检测PSCs中miR- 200a的表达
TGF-β1组中,miR- 200a的相对表达量为0.24±0.03,显著低于对照组(P<0.001)。
2.4 miR- 200a 对α-SMA和collagen Ⅰ表达的影响
由于TGF-β1组中miR- 200a表达量较低,因此将miR- 200a mimic转入细胞中,使miR- 200a过表达,同时检测α-SMA 和collagen Ⅰ的表达。Western blot和荧光定量PCR结果都显示miR- NC+TGF-β1组α-SMA和collagen Ⅰ mRNA及蛋白的表达与TGF-β1组无明显变化;过表达miR- 200a组,两者的相对表达量较miR- NC组明显减少(P<0.01)(图4)(表2,3),免疫荧光染色结果与上述结果一致(图5)。
3 讨论
慢性胰腺炎是由多因素引起的胰腺组织结构和功能持续进行性损害,典型病理改变为胰腺实质纤维化、腺泡萎缩、炎性细胞浸润,而胰腺纤维化的主要特征是大量成纤维细胞增生和ECM沉积,其发生机制是目前研究的热点之一。近年来大量研究揭示PSCs在胰腺纤维化的进程中具有重要作用,是多种诱因作用的靶点。正常胰腺组织内星状细胞呈静止状态,无促纤维化作用,胰腺损伤时各种刺激因子如氧化应激、细胞因子或基因表达调控等使其激活[6]。TGF-β1是急慢性胰腺炎中刺激PSCs活化的重要细胞因子,可刺激胶原蛋白的合成[6- 7]。雨蛙肽诱导的胰腺炎小鼠模型中TGF-β1 mRNA和蛋白的表达与Ⅰ型、Ⅲ型胶原的mRNA增加水平相平行[8]。本研究通过组织块法提取、体外培养大鼠PSCs,免疫荧光染色鉴定PSCs,TGF-β1刺激细胞,光镜下观察其形态学改变,Western blot和荧光定量PCR结果检测α-SMA、collagen Ⅰ蛋白及基因的表达量,发现TGF-β1可促进大鼠PSCs活化和ECM的合成。
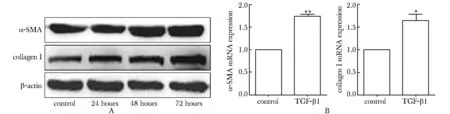
A.the expressions of α-SMA and collagen Ⅰ protein in PSCs after TGF-β1 treating for 24, 48 and 72 hours; B.the expressions of α-SMA and collagen Ⅰ mRNA in PSCs after TGF-β1 treating for 72 hours;*P<0.05,**P<0.01 compared with control group
图3 TGF-β1对PSCs活化及胶原蛋白合成的影响
Fig 3 Effect of TGF-β1 on activation and collagen synthesis of PSCs
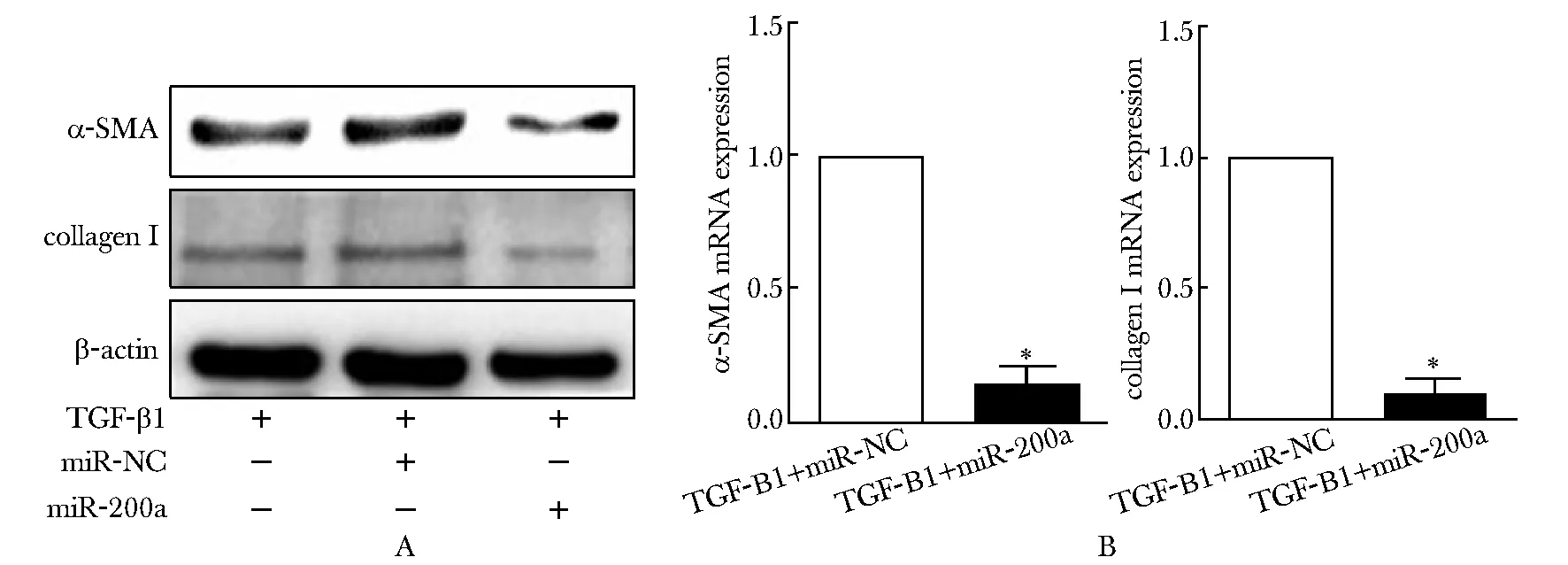
After transfection of miR- 200a mimic; A.the expressions of α-SMA and collagen Ⅰ protein in PSCs detected by Western blot; B.the expressions of α-SMA and collagen Ⅰ mRNA in PSCs measured by RT-qPCR;*P<0.01 compared with TGF-β1+miR-NC group
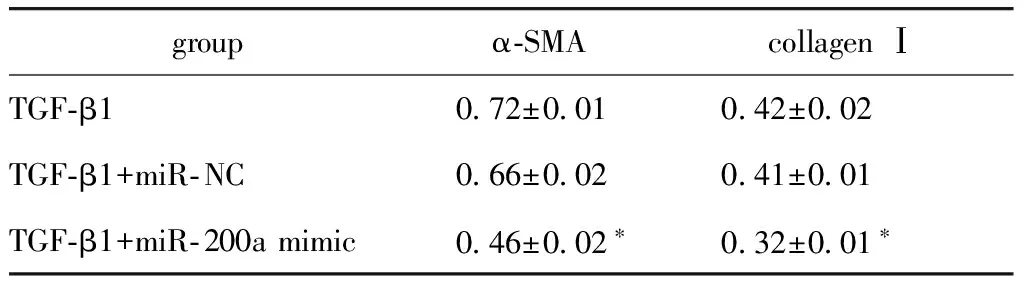
图4 过表达miR- 200a 对TGF-β1引起的PSCs活化和胶原合成的影响
*P<0.001 compared with TGF-β1+miR- NC group.
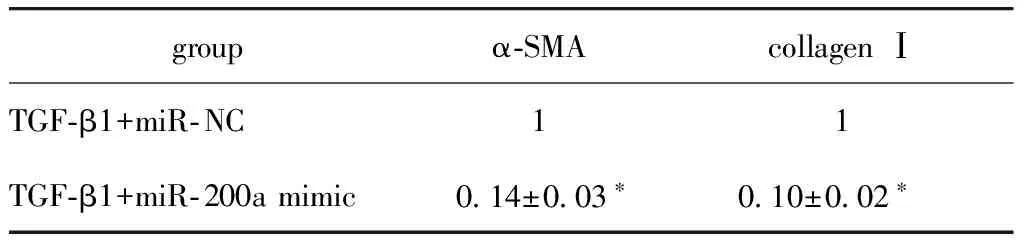
表3 过表达miR- 200a 后α-SMA和collagen ⅠmRNA的相对表达量
*P<0.01 compared with TGF-β1+miR- NC group.
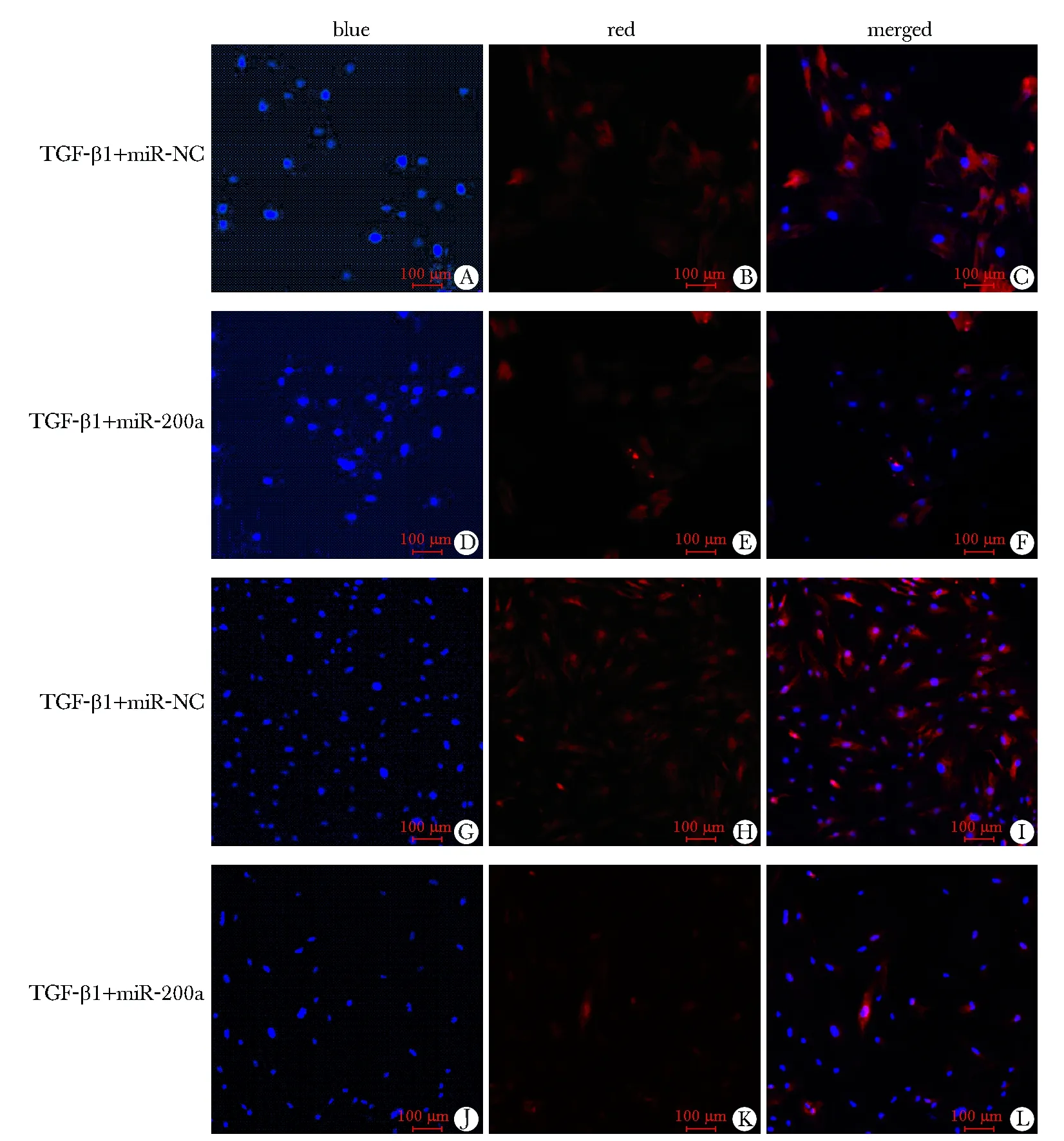
A, B, C, G, H, I.represent the expression of α-SMA and collagen Ⅰ after TGF-β1 treating; D, E, F, I, K, L.represent the expression of α-SMA and collagen Ⅰ after transfection of miR- 200a mimic, results of each group were presented with Hoechst33342 labeled blue fluorescence, Cy3 labeled red fluorescence and blue-red merged fluorescence
图5 过表达miR- 200a 对PSCs活化和胶原合成的影响
Fig 5 Effect of miR- 200a on activation and collagen secretion of PSCs(Scale bar=100 μm)
MicroRNA是一种具有调控功能的非编码RNA,通过降解靶mRNA或者阻遏其翻译来调控靶基因的表达。研究发现在肺纤维化过程中miR- 200家族成员miR- 200a、miR- 200b、miR- 200c的表达显著下降,而上调miR- 200a、miR- 200b、miR- 200c可反转TGF-β1诱导的肺泡细胞EMT[9];在TGF-β1诱导活化的HSCs中,内源性miR- 200a的表达是下降的,过表达miR- 200a可以显著抑制α-SMA的活力以及活化HSCs的增殖[10];本研究通过转染miR- 200a mimic后,显著减轻了TGF-β1诱导的大鼠PSCs的活化和ECM的合成,提示miR- 200a能影响TGF-β信号通路进而触发一系列生物学改变。
综上所述:TGF-β1在PSCs活化,促进ECM的合成,抑制ECM降解过程中发挥了重要作用;本研究通过上调miR- 200a的表达,可明显抑制TGF-β1引起的PSCs的活化和 ECM的合成。根据已有研究及本研究结果推测其机制至少是miR- 200a通过调控TGF-β1的生物学作用而实现,提示miR- 200a是慢性胰腺炎胰腺纤维化基因治疗的潜在靶点。但由于一个miRNA可以调控数十乃至上千的基因,故深入研究TGF-β1在PSCs活化和致胰腺纤维化过程中的分子机制以及miR- 200a通过调控哪些关键信号通路和靶基因起作用,可为胰腺纤维化提供新的基因治疗靶点。
[1]itt H, Apte MV, Keim V,etal. Chronic pancreatitis: challenges and advances in pathogenesis, genetics, diagnosis, and therapy [J]. Gastroenterology, 2007, 132: 1557- 1573.
[2] achem MG, Zhou Z, Zhou S,etal. Role of stellate cells in pancreatic fibrogenesis associated with acute and chronic pancreatitis [J]. J Gastroenterol Hepatol, 2006, 21: S92- 96.
[3] lmeida MI, Reis RM, Calin GA. MicroRNA history: discovery, recent applications, and next frontiers [J]. Mutat Res, 2011, 717: 1- 8.
[4] icolas FE, Lopez-Martinez AF. MicroRNAs in human diseases [J]. Recent Pat DNA Gene Seq, 2010, 4: 142- 154.
[5] ang B, Koh P, Winbanks C,etal. miR- 200a Prevents renal fibrogenesis through repression of TGF-beta2 expression [J]. Diabetes, 2011, 60: 280- 287.
[6] pte M, Pirola R, Wilson J. The fibrosis of chronic pancreatitis: new insights into the role of pancreatic stellate cells [J]. Antioxid Redox Signal, 2011, 15: 2711- 2722.
[7] an G, Williams CA, Salter K,etal. A role for TGFbeta signaling in the pathogenesis of psoriasis [J]. J Invest Dermatol, 2010, 130: 371- 377.
[8] ress T, Muller-Pillasch F, Elsasser HP,etal. Enhancement of transforming growth factor beta 1 expression in the rat pancreas during regeneration from caerulein-induced pancreatitis [J]. Eur J Clin Invest, 1994, 24: 679- 685.
[9] ang S, Banerjee S, de Freitas A,etal. Participation of miR- 200 in pulmonary fibrosis [J]. Am J Pathol, 2012, 180: 484- 493.
[10] Sun X, He Y, Ma TT,etal. Participation of miR- 200a in TGF-beta1-mediated hepatic stellate cell activation [J]. Mol Cell Biochem, 2014, 388: 11- 23.
Up-regulation of miR- 200a attenuates TGF-β1-induced activation and collagen synthesis in rat pancreatic stellate cells
ZHANG You-li, WANG Guo-ying, ZHAO Yi, LI Ping, LIU Xin, NI Xin, XU Min*
(Dept. of Gastroenterology, Affiliated Hospital of Jiangsu University, Zhenjiang 212000, China)
Objective To investigate the effect of miR- 200a mimic on transforming growth factor β1-mediated activation and collagen secretion of rat pancreatic stellate cells. Methods PSCs were isolated and cultured from pancreatic tissue and identified by desmin, GFAP and α-SMA immunofluorescence staining. PSCs of 2nd generation were divided into control group, TGF-β1 group, TGF-β1+miR- NC group and TGF-β1+miR- 200a mimic group. α-SMA and collagen Ⅰ protein were measured by Western blot and immunofluorescence staining. The mRNA of α-SMA and collagen Ⅰ and the expression of miR- 200a were detected by quantitative real-time PCR. ResultsTGF-β1 stimulates the activation of PSCs and promote collagen synthesis in time-dependment manner (P<0.05). After transfection of the mimic, treating with the same concentration of TGF-β1, the expressions of protein and mRNA of both α-SMA and collagen Ⅰ decreases significantly (P<0.01). Conclusions Over-expression of miR- 200a significantly attenuates α-SMA activity and further affects the collagen synthesis of TGF-β1-dependent activation of PSCs. The mechanisms are potentially related to the biological effects of TGF-β1.
TGF-β1; PSCs; miR- 200a; fibrosis
2014- 05- 15
2014- 08- 25
江苏省自然科学基金(BK2013247);镇江市“169四期工程”科研项目[镇人才办(2013)19号]
1001-6325(2015)01-0048-06
R576
A
*通信作者(corresponding author):peterxu1974@163.com
