RNAi双沉默Survivin和hTERT基因抑制人结肠癌SW480细胞增殖促进凋亡
2015-08-07董俊红王守训刘顺梅
肖 琳,王 平,董俊红,王守训,刘顺梅
(潍坊医学院 基础医学院 生化教研室, 山东 潍坊 261042)
研究论文
RNAi双沉默Survivin和hTERT基因抑制人结肠癌SW480细胞增殖促进凋亡
肖 琳,王 平,董俊红,王守训*,刘顺梅
(潍坊医学院 基础医学院 生化教研室, 山东 潍坊 261042)
目的探讨双向沉默Survivin和hTERT基因对结肠癌SW480细胞增殖和凋亡的影响,为结肠癌的基因治疗提供实验依据。方法设计并构建能够稳定转录shRNA并可分别及联合干扰Survivin和hTERT分子表达的质粒,将其转染结肠癌SW480细胞后, 分阴性对照组、空白质粒对照组、 Survivin RNAi组、hTERT RNAi组和Survivin-hTERT RNAi组。转染48h后 TRAP-PCR-ELISA 法检测端粒酶活性,RT-PCR 法检测Survivin和hTERT mRNA的表达,Western blot检测Survivin和 hTERT蛋白的表达,流式细胞仪及cck-8法分别检测细胞凋亡和细胞增殖的变化。结果Survivin-hTERT RNAi组SW480细胞端粒酶活性明显下降(P<0.01),Survivin-hTERT RNAi组Survivin及hTERT的mRNA水平较正常对照组分别减低82.8%和73.6%(P<0.01),蛋白表达抑制率分别为79.2%和66.7%(P<0.01)。实验各组中Survivin-hTERT RNAi组细胞增殖抑制率和凋亡率最高,分别为43.6%±0.1%和39.2%±2.3%(P<0.01)。结论Survivin和hTERT双干扰质粒可明显下调Survivin和hTERT蛋白的表达,抑制结肠癌SW480细胞的增殖,促进其凋亡。
RNA干扰;Survivin;hTERT;结肠癌
结肠癌(colorectal cancer,CRC)是比较常见的消化道恶性肿瘤,也是主要的致死性疾病之一,在欧美国家,结肠癌在恶性肿瘤死亡原因中排第2位[1- 2]。而在中国,在人们饮食结构改变、高度的工作、精神压力以及空气环境污染等多种因素的作用下,结肠癌的发病率逐年上升。同时结肠癌易发生转移,治疗效果差,因此本研究选取Survivin和hTERT这两个跟结肠癌发生、发展密切相关的两个基因用RNAi的方式以探讨如何更好的治疗结肠癌。Survivin是凋亡抑制蛋白家族(IAPs)的重要成员之一,在细胞周期、细胞凋亡以及肿瘤血管的形成中都发挥着重要的作用[3]。端粒酶已被公认为已知的最广谱的肿瘤标志物之一,在多种肿瘤中均有不同程度的表达[4]。本研究同时沉默Survivin和hTERT基因, 探讨其对结肠癌细胞增殖及凋亡的影响。
1 材料与方法
1.1 材料
人结肠癌SW480细胞系(上海细胞库),L-15培养基和胎牛血清(Gibco公司),Trizol、反转录试剂盒、限制性内切酶及T4 DNA连接酶(TaKaRa公司),PCR-TRAT-ELISA端粒酶活性检测试剂盒、FuGENE HD转染试剂盒(Roche公司),质粒pGenesil- 1.2(武汉晶赛生物工程技术有限公司),Survivin和hTERT单克隆抗体(CST公司),中量质粒DNA提取试剂盒(Qiagen公司),CCK- 8试剂盒(日本同仁化学研究所),深圳华大基因科技服务有限公司测序。
1.2 方法
1.2.1 shRNA表达载体的构建:Survivin(NM_001168)与hTERT(NM_198253)基因序列来自GenBank,分别设计3组干扰序列,预实验筛选出高效、特异性强的一组干扰序列,Survivin的靶向干扰序列为5′-GGACCACCGCATCTCTACA-3′,hTERT的靶向干扰序列为5′-AAGAACGTGCTGGCCTTCG-3′,经Blast分析证明与人类其他编码序列无同源性。将合成的shRNA退火片段分别与pGenesil- 1.1和pGenesil- 1.2线性化载体连接,分别构建pGenesil- 1.1-Survivin、pGenesil- 1.2-hTERT单干扰载体和pGenesil1.1-Survivin-hTERT双干扰载体,经酶切鉴定及DNA测序证实载体构建成功[5]。
1.2.2 细胞培养:人结肠癌细胞SW480培养于L15培养液,添加10%胎牛血清、100 mg/L链霉素、100 U/mL青霉素,在37 ℃、5% CO2温箱培养,细胞贴壁增殖,待细胞覆盖瓶底至70%~80%时用0.25%胰蛋白酶消化传代。
1.2.3 细胞转染:取对数增殖期的SW480细胞,在转染前1 d,用胰蛋白酶消化并计数, 用血清的培养基调整细胞至3×105/mL,铺板在12孔板中,每孔加入0.5 mL。分组转染(FuGENE HD∶DNA=2∶1),实验设空白对照组、空白质粒对照组(转染pGenesil- 1.1空质粒),Survivin RNAi组(转染pGenesil- 1.1-Survivin)、hTERT RNAi组(转染pGenesil- 1.2-hTERT)和Survivin-hTERT RNAi组(转染pGenesil1.1- Survivin-hTERT),放置于37 ℃,5% CO2孵育箱中孵育24~48 h,转染过程按FuGENE HD转染试剂盒说明书进行。
1.2.4 半定量RT-PCR法检测各组Survivin及hTERTmRNA:待细胞转染后48 h,按说明书用Trizol试剂提取细胞总RNA。参照RT-PCR试剂盒说明进行反转录和PCR扩增,以管家基因GAPDHmRNA作为内参照。引物序列如下:GAPDH 5′-ATG GCACCGTCAAGGCTGAG-3′(上游引物),5′-GCAGT GATGGCATGGACTGT-3′(下游引物),扩增产物约379 bp。Survivin:5′-GACAGATGAAGGTTGGG-3′(上游引物),5′-AGGTGGATGAGGAGACAGA-3′(下游引物),扩增产物约228 bp。hTERT:5′-TCATCGCCAG CATCATCAAAC-3′(上游引物),5′-ATGTACGGCTG GAGGTCTGTCA-3′(下游引物),扩增产物约136 bp。反应结束后分别取各组PCR产物进行琼脂糖电泳,Bio-1D凝胶分析系统进行PCR产物的半定量分析。
1.2.5 Western blot法检测Survivin和hTERT蛋白表达:转染48 h后,收集各组细胞,利用RIPA裂解液裂解细胞提取总蛋白,用BCA法进行蛋白定量。每孔取40 μg蛋白上样,进行SDS-PAGE电泳,电泳结束后将产物转至聚偏二氟乙烯(PVDF)膜上,用含5%脱脂奶粉的TBST室温封闭1 h,加入一抗(兔抗人Survivin单抗1∶1 000稀释;鼠抗人hTERT单抗1∶500稀释;鼠抗人β-actin单抗1∶1 000稀释),4 ℃孵育过夜,PBS洗膜,分别加入HRP标记的二抗(1∶20 000鼠抗兔IgG),室温孵育2 h,PBS洗膜,ECL化学发光试剂反应处理、曝光、显影,对蛋白质条带进行分析。目标蛋白的相对表达量=A目标蛋白/Aβ-actin。抑制率= (1-转染组目标蛋白的相对表达量/空白对照组的相对表达量)×100%。
1.2.6 TRAP-ELISA法测定细胞端粒酶活性:转染后48 h后,收集各组细胞方法采用端粒重复序列扩增-酶联免疫吸附实验(telomeric repeat am-plification protocol-enzyme linked immunosor-bentassay,TRAP-ELISA)法,每组取约5×106个细胞,加入裂解液,提取细胞的核蛋白,用BCA法进行蛋白定量。取待测样品50 μg,按照PCR-TRAT-ELISA试剂盒的说明进行端粒酶活性检测。用酶联免疫检测仪测各组450 nm和690 nm波长处的吸光度(A)值。每孔A值=A450 nm-A690 nm。
1.2.7 CCK- 8测定SW480细胞增殖抑制率:取对数增殖期的SW480细胞,胰蛋白酶消化,调整为1×104/mL,接种于96孔培养板,每孔100 μL,每组设8个复孔。转染实验分为空白调零对照组(不含细胞)、空白对照组、空白质粒对照组、Survivin RNAi组、hTERT RNAi组、Survivin-hTERT RNAi组,待细胞贴壁后进行质粒转染,转染48 h后,每孔加入CCK- 8试剂10 μL,继续培养1 h后用酶标仪用450 nm波长测吸光度值(A值)。取8 孔平均值,计算抑制率。细胞抑制率IR(100%)=[1-(干扰组A值-空白调零对照组A值)/(空白对照组A值-空白调零对照组A值)]×100%。
1.2.8 流式细胞仪检测细胞凋亡:转染后48 h,将各组细胞用不含乙二胺四乙酸(EDTA)的胰蛋白酶消化收集, 用PBS及缓冲液各洗涤细胞1次,离心后每组收集5×106个细胞,加入100 μL 结合缓冲液悬浮细胞,加5 μL Annexin V-APC混匀,再加入5 μL PI混匀,室温避光反应15 min,用流式细胞仪检测(Ex=633 nm; Em=670 nm)细胞凋亡的情况。
1.3 统计学分析
2 结果
2.1 mRNA水平表达
与空白对照组、空白质粒对照组相比,各干扰组mRNA相对表达量均有降低,其中双干扰组的SurvivinmRNA和hTERTmRNA表达水平下调最明显,相对含量明显降低(P< 0.01),其表达受到明显的抑制(图1,表1),双干扰组的mRNA表达抑制率为82.8%(Survivin)和73.6%(hTERT) (P<0.05)。
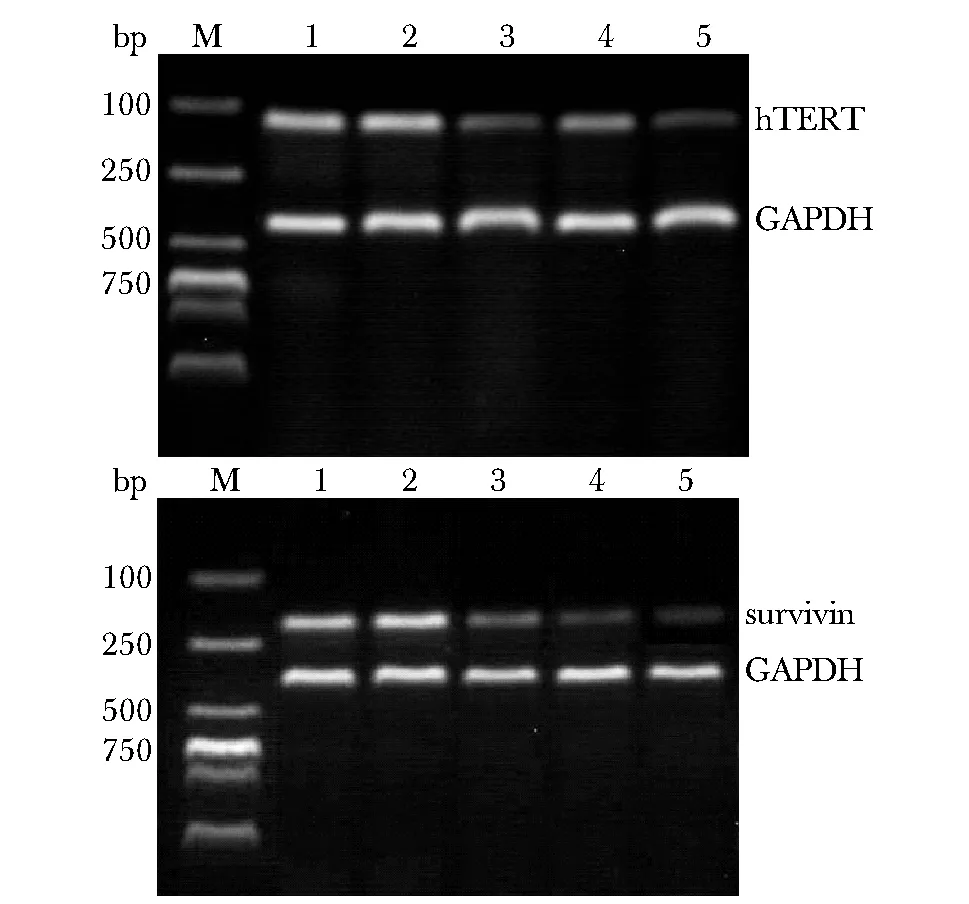
M.DL2000 marker;1.blank group;2.blank Plasmid control group;3.hTERT RNAi group;4.Survivin RNAi group;5.Survivin-hTERT RNAi group图1 各组hTERT mRNA和Survivin mRNA表达电泳图Fig 1 Electrophoregram of hTERT and Survivin mRNA level in various groups

Table 1 hTERT and Survivin mRNA expression
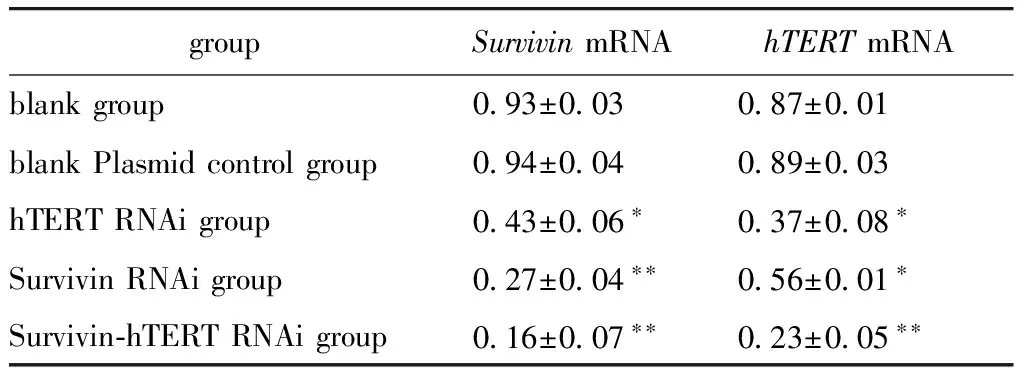
groupSurvivinmRNAhTERTmRNAblankgroup 093±003 087±001blankPlasmidcontrolgroup 094±004 089±003hTERTRNAigroup 043±006∗ 037±008∗SurvivinRNAigroup 027±004∗∗ 056±001∗Survivin⁃hTERTRNAigroup 016±007∗∗ 023±005∗∗
*P<0.05,**P<0.01 compared with blank group.
2.2 Western blot法检测蛋白水平表达
与空白对照组、空白质粒对照组相比,各干扰组Survivin蛋白和hTERT蛋白表达均有下调,其中双干扰组的Survivin蛋白和hTERT蛋白水平下调最为明显,相对含量有明显的降低(P<0.01),表达水平受到明显抑制(图2,表2)。双干扰组的蛋白表达抑制率为79.2%(Survivin)和66.7%(hTERT)。
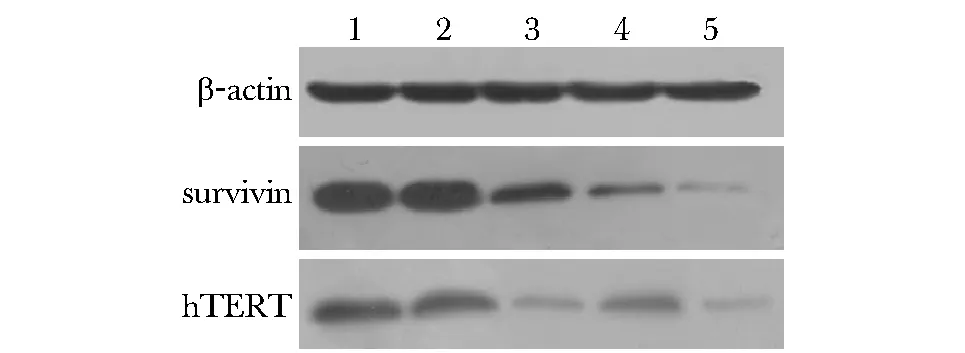
1.blank group;2.blank plasmid control group;3.hTERT RNAi group;4.Survivin RNAi group;5.Survivin-hTERT RNAi group图2 hTERT蛋白和Survivin蛋白的表达Fig 2 Survivin and hTERT protein expression
2.3 端粒酶活性测定结果
TRAP-PCR ELISA检测的结果显示各干扰组端粒酶活性均有降低(表3),其中hTERT RNAi组和Survivin-hTERT RNAi组的端粒酶活性降低明显。
表2 各组Survivin蛋白和hTERT蛋白表达相对含量

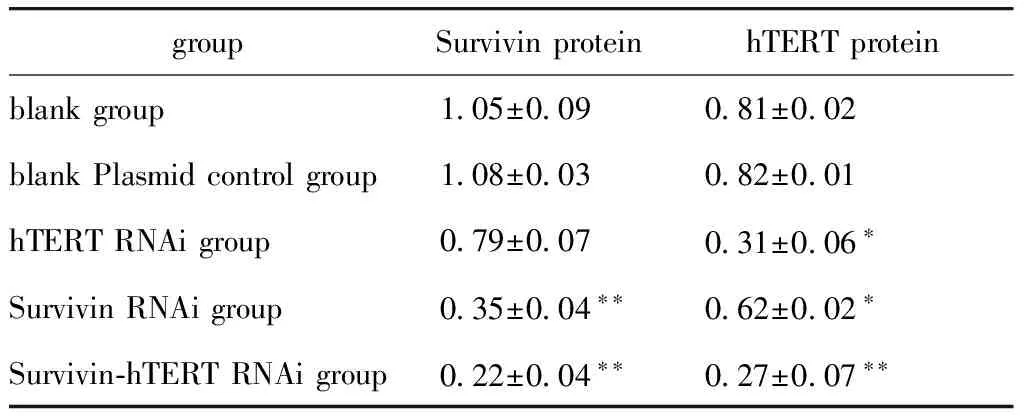
groupSurvivinproteinhTERTproteinblankgroup 105±009 081±002blankPlasmidcontrolgroup 108±003 082±001hTERTRNAigroup 079±007 031±006∗SurvivinRNAigroup 035±004∗∗ 062±002∗Survivin⁃hTERTRNAigroup 022±004∗∗ 027±007∗∗
*P<0.05,**P<0.01 compared with blank group.
2.4 细胞增殖抑制作用
采用CCK- 8法检测SW480细胞增殖,结果显示,与空白对照组比较Survivin-hTERT RNAi组、Survivin RNAi组和hTERT RNAi组细胞增殖均受到明显抑制(表3),其中Survivin-hTERT RNAi组抑制增殖效果最明显(P<0.01)。
2.5 流式细胞仪检测
经流式细胞仪检测结果显示,各干扰组早期凋亡率均高于晚期凋亡率(图3),与空白对照组比较Survivin-hTERT RNAi组、Survivin RNAi组和hTERT RNAi组细胞凋亡率均明显升高,其中Survivin-hTERT RNAi组凋亡率最高(表3)。
3 讨论
目前结肠癌的治疗手段主要依靠手术和化疗放疗,但是疗效并不能令人满意,因此寻找一种基因治疗位点,可以为结肠癌的治疗提供理论依据。
Survivin蛋白是凋亡IAPs家族成员之一,在对大肠癌的研究中发现,Survivin蛋白在正常大肠上皮细胞中不表达,其表达发生在大肠腺癌恶性转化的早期,在癌变过程中起重要作用[6]。结肠癌中Survivin的表达62.9%阳性, 癌旁正常组织均无表达[7]。有多项研究表明,Survivin的表达上调与肿瘤凋亡指数下降、转移率增高、总体存活率缩短、预后不良和复发率增加有关[8]。
表3 各组端粒酶活性,细胞增值抑制率和细胞凋亡率
Table 3 The telomerase activity,the inhibitory rate of cell proliferation and the cell apoptosis rate
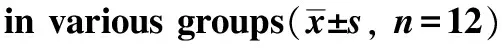
grouptelomeraseactivityinhibitoryrateofcellproliferation(%)cellapoptosisrate(%)blankgroup 1773±0014-- 311±05blankplasmidcontrolgroup 1766±0039-- 234±03hTERTRNAigroup 0844±0013∗ 314±02∗ 196±16∗SurvivinRNAigroup 1291±0022 253±02∗ 250±04∗Survivin⁃hTERTRNAigroup 0689±0042∗∗ 436±01∗∗ 392±23∗∗
*P<0.05,**P<0.01 compared with blank group.
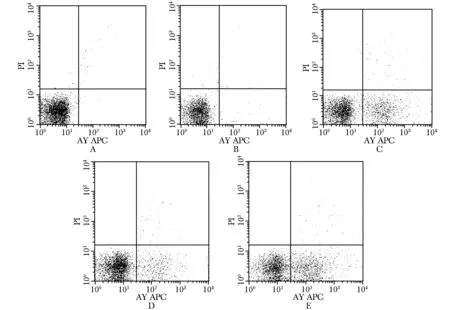
A.blank group;B.blank plasmid control group;C.hTERT RNAi group;D.Survivin RNAi group;E.Survivin-hTERT RNAi group
端粒酶全酶由端粒酶 RNA(human telomerase RNA,hTR)、端粒酶相关蛋白(telomerase related protein,TPI)和人端粒酶反转录酶(human telomerase reverse tran-scriptase,hTERT) 3部分组成,hTR和TPI在正常组织和肿瘤组织均有表达,与端粒酶活性无相关性,而hTERT作为端粒酶的催化亚基组分,具有反转录功能,即以端粒酶自身携带的RNA组分为模板,反转录合成互补DNA,其表达对端粒酶激活是必需的,是端粒酶激活的限速步骤[9- 10]。有研究表明hTERT在结肠癌中高表达,阳性表达率达80.8%,并且其表达与端粒酶活性及结肠癌的分期、病理生物学行为密切相关[11]。研究发现[12- 13]靶向hTERT mRNA的siRNA可有效抑制前列腺癌、鼻咽癌等肿瘤细胞的生长和增殖。
肿瘤的发生发展过程一般至少有两个或者两个以上功能不同、异常激活的基因共同发挥作用,因此本研究选取了两个与结肠癌的发生、发展密切相关的两个基因Survivin和hTERT,用RNAi的方式将其沉默,探寻更好治疗结肠癌的方法。结果显示分别沉默两基因的单干扰组在抑制细胞生长增殖、促进细胞凋亡及减少蛋白表达方面作用程度相当,而双干扰组Survivin-hTERT RNAi组与单干扰组相比抑制蛋白表达作用更强,细胞增殖抑制率及凋亡率均明显升高,而Survivin-hTERT RNAi组的端粒酶活性比hTERT RNAi组有一定程度的降低。这说明两基因在结肠癌的发生和发展过程中存在某种协同或互补作用,同时沉默Survivin和hTERT两个基因可以更好地抑制结肠癌细胞的增殖,促进其凋亡,为临床治疗结肠癌提供了新的理论基础。而如果将该技术应用于临床,以及Survivin和hTERT两个基因之间的相互协同促进作用到底通过哪些信号途径起作用有待于进一步的研究。
[1] JemalA, SiegelR, Xu J,etal.Cancer statistics[J].CACancer JClin, 2010, 60:277- 300.
[2] Ferlay J,Autier P,Boniol M,etal.Estimates of the cancer incidence and mortality in Europe in[J].Ann Oncol, 2007, 18:581- 592.
[3] Ambrosini G,Adida C,Alteri DC. A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma [J].Nat Med,1997,3:917- 921.
[4] Donate LE,Blasco MA. Telomeres in cancer and ageing,[J] Philos Trans R Soc Lond B Biol Sci, 2011,366:76- 84.
[5] 王 平,肖 琳,董俊红,等. survivin和hTERT双靶点表达载体的构建及对人结肠癌细胞的抑制作用[J].基础医学与临床, 2013, 33:1440- 1445.
[6] Lin LJ, Zheng CQ, Jin Y, Ma Yetal.Expression of survivin protein in human colorectal carcinogenesis[J].World J Gastroenterol, 2003, 9:974- 977.
[7] 毛银玲,徐刚,孟凡玲,等.P-STAT5和Survivin在结肠腺癌组织中的表达及临床意义[J].中国肿瘤临床,2011,38:716- 717.
[8] Pavlidou A, Dalamaga M, Kroupis C,etal.Survivin isforms and clinicopathological characteristics in colorectal adenocarcinomas using real-times qPCR [J].World J Gastroenterol, 2011,17:1614- 1621.
[9] Counter CM, Meyerson M, Eaton EN,etal.Telomerase activity is restored in human cells by ectopic expression of hTERT hEST2,the catalytic submit of telomerase[J].Oncogene, 1998, 16:12- 17.
[10] Polanská E, Dob áková Z, Dvo á ková M,etal.HMGB1 gene knockout in mouse embryonic fibroblasts results in reduced telomerase activity and telomere dysfunction [J].2012,Apr 28. [Epub ahead of print].[J].Chromosoma, 2012, 121:419- 431.
[11] 赵敏.hTERT和P53在结肠癌中表达及意义[J].中国现代普通外科进展,2011,14:793- 795.
[12] 王 建,何志巍. 靶向hTERT的小干扰 RNA诱导前列腺癌PC3细胞凋亡的机制[J].中国肿瘤,2012,21:211- 214.
[13] 宋玉姣,韩继波,陈始明,等. 腺病毒介导的shRNA沉默hTERT基因表达对鼻咽癌细胞增殖和凋亡的影响[J].肿瘤防治研究, 2011, 38:1351- 1355.
新闻点击
单独雌激素疗法对50~55岁停经女性认知功能退化无改善作用
据美国国家科学院学报(PNAS)网站2013-06-26报道,去年美国服务工作小组(USPSTF)回顾多项大型研究后指出,使用激素疗法可能增加女性中风、痴呆症、深部静脉血栓、胆囊疾病及尿失禁的发生风险,因此不应用来预防慢性疾病。
先前美国国家老化研究院(National Institute on Aging)所做妇女健康计划记忆研究(WHIMS)也已指出,65岁以上年老女性服用单独雌激素疗法,将增加认知功能缺陷及痴呆症风险提高的危险。而这次该研究团队则希望了解在较年轻的停经女性身上使用是否也会出现同样的结果。
研究参与者为1 326位女性,自50~55岁开始使用激素疗法长达7年的时间,停止使用后再过7.2年,研究以电话访谈1 168位女性,了解并评估她们的语文记忆、注意力、执行能力、语文流畅度及工作记忆的程度,两次评估的时间点是在参与者平均67.2~68.1岁时。
结果发现,服用激素疗法与安慰剂的两组在这些能力上的评分上并没有出现显著的差异,也就是说,年轻停经女性服用较短时间的雌激素疗法,长期来看可能不会提高对她们认知功能的伤害,但研究同样也并未发现有任何对退化改善的好处。
这项发现与早先的一项研究认为“服用激素替代疗法的妇女在她们60几岁时会出现认知能力下降”的结论相驳。
由于激素替代疗法会带来一定的风险,包括增加患乳腺癌的几率等,所以在采用激素替代疗法时应因人而异,应在分析个案的基础上有针对性地进行治疗。如在开始进行激素替代疗法时应尝试用最小剂量,用最短的时间。
该研究刊载于2013-06-24的美国医学会内科医学期刊(JAMA Internal Medicine)。
RNAi-silencedSurvivinandhTERTgene inhibits proliferation and induces apoptosis of human colorectal carcinoma cell line SW480
XIAO Lin, WANG Ping, DONG Jun-hong,WANG Shou-xun*, LIU Shun-mei
(Dept. of Biochemistry, Preclinical Medicine, Weifang Medical College,Weifang 261042, China)
Objective To investigate the Influence ofSurvivinandhTERTgene on cell proliferation and apoptosis in human colorectal carcinoma cell line SW480 and to find experiment evidence for gene therapy of colorectal carcinoma. Methods Plasmids carrying shRNAs targetingsurvivinandhTERTwere designed, constructed and transfected into SW480 cells. SW480 cells were then divided into blank group, blank Plasmid control group, survivin RNAi group, hTERT RNAi group and Survivin-hTERT RNAi group. The telomerase activity was examined by TRAP-PCR-ELISA analysis 48h after hTERT-shRNA transfection.SurvivinandhTERTmRNA and protein expression was analyzed by RT-PCR and Western blot. Cell apoptosis, proliferation were measured by flow cytometry, CCK-8 assay. Results Telomerase activity of SW480 cells in Survivin-hTERT RNAi groups were significantly
decreased compared with the blank group(P<0.01). The expression ofsurvivinandhTERTmRNA, proteins in the Survivin-hTERT RNAi group was reduced by 82.8% and 73.6%(P<0.01),79.2% and 66.7% (P<0.01)respectively. The inhibitory rate of cell proliferation of Survivin-hTERT RNAi group was 43.6%±0.1%(P<0.01). The apoptosis rate was 39.2%±2.3%(P<0.01) in the Survivin-hTERT RNAi group. Conclusions The Survivin-hTERT RNAi group could significantly reduces the protein expression ofsurvivinandhTERTmRNA, inhibit cell proliferation and induces cell apoptosis in human colorectal carcinoma cell line SW480.
RNA interference;Survivin;hTERT; colorectal carcinoma
2014- 04- 21
2014- 07- 18
山东省自然科学基金 (ZR2010HM065,ZR2010DM010);潍坊市科技局项目(20121227,201301062);山东省高等学校科技计划(J14LK57)
1001-6325(2015)01-0038-06
R318.14
A
*通信作者(corresponding author):linnihao@sina.com
