miR-30a抑制人骨肉瘤细胞143B的迁移、侵袭和活力
2015-08-07张汝益李琪英
张汝益,何 方,王 静,邓 芳,李琪英,施 琼*
(重庆医科大学 1.检验医学院 临床检验诊断学教育部重点实验室; 2.麻醉系, 重庆 400016)
研究论文
miR-30a抑制人骨肉瘤细胞143B的迁移、侵袭和活力
张汝益1,何 方1,王 静1,邓 芳1,李琪英2*,施 琼1*
(重庆医科大学 1.检验医学院 临床检验诊断学教育部重点实验室; 2.麻醉系, 重庆 400016)
目的探讨miR-30a对人骨肉瘤细胞143B侵袭、迁移和细胞活力的影响。方法过表达或抑制miR-30a分别处理人骨肉瘤细胞143B。划痕实验观察细胞划痕愈合能力;Transwell实验检测143B细胞迁移和侵袭能力;MTT实验检测细胞活力;定量PCR实验确认过表达miR-30a腺病毒有效性并且检测RUNX2 mRNA表达;Western blot检测细胞中RUNX2总蛋白表达。结果过表达miR-30a抑制了骨肉瘤细胞143B迁移和侵袭(P<0.05),在72 h时,miR-30a明显抑制细胞活力(P<0.01);抑制miR-30a的内源性表达后,143B细胞的迁移和侵袭能力增加(P<0.05),细胞活力也表现出上升水平(P<0.01);同时过表达miR-30a可以抑制RUNX2的蛋白表达,抑制内源性miR-30a后RUNX2蛋白水平表达增加(P<0.05)。荧光素酶活性检测,miR-30a可以靶向于RUNX2(P<0.01)。结论miR-30a抑制骨肉瘤细胞143B的迁移、侵袭和活力,其作用可以能是通过抑制RUNX2的表达来实现。
miR-30a;人骨肉瘤细胞;RUNX2
骨肉瘤(osteosarcoma,OS)是起源于间叶组织的恶性肿瘤[1]。自上世纪80年代采用联合治疗策略以来,骨肉瘤患者的5年生存率大幅提高,不过近十年来虽然有不同的治疗药物问世,患者5年生存率相比前十年却没有明显变化[2- 3]。如何改善病人的生活质量并且提高5年生存率成为科学家致力研究的问题[4]。
MicroRNA是一类长度在19~25 bp的短链非编码RNA,其作用主要是对转录后的RNA进行表观遗传水平的调控[5]。MicroRNA可以调节肿瘤细胞的增殖、分化,并且可以抑制或促进肿瘤的远处转移[6]。正是因为MicroRNA具有这些特性,使它成为潜在治疗肿瘤的基因药物[7]。本研究通过使用过表达miR-30a的腺病毒和特殊的Inhibitior抑制miR-30a,从正反两方面探讨miR-30a对人骨肉瘤细胞143B的迁移、侵袭性和活力,并对其机制作初步探索,以期为临床提供一些依据。
1 材料和方法
1.1 材料
1.1.1 细胞系和病毒:人骨肉瘤细胞系143B和人胚肾细胞系HEK- 293(ATCC)。重组腺病毒Ad-RFP和Ad-miR-30a(本实验室构建保存)。
1.1.2 主要试剂:DMEM高糖培养基和胎牛血清(Hylcone公司);PCR反转录试剂、定量PCR试剂和内切酶和T4连接酶(TakaRa公司);PCR引物和Trziol(Invitrogen公司);Transwell小室和Western blot ECL显影剂(Millipore公司);抗RUNX2抗体和β-actin抗体(Santa Cruz公司)。
1.2 方法
1.2.1 细胞培养:HEK-293和143B细胞均培养于含有10%胎牛血清和100 U/mL 青霉素、100 μg/mL链霉素的DMEM高糖培养基。置于37 ℃、5% CO2的饱和湿度培养箱中培养。
1.2.2 实验分组及处理: 实验组分为空白组(blank)、对照组(Ad-RFP)、过表达miR-30a(Ad-miR-30a)组;miR-30a抑制组(转染mrR-30a inhibitor,In-miR-30a),抑制剂对照组(转染无义inhibitor,In-control)组。Ad-RFP和Ad-miR-30a感染效率在30%左右为宜。
1.2.3 划痕实验:将总数为1.5×105个/孔的143B细胞悬液接种于6孔板,待细胞汇合度达90%时,使用200 μL Tip头横竖各划4条痕。测量多个划痕点宽度,计算各组划痕愈合率[(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%],重复3次取平均值,比较各组细胞迁移能力。
1.2.4 Transwell实验:取对数生长期143B细胞制成悬液,将400 μL的7.5×104个/mL细胞悬液加入到铺有基质胶或没有铺基质胶的上室,24孔板下室加入含20%胎牛血清的培养基600 μL。24 h后染色置显微镜下计数并照相。
1.2.5 MTT实验:取对数增殖期细胞悬液,以3 000个/孔细胞数加入到96孔板,12 h后换低血清培养基,并加处理因素,此时计时为0 h,此后在24、48和72 h时间点再次检测。到时间点后,各孔加入MTT试剂20 μL,继续培养4 h,小心吸走培养基,加入150 μL/孔DMSO,置摇床避光慢摇10 min,酶标仪检测吸光度。
1.2.6 实时荧光定量PCR(qRT-PCR)实验:各组细胞使用Trizol提取RNA,然后反转录成cDNA。反应体系如下:cDNA 2 μL,SYBR® Premix Ex Taq Ⅱ 10 μL,上下游引物各0.4 μL,ddH2O 6.4 μL,Total 20 μL。
1.2.7 Western blot: 细胞裂解,离心取上清,BCA方法检测蛋白浓度,加入缓冲液煮沸5 min置-20 ℃冰箱备用。经10% SDS-PAGE电泳,转膜,封闭。加入一抗(1∶1 000稀释),4 ℃冰箱过夜。第2天预冷TBST洗膜3次,每次10 min,加入二抗(1∶5 000稀释),37 ℃反应1 h,再次用预冷TBST洗膜3次,每次10 min。使用ECL显影成像。
1.2.8 双荧光素酶报告基因检测:软件预测到的各个靶基因位点加上Hind Ⅲ和Spe I酶切位点后用T4连接酶连接到报告载体上。使用Lipofectamine 2000将阳性质粒和对照质粒导入到293细胞中,36 h后检测荧光素活性。
1.3 统计学分析
2 结果
2.1 病毒感染效率和抑制剂转染效率
加入miR-30a和Ad-RFP病毒到143B细胞36 h后,相对Ad-GFP组,miR-30a表达显著增加(图1A,B)。转染经过荧光标签修饰过的miR-30a的抑制剂24 h荧光显微镜下的图像,转染效率几乎达到100%(图1D)。
2.2 划痕实验检测miR-30a对143B细胞迁移的影响
Ad-miR-30a组划痕愈合率为(53.40%±3.05%)显著低于Ad-RFP组的(76.55%±1.16%)和空白组的(80.45%±2.78%) (P<0.05)。而加入抑制剂抑制miR-30a后,143B细胞24 h的划痕愈合率(100%)明显比加入无义inhibitor的细胞或者没有加处理因素的143B细胞的划痕愈合率升高(图2)。
2.3 Transwell检测miR-30a对143B细胞迁移、侵袭的影响
感染腺病毒Ad-miR-30a后,穿过小室膜的细胞明显比Ad-GFP和空白组少(P<0.05),但是In-miR-30a组穿出的细胞比In-control组和空白组明显增多(P<0.05)。铺基质胶,模拟体内肿瘤细胞侵袭过程,加入Ad-miR-30a,143B细胞穿膜数显著下降,而使用i抑制剂抑制miR-30a后,143B细胞穿膜数显著上升 (P<0.05)(图3)。
2.4 MTT检测miR-30a对143B细胞活力的影响
在24,48和72 h分别检测了143B细胞的活力,过表达miR-30a在72 h过可以明显降低143B活力,而抑制miR-30a后143B细胞活力相对空白组升高(P<0.01)(图4)。
2.5 寻找miR-30a的靶向基因
通过预测软件对miR-30a的靶基因进行预测,找到RUNX2这个靶基因。qRT-PCR并且对产物进行琼脂糖凝胶电泳,RUNX2 mRNA表达在几组细胞里无明显变化(图5A)。过表达miR-30a后RUNX2蛋白表达下降,抑制内源性miR-30a后RUNX2蛋白表达增加。
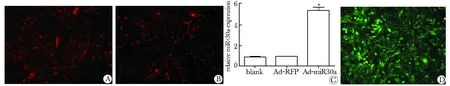
A. 143B cells infected with Ad-miR-30a; B.143B cells infected with Ad-RFP; C.investigated adenovirus miR-30a expression mature miR-30a; D.143B cells were transfected with miR-30a inhibitor;*P<0.05 compared with blank
图1 验证过表达miR-30a的腺病毒和抑制miR-30a的抑制剂的有效性
Fig 1 To identify the effectiveness of Aα-miR-30a and its in hibitor(×40)

图2 划痕实验检测miR-30a对143B细胞迁移的影响
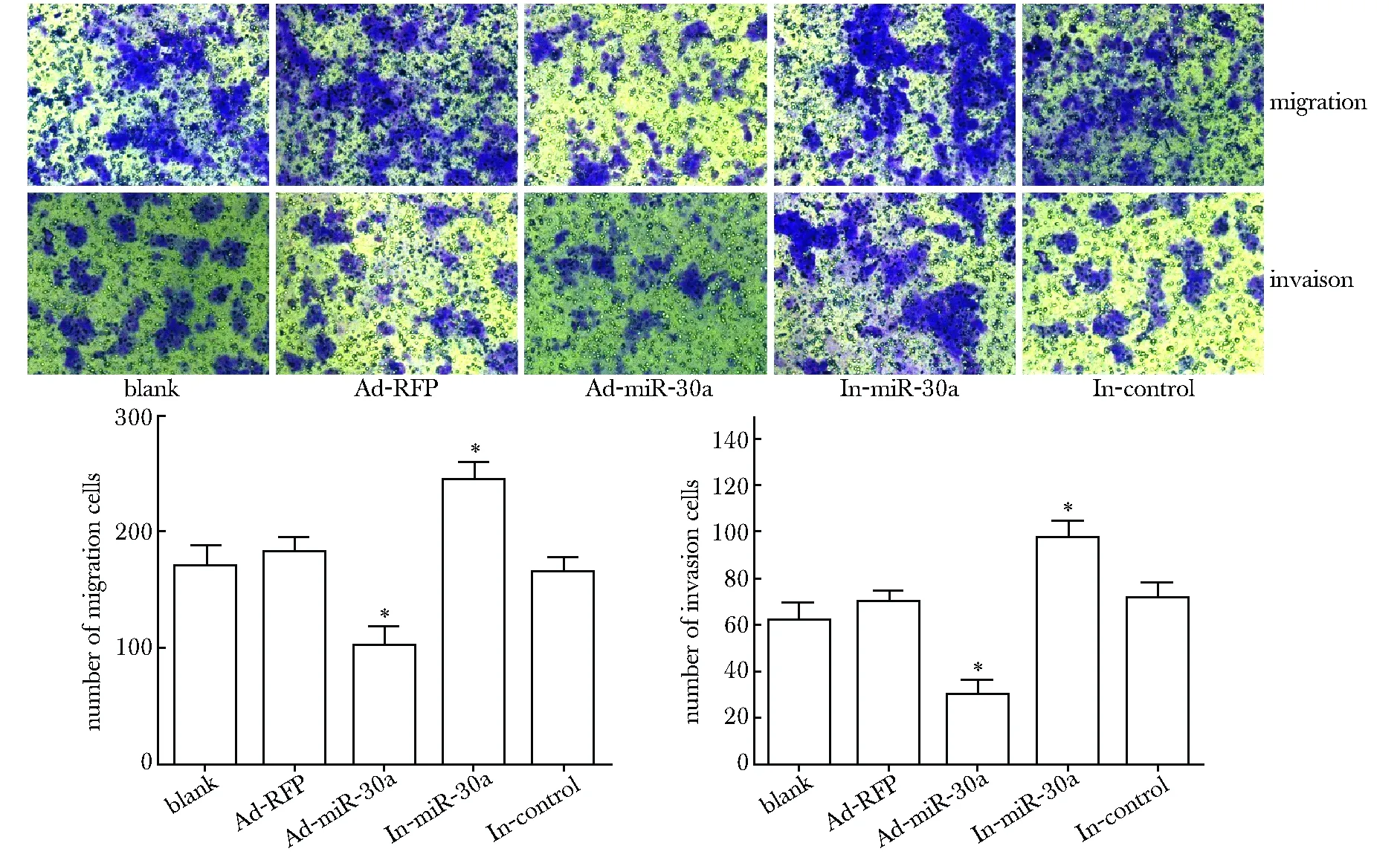
*P<0.05 compared with control group
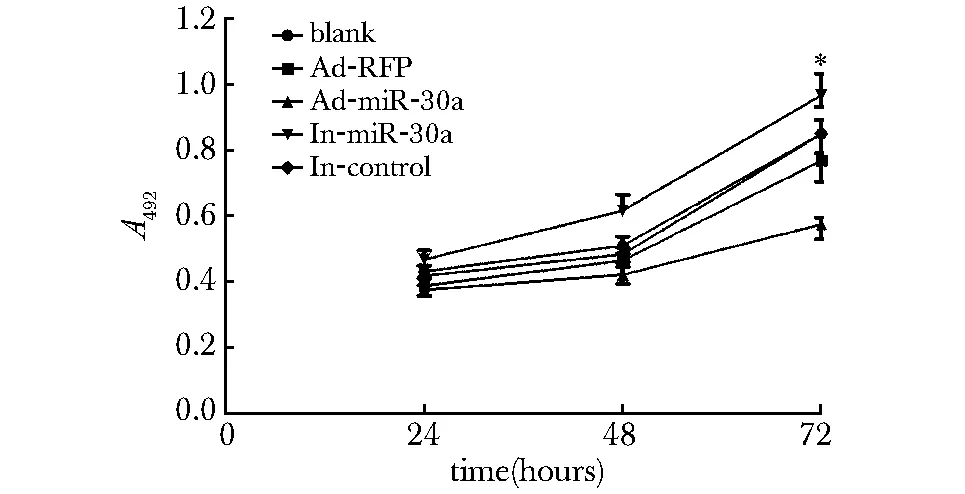
*P< 0.01 versus control cells图4 MTT检测miR-30a对143B细胞活力的影响Fig 4 The effects of miR-30a on 143B cell viability

A.PCR; B.Western blot图5 miR-30a对Runx2 mRNA和蛋白水平的影响Fig 5 Effect of miR-30a on RUNX2 mRNA and protein levels
2.6 miR-30a靶向RUNX2 3′-UTR
miR-30a显著抑制RUNX2 3′-UTR第3个靶位点荧光酶活性(P<0.01)(图6)。
3 讨论
自1993年第一个MicroRNA鉴定完成以来[8],截止作者发稿时已经有24,521个MicroRNAs被列入数据库miRBase。如此多的MicroRNAs被人们发现足见其重要性。
本研究对象miR-30a不仅可以调节成骨分化,在乳腺癌、胃癌和子宫内膜癌等癌症中也有异常的表达水平。骨肉瘤的主要发生机制就是骨组织成骨、破骨功能紊乱,青春期人体开始二次发育,骨骼也随之快速增长,特别是股骨远端和胫骨近端的生长更是决定一个人的身高水平, 而骨肉瘤的好发部位也正是在这两个地方[9]。本研究利用腺病毒过表达miR-30a后骨肉瘤细胞143B的迁移和侵袭明显受到抑制,而用特异性抑制剂抑制miR-30a后143B细胞的迁移和侵袭能力大大提高,提示骨肉瘤细胞143B的迁移和侵袭受到miR-30a的调控。为了阐明miR-30a调控143B细胞的具体机制,利用靶基因预测软件对miR-30a的靶基因进行了预测,找到了RUNX2这个潜在靶基因。相关研究表明,RUXN2可以调控TLN1和PTK2而控制骨肉瘤细胞的运动活力[10]。也有研究发现RUNX2的表达和骨肉瘤的转移有很大的相关性[11]。本实验也发现过表达miR-30a后RUNX2的蛋白水平下降,说明RUNX2是miR-30a的一个靶基因,这与前人的报道一致[12]。综上,通过本研究说明miR-30a抑制骨肉瘤细胞的迁移和侵袭并且可能是通过靶向RUNX2来实现。
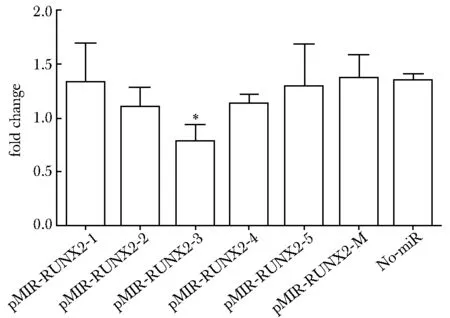
*P< 0.01 compared with no-miR group图6 荧光素酶报告基因实验检测miR-30a是否靶向于RUNX2基因3′-UTRFig 6 Luciferase activity in 293 cells
[1] Tian J, Li X, Si M,etal. CD271+ Osteosarcoma Cells Display Stem-Like Properties[J]. PLoS One, 2014,9:e98549. doi: 10.1371/journal.pone.0098549.
[2] 韩兴文,王栓科,康学文. 肿瘤干细胞与骨肉瘤[J]. 基础医学与临床,2009,29:654- 656.
[3] Broadhead ML, Clark JC, Myers DE,etal. The molecular pathogenesis of osteosarcoma: a review[J]. Sarcoma, 2011:959248. doi: 10.1155/2011/959248.
[4] 曲国蕃,孙志海,李佳慧. 与骨肉瘤预后相关的基因研究进展[J]. 基础医学与临床,2006,26:1157- 1160.
[5] Nugent M. MicroRNA function and dysregulation in bone tumors: the evidence to date[J]. Cancer Manag Res, 2014, 6:15- 25.
[6] Li PF, Chen SC, Xia T,etal. Non-coding RNAs and gastric cancer[J]. World J Gastroenterol, 2014, 20:5411- 5419.
[7] Haemmig S, Baumgartner U, Glück A,etal. miR- 125b controls apoptosis and temozolomide resistance by targeting TNFAIP3 and NKIRAS2 in glioblastomas[J]. Cell Death Dis, 2014,5:e127 9. doi: 10.1038/cddis 10.1038/cdd.
[8] Lee RC, Feinbaum RL, Ambros V,etal. The C. elegans heterochronic gene lin- 4 encodes small RNAs with antisense complementarity to lin- 14[J]. Cell, 1993, 75:843- 854.
[9] Botter SM, Neri D, Fuchs B,etal. Recent advances in osteosarcoma[J]. Curr Opin Pharmacol, 2014, 16:15- 23.
[10] Van der Deen M,Akech J,Lapointe D,etal. Genomic promoter occupancy of runt-related transcription factor RUNX2 in Osteosarcoma cells identifies genes involved in cell adhesion and motility[J]. J Biol Chem, 2012,287:4503- 4517
[11] Won KY, Park HR, Park YK,etal. Prognostic implication of immunohistochemical Runx2 expression in osteosarcoma[J]. Tumori, 2009, 95:311- 316.
[12] Wu T, Zhou H, Hong Y,etal. miR- 30 family members negatively regulate osteoblast differentiation [J]. J Biol Chem,2012, 287:7503- 7511.
miR-30a suppresses migration, invasion and vitality of human osteosarcoma cell line 143B
ZHANG Ru-yi1, HE Fang1, WANG Jing1, DENG Fang1, LI Qi-ying2*, SHI Qiong1*
(1.Key Laboratory of Clinical Laboratory Diagnostics,Ministry of Education,College of Laboratory Medicine; 2.Dept. of Anesthesiology, Chongqing Medical University,Chongqing 400016,China)
Objective To investigate the effect of miR-30a on human osteosarcoma cell 143B in migration,invasion and cell viability. Methods 143B cells were infected or transfected with recombinant adenovirus miR-30a (Ad-miR30a) and miR-30a inhibitor respectively. Wound healing assay was performed to detect the cell healing ability(P<0.05). Cell migration and invasion ability were determined by Transwell assay(P<0.05).The cell viability was analyzed by MTT assay(P<0.01). Real-time quantitative PCR was performed to analyze the expression ofRUNX2 mRNA level and confirmed the adenovirus miR-30a expressed in 143B cells.The expression of RUNX2 was analyzed by Western blot. miR-30a target toRUNX2 was verified by luciferase reported gene assay. Results The ability of migration and invasion was suppressed in osteosarcoma cell 143B by overexpression miR-30a,and the cell viability also decreased.After the endogenous miR-30a being inhibited, the cell motility and invasion enhanced and the cell viability was promoted.The RUNX2 protein decreased after overexpression miR-30a as compared with control group. The luciferase activity ofRUNX2 decreased by adding miR-30a.Conclusions 143B cell migration,
invasion and viability were suppressed by miR-30a,and this process is potentially achieved via suppressing RUNX2 protein expression.
miR-30a; human osteosarcoma cell line; RUNX2
2014- 06- 09
2014- 10- 08
国家自然科学基金(31200971)
1001-6325(2015)01-0012-05
R738.1
A
*通信作者(corresponding author):anniesq8718@aliyun.com; alny68@163.com
