HTA方案诱导治疗急性髓系白血病的疗效分析
2015-08-07韦中玲苏贵平
韦中玲,苏贵平
(皖南医学院第一附属医院弋矶山医院 血液内科,安徽 芜湖 241001)
急性白血病是造血干细胞恶性增殖性疾病,在我国成人急性白血病发病中,以急性髓系白血病(acute myeloid leukemia,AML)多见。柔红霉素(DNR)联合标准剂量阿糖胞苷(Ara-C)目前仍是急性髓系白血病标准诱导化疗方案[1],初始诱导治疗的完全缓解(CR)率在50% ~60%[2],随着DNR的剂量增大,其 CR 率明显提高[3-4],但 DNR 的心脏毒性副作用往往限制了其在AML中的应用。为了提高AML患者的完全缓解率,降低毒副作用,我科以高三尖杉酯碱(HHT)、吡喃阿霉素(THP)、阿糖胞苷(Ara-C)三药联合(HTA)方案治疗成人初诊AML15例,以DA方案诱导化疗的23例患者为对照,比较两种方案的疗效与安全性。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2006年8月~2013年12月在我科行HTA方案诱导化疗的15例初治AML,以2004年3月~2014年2月在我科行DA方案诱导化疗的23例患者为对照。所有患者根据《血液病诊断及疗效标准》确诊[5]。排除标准:①FAB分型中M3患者;②继发性急性白血病患者:包括前驱骨髓增生异常综合征史、放化疗史、其他恶性肿瘤史等;③急性混合型白血病。随访时间至2014年3月。
1.2 治疗方法 治疗组采用HTA方案,具体为:HHT 2~3 mg/d,静脉滴注,5~7 d;THP 10~20 mg/d,静脉滴注,2 ~3 d;Ara-C 100 ~150 mg/(m2·d),分两次静脉滴注,5~7 d。对照组采用DA方案,具体为:DNR 40~60 mg/(m2·d),静脉滴注,第1~3 d;Ara-C 100 ~150 mg/(m2·d),分两次静脉滴注,5~7 d。
1.3 支持治疗 所有患者均在普通病房进行诱导化疗,病房常规消毒机消毒,洗必泰及3%碳酸氢钠液交替漱口、1∶5000高锰酸钾液坐浴。对于初始患者外周血白细胞超过100×109/L者给予羟基脲等预处理治疗36 h后,再予诱导化疗。在血红蛋白<60 g/L或伴有心慌、胸闷、气急等明显贫血症状时给予输注红细胞悬液;血小板<20×109/L或临床上有出血症状时,给予输注机采血小板;出现发热,体温在38.3℃以上或2次体温38℃持续1 h,给予经验性抗感染治疗,同时行痰培养、血培养、咽拭子培养等病原学检查,并根据病原学结果调整抗感染药物治疗。化疗过程中均给予止吐、保肝、护胃、水化、碱化、保护脏器功能等药物治疗。
1.4 观察指标 观察患者化疗过程中的临床症状、体征变化,监测实验室指标(1周查血常规、电解质2~3次,1周复查1次肝肾功能、心肌酶谱、肌钙蛋白),监测心电图变化。化疗结束后3周内复查骨髓象及流式细胞学检查。
1.5 疗效及不良反应判定 诱导治疗的疗效判断:按照《血液病诊断及疗效标准》[5]分为完全缓解(CR包括 CR及 CRi)、部分缓解(PR)、未缓解(NR);总有效率(ORR)为CR+PR。不良反应按WHO分级标准进行安全性评价,分为0~Ⅳ级。观察并记录患者化疗后白细胞最低值,以及粒细胞缺乏持续时间;血小板最低值以及<20×109/L持续时间;输注红细胞和血小板数量。同时观察患者恶心、呕吐、腹泻、便秘、出血、感染、肝肾功能损害、心脏毒性、脱发等不良反应。
1.6 统计学方法 应用SPSS 16.0分析软件进行统计学处理,计量资料采用平均数±标准差,组间比较采用t检验;计数资料采用Fisher精确概率,以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料 HTA组中男9例,女6例;年龄18~59岁,平均年龄(43.1±14.7)岁;FAB分型:M1 3例,M2 12例;治疗前白细胞(1.3~127)×109/L,血红蛋白36~126 g/L,血小板(5~135)×109/L,原始细胞(27~93)%,细胞遗传学分型预后良好2例、预后中等11例、预后不良2例;DA组中男7例,女16例;年龄15~59岁,平均年龄(42.3±10.9)岁;FAB分型情况:M1 4例,M2 16例,M4 1例,M5 2例。治疗前白细胞(0.8~203.6)×109/L,血红蛋白37~109 g/L,血小板(8~252)×109/L,原始细胞(20~97)%,细胞遗传学分型预后良好0例、预后中等20例、预后不良3例。两组病例的年龄、性别、FAB分型及初诊时白细胞计数、原始细胞比例、血红蛋白计数、血小板计数等资料无统计学差异(P>0.05),具有临床可比性(表1)。

表1 两组临床资料比较
2.2 疗效分析 HTA组15例患者中,1个疗程达CR者11例,PR者2例,NR者2例,OR者为13例,其中预后良好2人、预后中等11人、预后不良2人,1疗程CR例数分别为(2/2)、(8/11)、(1/2)。DA方案组23例患者中,1个疗程达CR者14例,PR者3例,NR者6例,OR者为17例,无预后良好患者,预后中等20人和预后不良3人的1疗程 CR例数分别为13/20、1/3。两组化疗方案一疗程获得完全缓解的情况相比P>0.05(Fisher确切概率),见表2。

表2 两组的缓解情况比较
2.3 不良反应
2.3.1 血液学不良反应 两组总计38例患者中血液学不良反应主要为化疗后骨髓毒性,表现为粒细胞、血小板严重减少,按WHO化疗药物毒副作用分级,多为Ⅲ~Ⅳ级;两组比较,粒细胞缺乏持续时间HTA组较DA组短,血小板最低值HTA组较DA组高,两者有统计学差异(P<0.05),而血小板低于20×109/L的持续时间、白细胞最低值、输注红细胞和血小板量均无统计学差异(表3)。

表3 两组血液系统不良反应比较
2.3.2 非血液学不良反应 主要表现为胃肠道症状如恶心、呕吐、腹胀、便秘;心脏毒性表现为心慌、胸闷、心律失常;肝功能损害表现为转氨酶增高,为Ⅰ级,经止吐、护胃、护肝、营养心肌及对症治疗后改善,两组的发生率及严重程度差异无统计学意义(Fisher确切概率,P>0.05)。两组均未出现肾功能损害;两组病例中感染的发生率均较高,以呼吸道感染为主,多数伴有肺部侵袭性真菌感染;HTA组有1例肛周感染。出血以皮肤黏膜瘀斑、鼻腔及牙龈出血为主,未发生重要脏器出血,经输注机采血小板或血小板上升后症状改善。和DA组相比,HTA组的脱发例数较少,但两组仍无统计学差异(表4)。
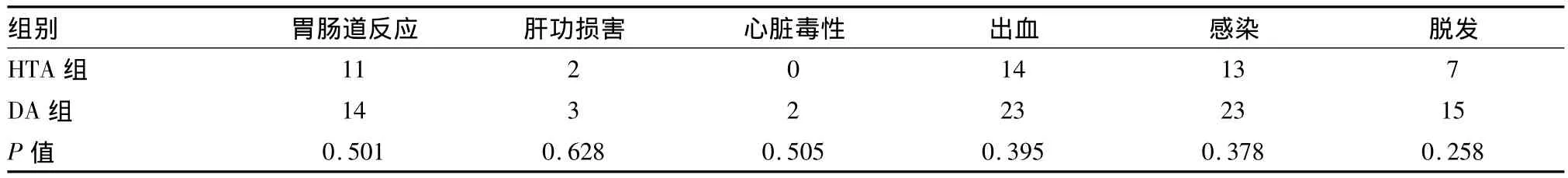
表4 两组的非血液学不良反应比较
2.4 两组患者生存情况分析 HTA组随访15例,随访时间为4~80月,8例复发,7例生存至今,中位生存时间为18个月(95%CI为14.28~21.72);DA组随访21例,2例失访,随访时间为1~120月,8例复发,13例生存至今,中位生存时间16个月(95%CI为13.18~18.82)。DA 组患者的1年的 OS率为60.87%,HTA组患者的1年的OS率为80.0%,P=0.294。以下为两组患者的生存曲线图(图1)。

图1 两组生存曲线比较
3 讨论
AML是一组生物学和预后不同的异质性血液系统恶性肿瘤,对于AML患者而言,尽快获得血液学缓解对患者长期生存至关重要。DA方案作为治疗急性髓细胞白血病的标准诱导方案,其CR率为50%~60%。但DNR的心脏毒性往往限制了其在临床上的应用。为进一步提高急性髓系白血病的疗效,学者们纷纷尝试使用心脏毒性较低的其他蒽环类药物代替DNR,在不减低化疗疗效的情况下降低患者的心脏毒性副作用,增加患者的可耐受性。吡喃阿霉素属半合成的蒽环类抗肿瘤药物,主要通过进入细胞内并迅速分布于细胞核,抑制DNA聚合酶α和β,阻碍核酸的合成,由于其可嵌入DNA的双螺旋链,使肿瘤细胞终止在G2期,导致肿瘤细胞死亡,不仅具有较强的抗肿瘤活性,且与其他蒽环类药物无交叉耐药性[6]。姜尔烈等[7]研究结果提示TA方案疗效与DA方案相似,但心脏毒性明显减低。国外研究也证实,THP出现心脏毒性不可逆损害的累积限制剂量为900~1100 mg/m2,而DNR的累积剂量超过550 mg/m2将会给病人带来严重心脏不良反应[8-9]。
提高化疗强度,增加患者CR率有利于延长患者总生存率[10-11]。因此学者们试着联合使用多种无交叉耐药的抗肿瘤药物来增加化疗敏感性提高疗效。HHT是从我国三尖杉属植物中分离出的抗肿瘤生物碱之一,属细胞周期特异性药物,对G1和G2期细胞杀伤作用最强,而对S期细胞作用较小。与蒽环类抗肿瘤药物机制不同,HHT主要抑制真核细胞的蛋白质合成,对细胞内DNA的合成也有抑制作用,可促进细胞分化及凋亡。有临床资料显示[12],HHT和Ara-C组成的HA方案与DA方案诱导缓解率相似,而且部分HA与DA诱导方案无效的患者,在互换方案后可以得到缓解,说明HHT与DNR不存在交叉耐药。国内秘营昌等[13]使用HAD方案获得较好疗效,在治疗初诊的AML的一疗程CR率为78.6%;米瑞华等[14]使用相同方案的 CR 率在65.7%。而叶佩佩等[15]对236例初诊AML患者采用了HAA方案诱导化疗,一疗程CR率在65.7%,一至两疗程化疗总的CR率在78%。金洁等[16]在一项HAA、HAD、DA三种方案的随机对照研究中发现HAA组、HAD组和DA组的CR率分别为73%、67%和61%,但HAA组和HAD组在治疗过程中出现治疗相关病死率却较DA组增高。而我科在使用HTA诱导治疗初诊AML结果显示,一疗程CR的情况为11/15,较对照组DA方案(14/23)稍好,与大剂量柔红霉素治疗组[3-4]相似,且本组未出现治疗相关死亡。
两种方案诱导化疗后严重不良反应均为骨髓毒性,化疗后出血、感染的发生率均很高。本组分析发现,HTA组和DA组患者在化疗后的白细胞最低值无统计学差异,但HTA组粒细胞缺乏持续时间较DA组明显缩短,且两组感染发生情况相比,HTA组仍低于DA组(13/15 vs 23/23)。虽然两组感染发生率并无统计学差异,但粒细胞缺乏时间越长,其感染发生率越有增加趋势。化疗后HTA组的血小板最低值较DA组高,但两组的血小板低于20×109/L持续时间没有差异,两者红细胞输注量和血小板输注量均无统计学差异,说明上述三药联合的诱导方案其骨髓毒性并未增加。由于两组血小板最低值均在20×109/L以下,因此出血发生率较高,大多为皮肤、黏膜、眼底出血,未发生重要脏器出血,在输注血小板或渡过骨髓抑制期血小板上升后出血症状改善。蒽环类抗肿瘤药物的突出不良反应为心脏毒性,而HHT的突出非血液学不良反应也为心脏毒性,在剂量减低至2.5 mg/(m2·d1)以下时,心脏毒性明显减少。但两者联用并未增加患者心脏毒性[17],本研究也显示两药联用未出现心脏毒性叠加现象。本研究的其他非血液学不良反应如肝功能损害、胃肠道反应较轻微,经对症处理后均很快好转。对于肿瘤患者而言,化疗药物导致的脱发现象往往使很多患者内心纠结,特别是对于那些爱美的年轻女性患者。DNR除了心脏毒性作用限制了临床使用,脱发也是临床常见、不容忽视的问题。而THP在这方面则显示了优势,有研究发现THP导致脱发比例不足30%[18],本组分析中HTA组患者脱发较DA组患者发生少,可能因样本量较小,统计学并无显著差异,有待更大样本进一步观察和分析。
本组分析显示,HTA组缓解情况及1年的OS稍优于DA组患者,但两者的生存时间无明显差异,究其原因可能与HTA组患者病例数少、随访时间短有关。本组研究结果还表明,HTA方案具有良好的安全性,无诱导相关性死亡,且一疗程获得完全缓解比例稍高,HTA方案可以推荐作为AML初始诱导化疗方案之一。但由于本组研究HTA组患者大多为低、中危组,且样本数量较小,随访时间短,有待更大样本量进一步分析其疗效及安全性。
[1]中华医学会血液学分会.成人急性髓系白血病(非早幼粒细胞白血病)中国诊疗指南(2011版)[J].中华血液学杂志,2011,32(11):804-807.
[2]Berman E,Heller G,Santorsa J,et al.(1991)Results of a randomized trial comparing idarubicin and cytosine arabinoside with daunorubicin and cytosine arabinoside in adult patients with newly diagnosed acute myelogenous leukemia[J].Blood,1991,77(8):1666-1674.
[3]Lee JH,Joo YD,Kim H,et al.A randomized trial comparing standard versus high-dose daunorubicin induction in patients with acute myeloid leukemia[J].Blood,2011,118(14):3832 -3841.
[4]Fernandez HF,Sun z,Yao X,et al.Anthracycline dose intensification in acute myeloid leukemia[J].N EnglJ Med,2009(361):1249-1259.
[5]张之南,沈悌.血液病诊断及疗效标准[M].2版.北京:科学出版社,1998:171-183.
[6]Isuruo T,Iidah,Tsukagoshi S,et al.4'-O-tetrahydropyranyladriameycin as a potential new antitumor agent[J].Cancer Res,1982,42(4):1462-1467.
[7]姜尔烈,黄勇,爱明,等.以吡喃阿霉素为基础的联合化疗方案治疗急性髓系白血病的疗效及其预后因素分析[J].肿瘤,2008,28(6):532 -534.
[8]Fazlina N,Maha A,Jamal R,et al.Expression of multidrug resistance(MDR)proteins and in vitro drug resistance in acute leukemias[J].Hematology,2007,12(1):33 -37.
[9]Plesa C,Chelghoum Y,Plesa A,et al.Prognostic value of immunophenotyping in elderly patients with acute myeloid leukemia:a single-institution experience[J].Cancer,2008,112(3):572 -580.
[10]Harvey P,Roger B D,Jeffrey K,et al.Comparison of three remisson in duction regimens and two postinduction strategies for the treatment of acute nonlymphocytic leukemia:a cancer and leukemia group B study[J].Blood,1987,69(5):1441 -1449.
[11]卞寿庚,郝玉书,王志澄,等.急性非淋巴细胞白血病强烈化疗91例疗效观察[J].中华内科杂志,1990,29(1):22-25.
[12]林茂芳,曾波航,吴佳丽,等.61例成人急性非淋巴细胞白血病诱导化疗HA和DA的比较[J].临床血液学杂志,1992,5(1):1-4.
[13]秘营昌,薛艳萍,俞文娟,等.HA为基础的三药方案治疗急性髓系白血病疗效分析及与染色体核型的关系[J].中华血液学杂志,2005,12(26):705 -709.
[14]米瑞华,魏旭东,张艳莉,等.DEA与DHA两种化疗方案诱导治疗急性髓系白血病疗效比较[J].中华血液学杂志,2010,31(11):767-768.
[15]叶佩佩,牧启田,陈菲菲,等.HAA方案诱导治疗成人初发急性髓系白血病236例疗效观察[J].中华血液学杂志,2013,34(10):825-829.
[16]Jin JI,Wang JX,Chen FF,et al.Homoharringtonine-based induction regimens for patients with de-novo acute myeloid leukaemia:a multicentre,open-label,randomised,controlled phase 3 trial[J].Lancet Oncol,2013,14(7):599 - 608.
[17]O'Brien S,Kantarjian H,Keadng M,et al.Homoharringtoalne therapy induces responses in patients chronic myelogenous Leukemia in late chronic phase[J].Blood,1995,86(9):3322 -3332.
[18]Zhong LY,Li QH,Huang ZL,et al.Regimen containing perarubicin for the treatment of newly diagnosed young patients with acute myeloid leukemia[J].Ai Zheng,2009,28(6):619 -625.
