阿片类药物复合右美托咪定用于术后镇痛的临床剂量探讨
2015-07-31张立冬
张立冬
阿片类药物复合右美托咪定用于术后镇痛的临床剂量探讨
张立冬
目的 探讨阿片类药物复合右美托咪定用于术后镇痛的最佳临床剂量。方法 选ASAⅠ~Ⅱ级择期行下腹部手术的全身麻醉患者80例,椎管内麻醉患者100例。全麻患者术后随机分为4组:各组芬太尼从20 μg/kg以5 μg/kg的幅度逐渐递减至5 μg/kg,每组右美托咪定4 μg/ kg+昂丹司琼0.1 mg/kg保持不变。椎管内麻醉者术后随机分为5组:各组吗啡从0.2 mg/kg以半量的幅度逐渐递减至0.05 mg/kg后再半量递减左布比卡因用量,从2 mg/kg递减至0.5 mg/kg,每组右美托咪定2 μg/kg保持不变。所有组别均将所用药物用0.9%氯化钠稀释至100 mL注入一次性使用输注泵中,分别行静脉和硬膜外自控镇痛。每组分别于术毕2 h、6 h、24 h、48 h监测生命体征并记录VAS评分、Ramsay镇静评级及不良反应的发生情况,并于术后24 h听取患者对本次麻醉满意度的评价。结果 静脉镇痛及椎管内镇痛各组术后各时点VAS差别无统计学意义,不良反应发生率随阿片类药及局麻药用量减少而降低(术后2 h:52.94% vs 38.10% vs 13.04% vs 5.26%,术后6 h:35.29% vs 23.81% vs 8.70% vs 0.00%,术后24 h:23.53% vs 19.05% vs 4.35% vs 0.00%,术后48 h:17.65% vs 9.52% vs 4.35% vs 0.00%),差异有统计学意义(P<0.05)。静脉镇痛各组镇静程度随阿片类药物用量减少而降低,椎管内镇痛各组差异无统计学意义。最小剂量芬太尼及吗啡加左布比卡因组患者满意度88.24%,高于其它各组(P<0.05)。结论 芬太尼复合右美托咪定静脉术后镇痛的最佳临床剂量为芬太尼5 μg/kg+右美托咪定4 μg/kg;吗啡及左布比卡因复合右美托咪定硬膜外术后镇痛的最佳临床剂量为吗啡0.05 mg/kg+右美托咪定2 μg/kg+左布比卡因0.5 mg/kg。
右美托咪定;阿片类药物;镇痛;剂量
右美托咪定是上世纪末研发的一种新型高选择性α2肾上腺素能受体激动剂[1],具有镇静、镇痛、抗焦虑、遗忘的特点,能够维持血流动力学稳定,没有呼吸抑制,且能维持患者于自然睡眠状态和正常免疫反应等优点,目前在临床麻醉及重症医学领域应用较为广泛。因其具有良好的镇痛作用,故能减少阿片类药物及局麻药的用量,但迄今无关于其与阿片类药物及局麻药配伍的剂量研究,本研究旨在探讨其与阿片类药物复合镇痛时的最佳临床剂量,现报道如下。
1 资料与方法
1.1 一般资料 选择2012年9月~2013年9月辽宁省辽阳市辽化总医院择期行下腹部手术的全身麻醉患者80例,椎管内麻醉患者100例,ASAI~II级。入选患者均无药物依赖、吸烟酗酒史、发热、甲状腺疾病及代谢性疾病。其中妇科手术78例,普外科手术67例,泌尿科手术35例;年龄40~60岁;男75例,女105例;体质量50~65 kg;身高152~167 cm;手术时间1.6~2.6 h;麻醉时间2.2~3.1 h;术中补液量900~1600 mL。
1.2 研究方法 所有患者入室后均行心电监护、无创血压及脉搏氧饱和度监测,检查麻醉机运行状态良好,准备好急救药品及设备后施行麻醉。此外,全麻患者麻醉后行呼末CO2分压和鼻咽温度监测。
全身麻醉组患者均选用静脉快诱导气管插管,七氟醚吸入全身麻醉。麻醉诱导:咪唑安定0.1 mg/kg、芬太尼4 μg/kg、顺阿曲库胺0.15 mg/kg、依托咪酯0.2 mg/kg,气管插管后调节潮气量8~10 mL/kg,控制呼末二氧化碳分压(PETCO2)于30~40 mmHg(1 mmHg=0.133 kPa),麻醉维持:七氟醚1.0~1.5 MAC持续吸入(O2流量:2 L/min),分别泵注顺阿曲库胺0.1 mg/(kg·h),芬太尼2~4 μg/(kg·h),保证术中满意的镇痛及肌肉松弛良好。冲洗腹腔时停肌松药,并将七氟醚减至1%,皮肤缝合一半时停用七氟醚,将氧流量开至8 L/min洗肺,不用任何拮抗药药物,在安静状态下等待患者自然苏醒,拔除气管导管。吸氧状态下观察患者15 min,若生命体征平稳,则静脉给予负荷剂量芬太尼1 μg/kg,后将患者按入组顺序经随机数字表转化的随机分组进入4个组别,接受相应的静脉自控镇痛治疗。V 1组17例(芬太尼20 μg/kg+右美托咪定4 μg/kg+昂丹司琼0.1 mg/kg);V 2组21例(芬太尼15 μg/kg+右美托咪定4 μg/kg+昂丹司琼0.1 mg/kg);V 3组23例(芬太尼10 μg/kg+右美托咪定4 μg/kg+昂丹司琼0.1 mg/kg);V 4组19例(芬太尼5 μg/kg+右美托咪定4 μg/kg+昂丹司琼0.1 mg/kg)。
椎管内麻醉组选L2~3或L3~4间隙,行腰硬联合阻滞(CESA)。穿刺成功后,蛛网膜下腔注入重比重布比卡因10~12 mg,注药时间45 s,后置硬膜外管,给药15 min后,平面未达T8水平者,从硬膜外管分次追加(2%利多卡因+0.5%左布比卡因卡因1∶1混合)(15.67±5.50)mL。术毕按入组顺序经随机数字表转化的随机分组进入五个组别,接受相应的硬膜外自控镇痛治疗。E 1组24例(吗啡0.2 mg/kg+右美托咪定2 μg/ kg+左布比卡因2 mg/kg);E 2组19例(吗啡0.1 mg/kg+右美托咪定2 μg/kg+左布比卡因2 mg/kg);E 3组18例(吗啡0.05 mg/kg+右美托咪定2 μg/kg+左布比卡因2 mg/kg);E 4组22例(吗啡0.05 mg/kg+右美托咪定2 μg/kg+左布比卡因1 mg/kg);E 5组17例(吗啡0.05 mg/kg+右美托咪定2 μg/kg+左布比卡因0.5 mg/kg)。
自控镇痛泵均选用珠海生物科技有限公司生产的亚特兰一次性输注泵。输注参数为:背景输注剂量:2 mL/h,单次给药剂量0.5 mL,锁定时间15 min。
1.3 评价方法 (1)每组分别于术毕2 h、6 h、24 h、48 h监测生命体征并记录VAS评分;(2)各组Ramsay评级(见表1)≥4级发生率;(3)不良反应(恶心、呕吐、呼吸抑制等)的发生情况;(4)术后24 h随访患者时听取患者对本次麻醉满意度的评价。满意度评价:分为非常满意、满意、基本满意、不满意四个级别,把各组作为患者满意度的分子,各组总例数作为分母得出患者满意度。总满意度=(非常满意例数+满意例数)/总例数× 100%。

表1 Ramsay评分表
1.4 统计学方法 数据采用SPSS 13.0行统计分析。计量资料采用“x±s”表示,计量资料行单因素方差分析,两两比较采用LSD-t法,计数资料均以百分率(%)表示,计数资以行×列表分析。P<0.05为差异有统计学意义。
2 结果
2.1 静脉镇痛各组术后各时点VAS评分、Ramsay≥4级发生率及不良反应发生率的比较 静脉镇痛各组患者年龄、身高、体质量、麻醉时间、手术时间、术中补液量差异均无统计学意义。各组术后各时点VAS差异无统计学意义。镇静程度及不良反应发生率随芬太尼用量减少而降低,差异有统计学意义(P<0.05)。见表2。

表2 静脉镇痛各组术后各时点VAS评分、Ramsay≥4级发生率及不良反应发生率的比较
2.2 静脉镇痛各组患者术后24 h内不良反应发生率及患者满意度的比较 术后24 h随访患者再次了解不良发应发生情况,V 1、V 2组的各系统及总体不良反应发生率明显高于其他两组,且V 1、V 2组亦存在着差异。其中V 1组有1例患者返回病房后出现了呼吸抑制,经置入口咽通气道,提高吸入氧浓度等处理后渐好转。同时时听取患者对本次麻醉的整体评价,患者满意度以V 4组最高。见表3。
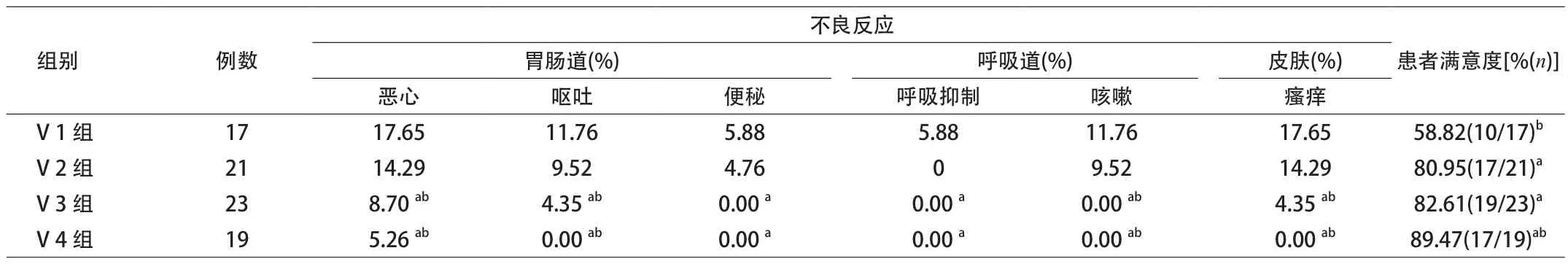
表3 静脉镇痛各组患者术后24 h内不良反应发生率及患者满意度的比较
2.3 硬膜外镇痛各组术后各时点VAS评分及不良反应发生率的比较 硬膜外镇痛各组患者年龄、身高、体质量、麻醉时间、手术差异均无统计学意义。各组术后各时点VAS评分及镇静程度差异无统计学意义,不良反应发生率随吗啡及局麻药用量减少而降低,差异有统计学意义(P<0.05)。见表4。
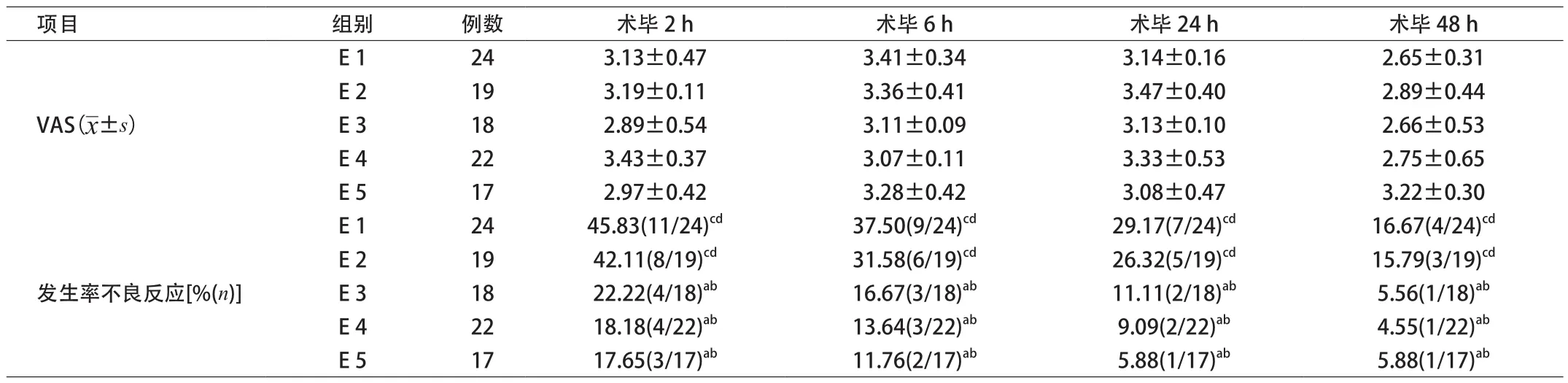
表4 硬膜外镇痛各组术后各时点VAS评分及不良反应发生率的比较(x±s)
2.4 硬膜外镇痛各组患者术后24 h内不良反应发生率及患者满意度的比较 术后24 h随访患者再次了解不良发应发生情况,E 1、E 2组的各系统及总体不良反应发生率显著高于其他3组,患者满意度以E 5组最高。见表5。

表5 硬膜外镇痛镇痛各组患者术后24 h内不良反应发生率及患者满意度的比较[%(n)]
3 讨论
盐酸右美托咪定是一种高选择性α2肾上腺素受体激动药, 1999年被美国食品药品管理局批准用于成人重症监护病房机械通气患者的短期镇静[1]。其通过内源性促睡眠途径发挥镇静效果,故可诱导类似生理睡眠的镇静效应[2]。此外,右美托咪定可通过对钙通道的抑制和钙离子激活钾通道的活化来调节离子传导,进而来发挥其多种药理作用[3]。
围手术期使用右美托咪定可使应激造成的神经内分泌反应降低,且具有利尿、稳定血流动力学、降低寒战及围手术期心肌缺血发生率等作用,故近年来在临床上广泛应用[4]。因其良好的镇静、镇痛以及抗交感作用,近年来在临床麻醉中应用亦呈渐增趋势,但用于术后镇痛尚未大规模使用,仅有一些相关的研究。
右美托咪定作用于蓝斑核的α2受体产生镇静催眠及镇痛作用[5]。在羊的动物实验中通过椎管内注入右美托咪定确实有镇痛作用,且证实其镇痛作用的基本位点在脊髓[6]。有研究证实:右美托咪定全身应用可减少麻醉药的需要量,术后重症监护病房中使用右美托咪定,与安慰药比较能减少一半的麻醉药的需要量[7],这也充分说明了它强烈的镇静及镇痛作用。关于右美托咪定直接用于镇痛的研究已不鲜见,如右美托咪定1 μg/kg术中单次给药可以延长术后第一次需要阿片类药物的时间和减少术后阿片类药物的需求量[8]。右美托咪定术前单次给药可以减少术后吗啡镇痛患者14 h内吗啡的消耗量[9]。本研究首次利用大样本递减阿片类药及局麻药物来探索右美托咪定的镇痛效应,其结果一样令人惊奇,仅用原来四分之一的阿片类药就达到了满意的镇痛效果,这或许与这两种药物的协同作用有关,具体机制有待于进一步探讨。
Massad等研究显示右美托咪定可减少腹腔镜检查患者术后恶心呕吐的发生。其原因可能是右美托咪定具有镇静、镇痛作用,可以减少麻醉镇痛药如阿片类药物的使用量,从而减少了恶心呕吐的发生率。同时抑制交感张力,降低儿茶酚胺的释放,对恶心呕吐有间接抑制作用,也可能直接作用于中枢和其他部位的α2受体,发挥抑制恶心呕吐的作用[10]。尽管右美托咪定可通过多条途径抑制恶心呕吐,本研究还是显示出了与阿片类药物用量正相关的恶心、呕吐发生率,也说明我们既往术后镇痛中常见的消化系统不良反应主要与阿片类药物用量偏大有关。本研究还显示出其他阿片类相关的不良反应,诸如便秘、呼吸抑制、咳嗽及皮肤瘙痒随阿片类用量降低而减少的现象,究竟是否存在因阿片类用量减低外的其他与右美托咪定相关的机制,有待于进一步探讨。
已有研究证实,右美托咪定在术中与局麻药联合应用能增强硬膜外阻滞效应[11-13]。我们的研究也显示出了合用的效果。E 5组合并使用吗啡及左布比卡因仅为常规用量的四分之一却起到了满意的镇痛效果,同时不良反应的发生率明显降低,显示出了右美托咪定在硬膜外镇痛中应用的潜力。
尿潴留、运动神经阻滞也是椎管内麻醉镇痛常见的并发症。有研究表明:吗啡与κ受体结合抑制抗利尿激素释放,与δ受体结合增加输尿管 张力、收缩膀胱括约肌、增高尿道内压是尿潴留的原因。而硬膜外应用右美托咪定可减少尿潴留的发生,其具体机制尚不清楚。本研究中因所有患者均留置尿管,也未对运动神经阻滞的具体时间作评价,只观察到了术后2 h大部分患者下肢肌力已接近Ⅲ级,术后6 h几乎全部患者肌力已正常,是否在低浓度局麻药组中运动神经阻滞持续时间会缩短,右美托咪定在其中有无作用,在以后的工作中可在这方面做些研究。
总之,我们通过一个较大样本的研究显示出右美托咪定用于术后镇痛的优势,并且初步探讨出与阿片类药物及局麻药合用时的最佳剂量,希望对术后患者的镇痛能有一点帮助。
[1] Le Guen M,Liu N,Tounou F,et al.Dexmedetomidine reduces propofol and remifentanil requirements during bispectral index-guided closedloop anesthesia:a double-blind,placebo-controlled trial[J].Anesthesia & Analgesia,2014,118(5):946-955.
[2] Wellington D,Mikaelian I,Singer L.Comparison of Ketamine–Xylazine and Ketamine-Dexmedetomidine Anesthesia and Intraperitoneal Tolerance in Rats[J].JAALAS,2013,52(4):481-487.
[3] Bayram A,Ülgey A,Baykan A,et al.The effects of dexmedetomidine on early stage renal functions in pediatric patients undergoing cardiac angiography using non-ionic contrast media:a double-blind,randomized clinical trial[J].Pediatric Anesthesia,2014,24(4):426-432.
[4] Weant KA,Martin JE,Humphries RL,et al.Pharmacologic options for reducing the shivering response to therapeutic hypothermia[J].Pharmacother apy,2010,30(8):830-841.
[5] Bajwa SJS,Gupta S,Kaur J,et al.Reduction in the incidence of shivering with perioperative dexmedetomidine:A randomized prospective study[J]. Journal of anaesthesiology,clinical pharmacology,2012,28(1):86-92.
[6] Walsh VP,Gieseg M,Singh PM,et al.A comparison of two different ketamine and diazepam combinations with an alphaxalone and medetomidine combination for induction of anaesthesia in sheep[J].New Zealand veterinary journal,2012,60(2):136-141.
[7] Le Guen M,Liu N,Tounou F,et al.Dexmedetomidine reduces propofol and remifentanil requirements during bispectral index-guided closedloop anesthesia:a double-blind,placebo-controlled trial[J].Anesthesia & Analgesia,2014,118(5):946-955.
[8] Olutoye OA,Glover CD,Diefenderfer JW,et al.The effect of intraoperative dexmedetomidine on postoperative analgesia and sedation in pediatric patients undergoing tonsillectomy and adenoidectomy[J].Anesth Analg,2010,111(2):490-495.
[9] Yang L,Xu JM,Jiang XH,et al.Effect of dexmedetomidine on plasma brain-derived neurotrophic factor:A double-blind,randomized and placebo-controlled study[J].Upsala journal of medical sciences,2013,118(4):235-239.
[10] Kim KH.Safe sedation and hypnosis using dexmedetomidine for minimally invasive spine surgery in a prone position[J].The Korean journal of pain,2014,27(4):313-320.
[11] Bajwa SJS,Bajwa SK,Kaur J,et al.Dexmedetomidine and clonidine in epidural anaesthesia:A comparative evaluation[J].Indian journal of anaesthesia,2011,55(2):116-122.
[12] Kitamura H,Kitayama M,Tanimo T,et al.Successful anesthetic management in a patient with chronic obstructive pulmonary disease (COPD) using dexmedetomidine and combined spinal-epidural anesthesia for low anterior resection of the rectum[J].Masui.The Japanese journal of anesthesiology, 2012,61(8):840-843.
[13] Arunkumar S,Kumar VRH,Krishnaveni N,et al.Comparison of dexmedetomidine and clonidine as an adjuvant to ropivacaine for epidural anesthesia in lower abdominal and lower limb surgeries[J].Saudi journal of anaesthesia,2015,9(4):404.
10.3969/j.issn.1009-4393.2015.36.002
辽宁 111003 辽宁省辽阳市辽化总医院麻醉科 (张立冬)
