PGD2调控TGF-β1/Smads在支气管哮喘中的实验研究
2015-07-31刘振峰刘建英
刘振峰 刘建英
PGD2调控TGF-β1/Smads在支气管哮喘中的实验研究
刘振峰 刘建英
目的 观察PGD2对小鼠肺成纤维细胞生物学特性的影响,利用其受体特异性抑制剂Laropiprant调控TGF-β1/Smads在支气管哮喘中的研究。方法 根据Laropiprant的浓度将细胞分组,每组分别加入TGF-β2(2.5ng/mL)培养24h后用Laropiprant刺激24h,分别用PCR法、WB法检测细胞TGF-β1、smad3和smad4的表达。采用不同浓度的Laropiprant作用于细胞不同时间,通过MTT法检测Laropiprant对细胞生长的抑制作用。结果 随着Laropiprant的浓度增加,细胞中TGF-β1、smad3及smad4的mRNA和蛋白的表达呈下降趋势,与正常对照组比较,差异有统计学意义(P<0.05)。不同浓度的Laropiprant作用于细胞不同时间后,其抑制率随浓度增高和作用时间增长呈下降趋势。结论 L-929小鼠肺成纤维细胞的中PGD2-DP1的表达可能与TGF-β1/Smads的调节相关。Laropiprant作用于细胞后,其抑制率随浓度增高和作用时间增长呈下降趋势。
PGD2;Laropiprant L-929;TGF-β1/Smads;支气管哮喘
支气管哮喘是一种慢性非特异性炎性疾病,在疾病的发生进展过程中,由于炎症对气道的持续性损伤和机体对损伤的修复性反应而形成的新结构,导致气道结构发生改变,即气道重塑,其主要表现为气道平滑肌和基底膜增厚及细胞外基质的沉积,炎性细胞浸润和腺体增生肥大的结果是产生持续的气道高反应性和不可逆性气道阻塞;是支气管哮喘肺功能进行性下降的重要病理学基础,亦是近年来支气管哮喘研究的热点、重点之一。因此,应对气道重塑的其发生机制,本研究将探讨PGD2对小鼠肺成纤维细胞生物学特性的影响,利用其受体特异性抑制剂Laropiprant调控TGF-β1/Smads信号通路,为进一步探讨气道纤维化形成的分子机制提供基础。
1 资料与方法
1.1 材料 L-929小鼠肺成纤维细胞细胞(第三军医大学提供),TGF-β1细胞因子(Gibco公司,USA),PCR试剂盒(大连宝生物公司),II级鸡卵清白蛋白(Sigma公司,美国);PGD2受体多克隆抗体、辣根过氧化物酶(HRP)标记的羊抗兔二抗(CsT公司,美国),BCA蛋白定量试剂盒、PVDF膜(Piece公司,美国)。
1.2 方法
1.2.1 MTT比色法 参照国家标准GB/T1688615-1997“医疗器械生物学评价第五部分:细胞毒性试验体外法”进行。将冻存的L-929细胞复苏后,将生长状态良好的L-929细胞于实验前1d传代,第2天用0.25%胰酶(pH为7.8)消化,用DMEM高糖培养基洗细胞两次(1500r/min,8min),用含10%小牛血清的DMEM培养基重悬,调整细胞数为2×105/个,铺于96孔平底板中置于37℃、5%CO2孵箱中孵育4h,待细胞贴壁后,即将实验细胞按照时间梯度分为12h组、24h组、48h组、72h组,分别加入含10%胎牛血清DMEM高糖培养基稀释试验药物(各组Laropiprant均按0.3μmL、1μmL、3μmL、10μmL比例配置),同时设正常细胞对照,每孔加入100μL试液,每个稀释度设5个复孔,置于37℃、5%CO2孵箱中孵育24h,加入5mg/mL MTT20μL/孔(每毫升PBS中溶解5mgMTT,经0.22μL 滤膜滤过以除菌和去不溶物,低温、避光保存),37℃、%CO2培养箱中继续孵育4h后,用预温的PBS清洗2遍,弃去上清,加入溶解液DMSO 100μL/孔,于微型振荡器上振荡5min,使结晶物充分溶解,使用酶联免疫检测仪在波长490nm处测定各孔吸光度(OD) 值。根据测定的吸光度值计算其相对的细胞生长抑制率。同样方法测量48h药物对实验细胞生长抑率。抑制率的计算公式:抑制率(100%)=[(对照组的OD值-给药组的OD值)/对照组的OD值]×100%。
1.2.2 RT-PCR检测 对数生长期的L-929细胞以5×104个/mL接种于25mL培养瓶内,接种24h,按Laropiprant浓度梯度将细胞分为1组(0.3μmL)、2组(1μmL)、3组(3μmL)、4组(10μmL)、5组(30μmL),每组分别加入TGF-β2(2.5ng/mL)[7]。引物序列:PGD2:上游5’-CGGAATTCATGGTCCACAGCATTCCGCTG-3’,下游5’-CGGGATCCCTAATTGATCCCGCTGCTCA-3’;TGF:上游5’-CCAGATCCTGTCCAAACTAAGG-3’,下游5’-CATGTTGCTCCACACTTGATTT-3’;smad3:上游5’-TGAACACCAAGTGCATTACCA-3’,下游5’-GGAGGTAGAACTGGCGTCTCT-3’;smad4:上游5’-ACATTGGATGGACGACTTCAG-3’,下游5’-TCAATTCCAGGTGAGACAACC-3’。细胞总RNA提取:加药后继续培养24h后加入适量的Trizol,将细胞收入EP管中。每个EP管中加入0.05μg/l氯仿0.2mL,加盖,振摇15s,室温静置3min,12000r/min离心15min,吸取上清液移至另一EP管内,加入等体积的异丙醇,混匀,静置10min,12000r/min离心15min,弃上清,加入75%乙醇1mL,7500r/min离心5min,弃上清,空气中干燥5~10min,加入DEPC(diethypyrocarbonate,焦碳酸二乙酯)水30μL溶解RNA,-80℃保存。逆转录反应体系:10×RNA PCR buffer 5μL,25mmol/L MgCl24μL,10mmol/L dNTP 1μL,Oligo dT50 pmol,Rnasin 20U,AMV 5U,cDNA 10μL,补加DEPC处理水至20μL。于热循环仪中95℃预变性
5min,再进行95℃变性1min、57℃退火1min、72℃延伸
1min,共35个循环。PCR产物用1.2%糖凝胶电泳,HB染色后拍照。通过Potoshop 图像分析系统分析各条带灰度。
1.2.3 Western blot检测TGF量 提取总蛋白,BCA法测定浓度。按Laropiprant浓度梯度将细胞分为1组(0.3μmL)、2组(1μmL)、3组(3μmL)、4组(10μmL)、5组(30μmL),每组分别加入TGF-β2(2.5ng/mL)。以每孔40mg上样,用lO的聚丙烯酸胺凝胶电泳分离蛋白,半干法转移至PVDF膜上,与小鼠抗兔的GATA-3(1∶1000)和
13-actin(1∶1000)单克隆抗体孵育4℃过夜,洗膜后,用辣根过氧化物酶标记的山羊抗小鼠的IgG抗体(1:1000)孵育6h,用发光试剂盒显示蛋白条带,使用Gensnap凝胶成像系统拍照。
1.2.4 统计学方法 所有数据采用SPSS13.0统计学软件进行处理。正态计量资料采用“x±s”表示;2组正态计量数据的组间比较采用t检验。计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PGD2-DP1抑制后TGF-β1、smad3及smad4的信号改变 随着加入Laropiprant的浓度增加,细胞TGF-β1、smad3以及smad4的表达呈下降趋势,与正常对照组比较,差异有统计学意义(P<0.05)。见图1~3。
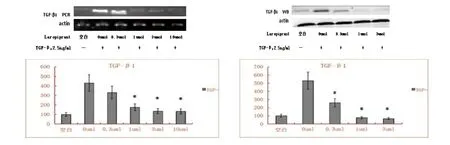
图1 TGF-β2刺激L-929细胞后使用Laropiprant抑制PGD2-DP1受体表达,使用PCR和WB法检测细胞TGF-β1的表达
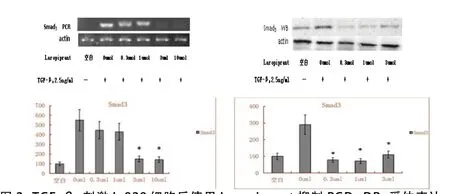
图2 TGF-β2刺激L-929细胞后使用Laropiprant抑制PGD2-DP1受体表达,使用PCR和WB法检测细胞Smad3的表达。
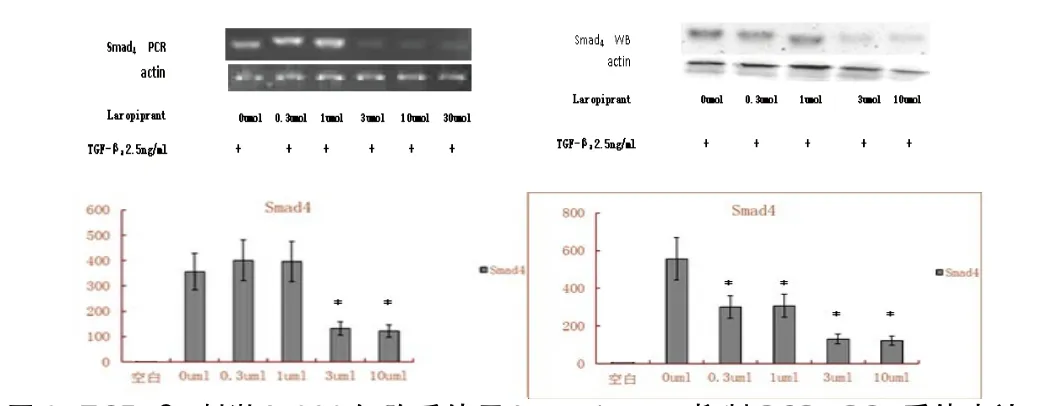
图3 TGF-β2刺激L-929细胞后使用Laropiprant抑制PGD2-DP1受体表达,使用PCR和WB法检测细胞smad4的表达。
2.2 Laropiprant抑制PGD2-DP1对小鼠肺成纤维细胞细胞活力的影响 使用EXCEL统计软件将酶标仪测得的OD值结果转变为抑制率图标。细胞抑制率随浓度增高和作用时间增长呈下降趋势,Laropiprant在浓度达到1μmol/L,作用时间在24~36h时,细胞生长抑制率明显升高(见图4)。
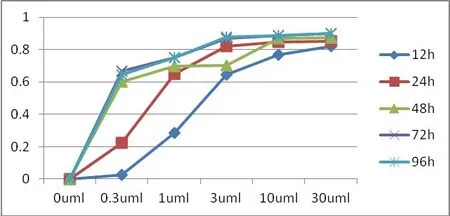
图4 细胞活力曲线图
3 讨论
支气管哮喘是由多种炎症细胞和多种炎症介质参与的慢性气道炎症,受遗传因素和环境因素的双重影响[1],且气道炎症与重塑在支气管哮喘发生发展中起重要作用。近年来关于气道重构的研究说法不一,而学者普遍认为TGF-β1在气道炎症和纤维化中发挥了重要作用。TGF-β1能刺激气道平滑肌细胞分裂与增殖,导致平滑肌增生和肥厚,促进成纤维细胞转化为肌成纤维细胞,诱导成纤维细胞合成Ñ型和Ó型胶原,诱导支气管上皮细胞合成Ô型胶原,参与并促进气道重塑的形成[2]。Smad蛋白是目前所知的惟一TGF-β1受体的胞内激酶底物,TGF-β1导致气道重塑的生物活性是通过Smad蛋白信号转导途径来实现的。使用ELISA法检测稳定期的支气管哮喘哮喘患者支气管肺泡灌洗液中TGF-β1后发现,其含量显著高于健康对照组,变应原刺激24小时后的TGF-β1浓度更高[3]。本实验以小鼠L-929小鼠肺成纤维细胞细胞为研究对象,通过应用TGF-β2刺激细胞产生PGD2,运用RT-PCR和Western blot法来检测TGF-β1、smad3和smad4的表达,结果提示:随着PGD2的浓度增加,细胞TGF-β1、smad3和smad4的表达呈下降趋势,与正常对照组比较,差异有统计学意义(P<0.05)。这说明在小鼠气道慢性炎症过程中,PGD2受体可能对细胞TGF-β1、smad3和smad4的表达具有调控作用[4-5],且在慢性气道炎症引起的气道重构中发挥了核心的作用[6-8]。但Vigola[9]上述研究证实的PGD2/DP信号转导途径,不仅能抑制成纤维细胞的迁移,也可以调整成成纤维细胞介导前胶原纤维的收缩反应,此结论提示了新的支气管哮喘气道重构的发生机制。
PGD2对哮喘免疫反应的双向调节能力,可作为炎症介质产生致炎作用。Murray[10]等人在支气管哮喘患者在吸入尘螨后对其肺泡灌洗液进行检测,发现其中的PGD2的浓度可增加15倍。PGD2不仅诱导了支气管收缩,并且促使支气管收缩的效应强于组胺30倍。在支气管哮喘患者受到抗原刺激后,其气道内存在大量PGD2。实验发现:给予环氧合酶抑制剂后,可部分抑制速发性哮喘反应的严重程度,证明了PGD2在慢性气道炎症中起到了调节作用。Kohyama[11]等人通过培养人胎儿肺成纤维细胞(HFL-1)进行体外实验,证明了PGD2不仅抑制HFL-1对人纤连蛋白(HFN)的趋化作用的因子,而且还可以减缓成纤维细胞的迁移。以上都是通过Ca2+依赖PKA信号通路来发挥作用的[12]。这种作用体现在气道炎症损伤后修复过程中,成纤维细胞过度聚集太少不利于损伤的修复,而成纤维细胞过多则会发生变形,使组织丧失的功能结构。
综上所述,L-929小鼠肺成纤维细胞中的PGD2-DP1受体可能与TGF-β1/Smads的调节相关,两者之间的关系为正相关,这与相关报道一致,但是本实验仍未涉及其具体调控机制的研究。此外,在活体复杂的环境中,PGD2对TGF-β1/Smads的调控规律也有待进一步研究。
[1] Bone HG,McClung MR,Roux C,et al.Odanacatib,a cathepsin-Kinhibitor for osteoporosis:a two-year study in postmenopausal women with low bone density[J].J Bone Miner Res,2010,25(5):937-947.
[2] Xie S,Sukkar MB,Issa R,et al.Mechanisms of induction of airway smooth muscle hyperplasia by transforming growth factor-beta[J].Am JPhysiol Lung Cell Mol Physiol,2007,293:L245-L253.
[3] Logue CA,Peak IR,Beacham IR.Facile construction of unmarked deletion mutants in Burkholderia pseudomallei using sacB counter-selection in sucrose-resistant and sucrose-sensitive isolates[J].J Microbiol Methods,2009,76:320-323.
[4] Matsumoto K,Yokote H,Arao T,et al.N-glycan fucosylation of epidermal growth factor receptor modulates receptor activity and sensitivity to epidermal growth factor receptor tyrosine kinase inhibitor[J].Cancer Sci,2009,99:1611-1617.
[5] Takahashi M,Kuroki Y,Ohtsubo K,et al.Core fucose and bisecting GlcNAc,the direct modifiers of the N-glycan core:their functions and target proteins[J].Carbohydr Res,2009,344:1387-1390.
[6] Murata T,Aritake K,Tsubosaka Y,et al.Anti-inflammatory role of PGD2 in acute lung inflammation and therapeutic application of its signal enhancement[J].Proc Natl Acad Sci USA,2013,110(13):5205-5210.
[7] Goldman R,Ressom HW,Varghese RS,et al.Detection of hepatocellular carcinoma using,glycomic analysis[J].Clin Cancer Res,2009,15:1808-1813.
[8] Newsom-Davis TE,Wang D,Steinman L,et al.Enhanced immune recognition of cryptic glycan markers in human tumors[J].Cancer Res,2009,69:2018-2025.
[9] Schwartz Jules I,Liu Fang,Wang Ying-Hong,et al.Effect of Laropiprant,a PGD2 Receptor 1 Antagonist,on Estradiol and Norgestimate Pharmacokinetics After Oral Contraceptive Administration in Women[J]. American Journal of Therapeutics,2009,16(6):487-495.
[10] Song WL,Stubbe J,Ricciotti E,et al.Niacin and biosynthesis of PGD2 by platelet COX-1 in mice and humans[J].The Journal Of Clinical Investigati on,2012,112(4):1459-1468.
[11] Sedej Miriam,Platzer Wolfgang,Heinemann ákos,et al.Cross-talk of PGD2 receptors:the DP receptor modulates signaling and trafficking of CRTH2[J].BMC Pharmacology,2010,10(S):A7.
[12] Deng H,Hershenson MB,Lei J,et al.Pulmonary artery smooth muscle hypertrophy:roles of glycogen synthase kinase-3beta and p70 ribosomal S6 kinase[J].Am J Physiol Lung Cell Mol Physiol,2010,298(6):L793-803.
Objective To explorer PGD2 biological characteristics in mice lung fibroblasts cell by Laropiprant is a specific inhibitor of PGD2receptor regulation of TGF-β1/Smads signaling pathway.Provide further basis research to explore the molecular mechanisms of airway fibrosis. Methods The cells divided by Laropiprant concentration 1 (0.3μmol) group, 2 (1μmol) group, 3 (3μmol) group, 4 (10μmol) group, 5 (30μmol) and the control group. Each group were added TGF-β2(2.5ng / mL) were cultured for 24 hours after stimulation with the corresponding concentrations of Laropiprant 24h, TGF-β1smad3and smad4expression were detected by PCR and WB, respectively. A randomized approach, using different concentrations of Laropiprant (0.3μmol, 1μmol, 3μmol, 10μmol, 30μmol)acts on cells at different times (12h, 24h, 48h, 72h, 96h) by MTT assay for cell growth Laropiprant inhibition.Results TGF-β1, smad3and smad4mRNA expression decreased with the addition of Laropiprant concentration increases, there was significant difference compared with the control group with (P<0.05). TGF-β1, smad3and smad4protein expression decreased with the addition of Laropiprant concentration increases, there was significant difference compared with the control group with (P <0.05). Cell growth inhibition rate decreased with Laropiprant concentration increasing and cell culture time growth, Laropiprant in concentration 1μml, reaction time was 24 to 36h, the cell growth inhibition was significantly improved.Conclusion PGD2-DP1expression in L-929 mouse lung fibroblasts cell may be associated with TGF-β1/ Smads regulation.
PGD2; Laropiprant L-929; TGF-β1/Smads; Biological characteristics
10.3969/j.issn.1009-4393.2015.2.002
贵州 563003 遵义市第一人民医院呼吸内科 (刘振峰 刘建英)
刘建英 E-mail:ljy2317@126.com
