聚己内酯/壳聚糖与聚己内酯/聚乳酸支架与人脂肪来源干细胞的生物相容性研究
2015-07-31姚海军肖冬冬张郑大超何创龙吴稼晟上海交通大学医学院附属第九人民医院泌尿外科上海000东华大学化学化工与生物工程学院生物材料与组织工程研究室上海交通大学材料科学与工程学院金属基复合材料国家重点实验室
姚海军 赵 阳 周 哲 肖冬冬张 明 郑大超 何创龙 吴稼晟 王 忠*. 上海交通大学医学院附属第九人民医院泌尿外科(上海 000);.东华大学化学化工与生物工程学院, 生物材料与组织工程研究室;.上海交通大学材料科学与工程学院金属基复合材料国家重点实验室
聚己内酯/壳聚糖与聚己内酯/聚乳酸支架与人脂肪来源干细胞的生物相容性研究
姚海军1赵 阳1周 哲1肖冬冬1
张 明1郑大超1何创龙2吴稼晟3王 忠1*
1. 上海交通大学医学院附属第九人民医院泌尿外科(上海 200011);
2.东华大学化学化工与生物工程学院, 生物材料与组织工程研究室;
3.上海交通大学材料科学与工程学院金属基复合材料国家重点实验室
目的 对比人脂肪来源干细胞(Human adipose derived stem cells,hADSCs)与聚己内酯/聚乳酸(Polycaprolactone/Polylactide, PCL/PLA)和聚己内酯/壳聚糖(Polycaprolactone/chitosan,PCL/CS)复合支架的生物相容性,为进一步体内组织修复提供依据。方法 体外分离、培养和扩增hADSCs,分别制备PCL/PLA、PCL/CS复合支架,扫描电镜观察支架材料的表面情况。取材料浸提液培养hADSCs,CCK-8法检测细胞活力,评价支架的细胞毒性。hADSCs传代扩增后,接种到支架材料上,裸鼠皮下培养2周,HE染色观察细胞在支架上的生长情况。结果 hADSCs与成纤维细胞相似,呈“梭形”,并以集落形式生长。扫描电镜观察PCL/CS孔径在100μm左右,孔隙率为88.76%,而PCL/PLA支架孔径则在40μm左右,孔隙率为91.45%。hADSCs在PCL/CS浸提液中培养1、3、7天的相对增殖率分别为98.6%、101.6%、110.3%,而PCL/PLA组为98.1%、100.7%、108.4%,说明hADSCs在两种浸提液中均保持较高的增殖率,即两种合成支架均无细胞毒性。hADSCs复合两种支架体内培养后,HE染色后可见有大量细胞长入PCL/CS支架内部,同时免疫组化HLA-Ⅰ检测发现,支架材料内部分细胞阳性表达,说明PCL/CS支架内该部分的细胞来源于人,即hADSCs。而在PCL/PLA内部渗透进入的细胞不如PCL/CS支架组。结论 PCL/ CS和PCL/PLA支架安全无毒,hADSCs在PCL/CS支架上显示更好的细胞相容性,该支架可以作为hADSCs的载体材料,用于组织工程膀胱修复的研究。
干细胞; 组织支架; 组织工程; 生物相容性材料
长期以来,大面积或严重缺损的膀胱修复一直是泌尿外科医生临床中所面临的难题和挑战。传统方法需借助其他组织器官来完成修补、替代,但无法做到良好的组织再生修复。虽然组织工程已为修复大面积缺损的组织器官开辟了一条崭新的途径[1],但其中仍有许多悬而未决的问题,这当中可能最为关键的依旧是种子细胞、支架材料的选择和两者相互作用后达到组织再生。
目前认为,脂肪来源干细胞(human adipose derived stem cells,hADSCs)具有跨胚层的多向分化能力,经适当条件调控后可向膀胱平滑肌和尿路上皮细胞进行诱导分化。同时由于其取材方便,自我更新快,体外培养、增殖能力旺盛,是作为组织工程化膀胱的“热门”种子细胞。
人工合成材料具有良好的力学特性,生物性能均一,能大规模生产等优势,逐渐成为支架材料研究热点,特别是经特殊修饰后的复合人工材料,可充分发挥各种材料成分的优点,达到扬长避短、优势互补,在膀胱组织工程修复研究中展现出独特的优势[2-5]。
本实验先对选取聚己内脂/壳聚糖(polycaprolactone/ chitosan, PCL/CS)、聚己内酯/聚乳酸(Polycaprolactone/ Polylactide, PCL/PLA)材料进行必要的性能分析,然后将hADSCs在PCL/CS、PCL/PLA浸提液中培养,检测两种复合支架的细胞毒性。再将hADSCs与这两种复合支架进行体内复合培养,检测其在支架上的生长情况,从而探讨哪一种复合支架更适合作为hADSCs的支架材料用于组织工程膀胱缺损的修复。
材料与方法
一、材料
本实验研究得到上海交通大学医学院伦理委员会批准。hADSCs 取自我院整复外科门诊进行抽脂手术后废弃的健康成年女性人体的脂肪组织,并获患者知情同意。分别由东华大学化学化工与生物工程学院制作并筛选出合适的PCL/PLA复合支架,由上海交通大学材料科学与工程学院制作并筛选出合适的PCL/ CS复合支架。其中,合成复合支架材料的PLA(宁波环球塑料制品有限公司),PCL(上海天清材料有限公司),CS购自国药集团化学试剂有限公司。DMEM培养基采用市售产品。
二、方法
(一)hADSCs的分离培养
参照Zuk方法[6]进行分离培养,并得到课题组多次证实后使用。
(二)PCL/CS、PCL/PLA支架的制备及扫描电镜观察[2,7]
两种材料分别在上海交通大学材料科学与工程学院和东华大学化学化工与生物工程学院制备。PCL/CS复合支架利用冷冻干燥技术以及真空热交联方法进行制备, CS与PCL按照质量百分比2:8混合。PCL/PLA复合支架利用热致相分离技术得到,PLA与PCL按照质量以3:1混合。最后将材料制备成大小10mm×10mm,厚度为2mm的补片,酒精消毒备用。
制备所得的PCL/CS、PCL/PLA支架按照扫描电镜要求分别进行喷金镀膜、液氮淬断和喷金处理后放入扫描电子显微镜观察,观察样品孔洞的大小、具体形貌以及疏密程度。
(三)支架材料孔隙率测量
将制备得到的支架样品烘干,分析天平精确称得多空支架的干燥质量,测量长度、宽度以及高度并计算得到支架表观体积,通过相应公式计算得出共混物块体的密度ρ,由下述公式得到孔洞体积分数,即

(四)hADSCs在支架浸提液中增殖率测定
将复合支架材料置于75%的酒精中,浸泡消毒过夜,吸弃酒精,紫外灯照1h,加入含10%胎牛血清的低糖DMEM培养基,置于37℃、5%的CO2的饱和湿度培养箱中进行24h培养,收集浸提液。分别设对照组(正常DMEM培养基)和实验组(支架浸提液)。选取传代后生长良好的第三代hADSCs,接种于96孔板中培养。24h后吸出培养基,实验组与对照组分别添加相对应的支架浸提液和培养基100μL并继续培养。分别于第1、3、7天对hADSCs增殖率进行测定,在相应时间点,实验组与对照组各取5个孔,每孔加入10μL CCK-8溶液,继续培养1h,在酶标仪上选用450nm波长测定各孔A值,并计算相对增殖率=实验组A值/对照组A值×100%。对照美国药典中细胞相对增殖率与细胞毒性分级的关系,评价毒性情况。
(五)hADSCs与支架共培养
所谓共培养[8]就是将细胞与支架混合共同培养,使得细胞能完全适应支架环境并稳定地贴附在支架表面。将支架裁成10 mm×10 mm大小,75%酒精浸泡消毒过夜,吸弃酒精,紫外灯照1h,PBS冲洗后加入含10%胎牛血清的低糖DMEM培养基预培养过夜。第2天取过夜培养的支架材料,然后吸弃上清及材料表面的培养基后待用。选取传代后生长良好的第三代hADSCs制成密度为2×106/mL的细胞悬液,取1mL细胞悬液使细胞均匀接种至每个预培养过的支架材料表面,待细胞扩散和黏附于支架后再次小心加入含10%胎牛血清的低糖DMEM培养基,置于37℃、体积分数为5%的CO2饱和湿度培养箱中进行体外培养。体外培养3h后,植入裸鼠皮下进入体内培养。
(六)细胞增殖的组织化学观察及HLA-I检测
裸鼠皮下培养后2周后取材,取材后进行石蜡切片:立即用4%的多聚甲醛溶液固定,酒精梯度脱水,常规石蜡包埋,切片机将材料切成 6μm厚,进行苏木素-伊红(HE)染色,在光镜下观察细胞在支架内的生长情况。HLA-I检测:以3%过氧化氢溶液去除内源性过氧化物酶,再用0.1%胰酶修复抗原,然后滴加羊血清封闭非特异性抗原。一抗为兔抗人HLA-Ⅰ抗体(anti- HLA-Ⅰ,Epitomics,USA),4℃过夜。二抗为偶联过氧化物酶的羊抗兔单克隆抗体,DAB显色。苏木素衬染细胞核,1%盐酸酒精分化,95%~100%乙醇脱水,二甲苯透明处理,中性树胶封片,光镜观察。
(七)统计学分析
结 果
一、hADSCs的形态、生长特性
原代细胞经胶原酶消化后培养4~6h,可见有部分细胞贴壁。这些贴壁细胞呈梭形,类似于成纤维细胞样形态,并有少量三角形、多边形细胞混于其中。随着培养时间的延长,这部分贴壁细胞数量逐步增多,并出现集落状生长,集落中细胞形态为典型梭形,但集落大小参差不齐,所包含的细胞数从数个至数百个不等。24h后进行首次换液,培养时每48h换液,培养1周左右可达80%~90%的致密层,继续培养至9~10d可形成100%融合的致密单层。传代后的ADSCs细胞形态一致,主要为梭形,其中少量为三角形或多边形,且生长旺盛,15代以内细胞形态无明显变化。
二、支架材料的构建
制备PCL/CS以及PCL/PLA多孔支架,其外观均呈白色,扫描电镜观察PCL/CS支架孔径在100μm左右,孔隙率在88.76%,而PCL/PLA支架孔径则在40μm左右,但大小不一,其孔隙率为91.45%。上述支架均具有较高的孔隙率能为细胞的增殖提供足够的空间,接近理论计算值(约90%),符合度良好。孔隙率的增加,可扩大细胞接触面,使得更多的细胞吸附于支架上。理想的孔隙率更利于种子细胞渗入支架内部并进行增殖,提高细胞接种的密度,见表1。
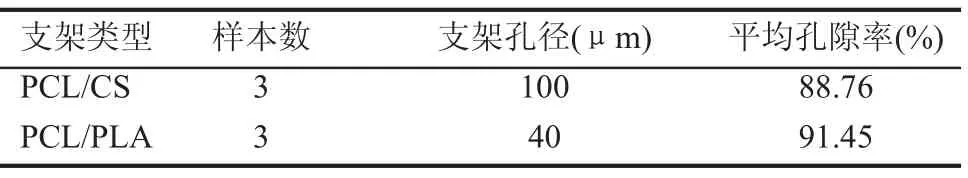
表1 PCL/CS多孔支架的孔径及孔隙率
三、hADSCs在PCL/CS及PCL/PLA浸提液中增殖率的测定
各实验组和对照组的细胞A值均随培养时间延长而增大,第1、3、7天PCL/CS组的细胞相对增殖率分别为98.6%、101.6%、110.3%;而PCL/PLA组分别为98.1%、100.7%、108.4%(表2)。统计结果显示,第1,3,7天各实验组与对照组之间的A值无显著性差异(P>0.05),说明浸提液对细胞增殖无明显影响,符合组织工程材料的基本要求。对照美国药典中细胞毒性分级,两组材料浸提液的毒性评级均为0或1级(见表2),可以说明细胞在浸提液中保持较高的增殖率,即无细胞毒性。
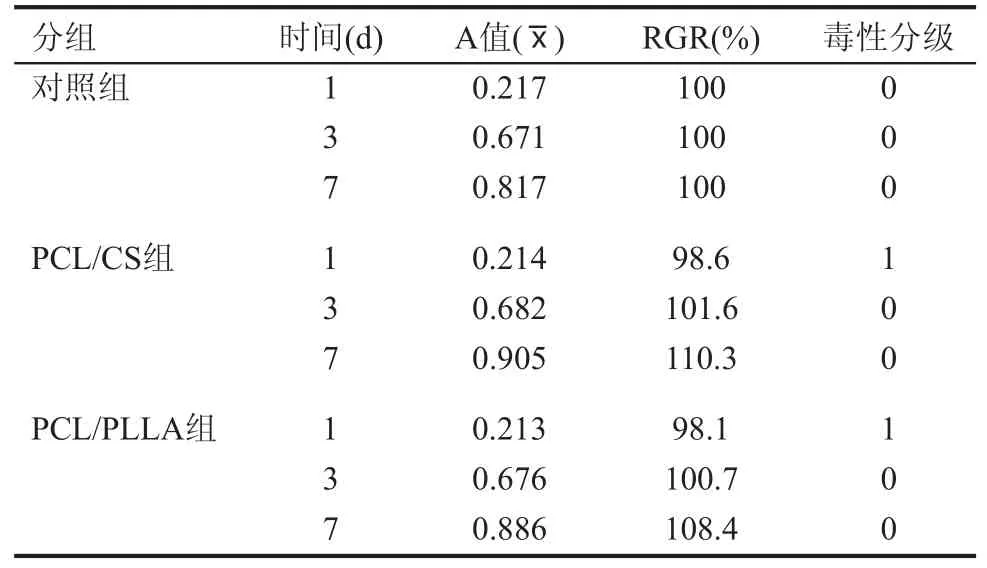
表2 不同支架材料浸提液的细胞相对增殖度与毒性等级评价
细胞在各支架材料浸提液中的细胞生长曲线见图1。各实验组细胞的生长趋势均与对照组类似,1~3d细胞呈生长迅猛,而3~7d细胞生长有所放缓,但仍显示出细胞生长状态良好。从细胞生长曲线分析,PCL/CS、PCL/PLA组细胞生长均未受抑制。
四、细胞和支架材料的复合情况
hADSCs复合两种支架,经过2周体内培养后,细胞均能长入支架的空隙内, PCL/PLA组细胞主要附着的支架表面,少量细胞渗透到支架内部空隙中,但大量细胞长入 PCL/CS支架内部(图2B)[2],说明相对于PCL/PLA,PCL/CS支架具有更好的生物相容性。免疫组化HLA-Ⅰ检测发现,支架材料内部分细胞阳性表达,说明支架内该部分的细胞来源于人,即hADSCs(图2C)。
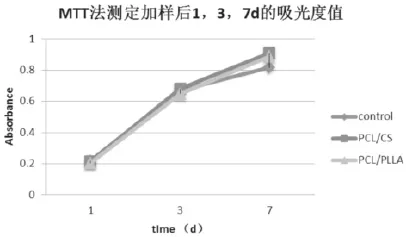
图1 MTT法比较脂肪来源干细胞在不同支架上的生长曲线
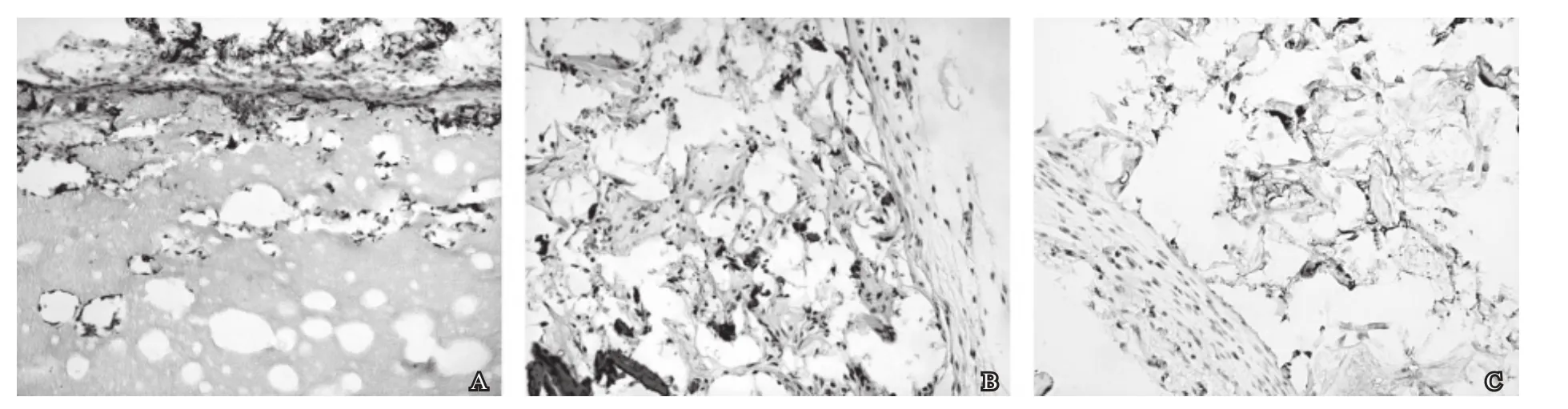
图2 hADSCs复合PCL/PLA、PCL/CS支架体内培养的组织学检测(HE染色, ×200)A: hADSCs复合PCL/PLA体内培养2周; B: hADSCs复合PCL/CS体内培养2周; C: hADSCs复合PCL/CS支架体内培养HLA-Ⅰ免疫组化检测(×200)
讨 论
理想的组织工程支架不仅为种子细胞提供三维立体空间支撑,更重要的是引导种子细胞按特定形态促进组织构建和再生,同时作为细胞间信号转导和相互作用的媒介,提供细胞生长所必需的生物活性剂,促进移植物血管化,最后被机体降解和新生软组织替代[9],支架材料的降解不会对种子细胞生存的微环境产生不良影响。
组织工程支架材料主要分为天然细胞外基质、脱细胞基质及人工合成可降解聚合材料。研究表明CS壳聚糖(chitosan,CS)又称脱乙酰甲壳素,可由自然界广泛存在的几丁质经过脱乙酰作用而得到的,是一种优良的天然生物材料,其结构与糖胺聚糖类似的。它是迄今为止自然界中所发现的唯一具有带有正电荷、明显碱性的天然多糖[10]。另外,壳聚糖成膜性好,与生俱有高效的生物可降解性和生物相容性,还拥有可利用的活性基团,使其在组织工程中得到广泛的应用[4,5]。PCL虽然具有良好的力学性能,但是其高度疏水性以及缺乏生物活性等不足,限制了其在组织工程中的进一步应用。另外,在研究中我们也发现hADSCs与支架经共培养后转入体内,细胞均可有效渗入支架内,说明PCL经过CS或PLA修饰后,其材料的性能出现优势互补,从而更加有利于种子细胞在支架材料上进行贴附生长并增殖。同时还发现,相对于PCL/PLA,更多的细胞长入PCL/CS支架的空隙内,说明此支架具有更好的细胞亲和性。经免疫组化HLA-Ⅰ检测后发现,体内培养2周后,大量hADSCs能有效渗透进入PCL/CS支架内部,表明PCL/CS多孔支架更适于hADSCs黏附扩增。这可能是由于CS与PCL复合后,CS的良好生物活性改善了PCL的疏水性,使其具有更佳的生物相容性。而PLA同样为生物聚合材料,对PCL的疏水性改善不明显,有可能导致其生物活性有所欠缺。也有可能是CS的多糖特性促进细胞的生长和增殖[10],而PLA降解后的产物乳酸造成的酸性环境影响细胞存活[11]。
本实验结果提示,两种支架均安全无毒,适合进行细胞材料的接种;相对于PCL/PLA,PCL/CS具有更好的细胞相容性,可进一步用于体内组织工程膀胱缺损修复的实验研究。利用PCL/CS并植入合适的种子细胞进行大面积膀胱缺损修复,是下一步研究的方向,并可进一步评估膀胱替代后的功能情况。
1 Chung SY. Bladder tissue-engineering: a new practical solution?. Lancet 2006; 367(9518): 1215-1216
2 周哲, 吴稼晟, 张明, 等. 人脂肪来源干细胞与聚己内酯/壳聚糖支架的生物相容性研究. 组织工程与重建外科2013; 9(3): 133-136
3 Sarasam A, Madihally SV. Characterization of chitosanpolycaprolactone blends for tissue engineering applications. Biomaterials 2005; 26(27): 5500-5508
4 Feng H, Dong CM. Preparation and characterization of chitosan-graft poly(e-caprolactone) with an organic catalyst. J Polym Sci A Polym Chem 2006; 44(18): 5353-5361
5 Chen H, Fan X, Xia J, et al. Electrospun chitosan-graftpoly (e-caprolactone)/poly (e-caprolactone) nanofibrous scaffolds for retinal tissue engineering. Int J Nanomedicine 2011; 6: 453-461
6 Zuk PA, Zhu M, Ashjian P, et a1. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell 2002;13(12): 4279-4295
7 姚海军, 赵阳, 周哲, 等. 人脂肪来源干细胞与左旋聚乳酸/聚己内酯支架的体内外生物相容性研究. 组织工程与重建外科 2014; 10(5): 255-258
8 张明, 周哲, 周娟, 等. 人脂肪干细胞与猪尿路上皮细胞隔离共培养后向尿路上皮样细胞分化. 中华临床医师杂志•电子版 2012; 6(8): 109-112
9 Brehmer B, Rohrmann D, Becker C, et al. Different types of scaffolds for reconstruction of the urinary tract by tissue engineering. Urol Int 2007; 78(1): 23-29
10 Bhattarai N, Edmondson D, Veiseh O, et al. Electrospun chitosan-based nano bers and their cellular compatibility. Biomaterials 2005; 26(31): 6176-6184
11 赵宇, 胡平, 陆应麟, 等. 新型生物可降解材料与骨髓间充质干细胞生物相容性研究. 中国修复重建外科杂志2004; 18(2): 104-107
(2015-04-20收稿)
Biocompatibilty analysis of human adipose-derived stem cells and Polycaprolactone/chitosan or Polycaprolactone/ Polylactide scaffold
Yao Haijun1, Zhao Yang1, Zhou Zhe1, Xiao Dongdong1, Zhang Ming1, Zheng Dachao1, He Chuanglong2, Wu
Jiachen3, Wang Zhong1*
1. Department of Urology,Shanghai 9th People' s Hospital,Shanghai Jiaotong University School of Medicine , Shanghai 200011, China; 2. College of Chemistry, Chemical Engineering and Biotechnology, Donghua University; 3. State Key Lab
of Metal Matrix Composites, Shanghai Jiaotong University School of Materials Science and Engineering
Wang Zhong, zhongwang2010@sina.com
Objective To observe the growth of human adipose derived stem cells cultured on Polycaprolactone/ chitosan (PCL/CS) and Polycaprolactone /Polylactide(PCL/PLA) biomaterials in vitro and in vivo. Methods hADSCs were isolated from human subcutaneous adipose tissue after collagenase digesting, ltrating and centrifuging. The scaffoldwas prepared by freeze-drying technique and the method of vacuum thermal cross-linking. The cytotoxicity of scaffold was evaluated by cell growth. The third passage of hADSCs were seeded onto the PCL/CS and PCL/PLA scaffolds and were subcutaneously planted into nude mice for observing hADSCs growth in vivo. Results hADSCs growed faster in the leaching solution of the PCL/CS or PCL/PLA.The PCL/CS,indicating that PCL/PLA scaffolds were non-toxic for hADSCs growth.The histological analysis showed that hADSCs could grow in the space of the scaffolds no matter in vitro or in vivo culture.When cultured in vitro, some cells adhered at the edge of the scaffolds 1 week later and more cells grew into the inside of the scaffolds after 2 weeks. When cultured in vivo, a great deal of cells grew into the scaffolds. Conclusion Both of PCL/CS and PCL/PLA scaffolds are non-toxic, but former has a better biocompatibility with hADSCs than later,suggesting that it can be used as a vehicle for hADSCs in tissue engineering repair of bladder defect reconstruction.
stem cells; tissue scaffolds; tissue engineering; biocompatible materials
10.3969/j.issn.1008-0848.2015.08.004
R 318.08
*通讯作者, E-mail: zhongwang2010@sina.com
