雌激素及雌激素受体与良性前列腺增生症
2015-07-31黄成然张春阳综述钟秀宏审校吉林医药学院0级临床本科班吉林303吉林医药学院病理教研室
黄成然 陈 钱 张春阳 张 齐 综述 钟秀宏 审校. 吉林医药学院0级临床本科班(吉林 303); . 吉林医药学院病理教研室
雌激素及雌激素受体与良性前列腺增生症
黄成然1陈 钱1张春阳1张 齐1综述 钟秀宏2审校
1. 吉林医药学院2011级临床本科班(吉林 132013); 2. 吉林医药学院病理教研室
良性前列腺增生症(benign prostatic hyperplasia,BPH)是中老年男性排尿障碍原因中最常见的良性疾病[1,2]。近年来越来越多的研究表明,雌激素可能参与了前列腺腺体的自稳调节和间质增生的形成,由于雌激素主要通过雌激素受体(ER)发挥生物学功能,因此,雌激素及其受体在其发病中的作用机制越来越受到重视。本文对雌激素及ER与BPH的相关性研究做一综述。
一、雌激素
雌激素是一类化学结构相似、分子中含有18C的甾体激素,其合成过程是以胆固醇为原料,在羟化酶和裂解酶的作用下,生成 C-19类固醇(如雄激素),然后在芳香化酶 (aromatase, Ar)的作用下生成 C-18类固醇(即雌激素)。雌激素合成主要在卵泡内进行。雄激素是胆固醇合成雌激素的中间产物,芳香化酶是限速酶。因此,雄性器官组织只要存在芳香化酶, 即能以睾酮或睾酮的前体物质(如脱氢表雄酮, DHEA)为底物合成雌激素。
二、雌激素受体
(一)发现
Jensen[3]于1962 年发现了ER,在 1970年Kushner等[4]又成功分离出 ER,有报道[5]Chambon于1986年克隆出一种雌激素受体ERα,Giguere等于1988 年筛选到雌激素受体相关受体(estrogen receptor-related receptor, ERR), 它包括 3 个亚型 ERRα、ERRβ和ERRγ。 ERRα是最早发现的 ERR 亚型, 它与 ERα 在 DNA 结合 结构 域(DNA binding domain, DBD)和配体结合结构域(ligand binding domain,LBD)上的同源性分别达到了 68%和 37%。在1996 年,Kuiper[7]在大鼠卵巢和前列腺cDNA 文库中成功克隆出雌激素受体ERβ, 两年后Ogawa[8]又进一步成功分离到完整的人ERβ基因。ERα、ERβ二个雌激素受体都和前列腺有关。
(二)结构
ERα基因位于人类第6号染色体的6q25.1区[9],ERβ的编码基因位于第14号染色体的q臂。两种受体基因的主要差别是内含子长度不同[10]。ERα和ERβ由A-F 共6个功能区构成。N-端的 A/B区为 1-149氨基酸,主要是激活功能区(AF-1),为转录调控区,ERα有AF1区,而ERβ无AF1区[11]。C 区为 150-214 氨基酸,是DNA结合区,主要有两个锌指结构组成,是雌激素反应原件,可识别和结合特异性DNA序列。D 区为 215- 248氨基酸,为铰链区,可与热休克蛋白(HSP)结合,后者可以帮助 ER 进行适当折叠,使之处于非活性状态。C-端的 E/F 区为 249- 530氨基酸,是 ER 最大的功能区。E区主要包含配体结合区,可保证与雌激素结合的专一性,在E区ERα和ERβ两者的同源性为60%,含有配体依赖的激活区AF2,与受体二聚体化、受体的核定位、辅激活子、辅抑制子相互作用有关。F区主要是维持ER的稳定,对招集共激活因子也有很大的作用[12]。ERα和ERβ具有相似的生化特征,但是不同的结构决定了其在启动激活细胞特异状态下的不同转录效应。
(三)分布与调控
雌激素受体位于胞浆和胞核内, 胞浆内的雌激素受体具有运载雌激素的作用, 胞核内的雌激素受体具有转录因子的作用。ER与雌激素在核内结合并且能够由配体独立活化转录。ERα及ERβ两者在前列腺的分布并不相同,ERα主要分布于前列腺外周带的间质(基质)细胞,而ERβ主要分布于前列腺的上皮细胞和间质(基质)细胞[13-15],且上皮中的表达率高于间质(基质)细胞[16]。雌激素能够直接作用于前列腺间质细胞上的膜受体,快速激活细胞内丝裂原活化蛋白激酶(MAPK)途径,进而调控细胞的增殖[17]。
三、雌激素及其受体与BPH的发生
研究发现, BPH发生于雄激素水平逐渐降低的老年,说明雄激素的作用并不是BPH发生的唯一因素。朱刚等[18]研究发现,雌激素浓度与前列腺间质(基质)细胞生长的关系呈倒 U 形,雌激素和雄激素同时存在时,前列腺间质细胞的处于一种稳定状态,一旦雌雄激素的相互平衡打破后,就会引起前列腺间质细胞的过度增生,前列腺间质细胞主要由平滑肌细胞(smooth muscle cell , SMC)和成纤维细胞组成。目前大部分学者认为雌、雄激素水平保持动态平衡有助于前列腺的生长、发育及功能的维持,而随年龄的增长,睾丸功能减退,体内雄激素水平下降,血浆和前列腺组织中雌/雄激素比例明显增加,将打破原有的平衡使前列腺增殖与凋亡状态发生改变,从而引发了BPH[19]。
临床上 BPH患者前列腺组织中成纤维细胞、SMC、腺上皮细胞各自增生程度有差异[20]。宁召臣等[21]发现在大鼠和人 BPH 组织中早期生长反应基因1 (early growth response gene 1,EGR1)高表达, 而且在大鼠 BPH 芯片结果中发现,EGR1 的上调主要发生在上皮组织,在体外实验中,通过构建EGR1 稳定转染细胞系,发现过表达 EGR1 能促进BPH-1 细胞系(前列腺增生上皮细胞系)的增殖。然而,目前大部分学者认为,基质增生是BPH主要类型。Krieg等[22]研究发现,BPH基质(间质)细胞中雌激素水平比上皮细胞和正常前列腺上皮细胞、基质细胞的水平高。陈金海等[23]为了研究雌、雄激素的比例变化对间质(基质)细胞的影响,进行体外培养SD大鼠前列腺间质细胞,参考了老年雄鼠前列腺组织内的雌、雄激素水平,进行模拟前列腺间质(基质)细胞生长的体内环境,并以高比例的雌/雄激素模拟老年SD雄性大鼠前列腺组织内的水平,研究发现,高比例的雌/雄激素可以使基质细胞的生长提前达到高峰,同时促进间质(基质)细胞的增殖及减少间质(基质)细胞的凋亡。Prezioso等[24]也认为, BPH的发生和发展与间质细胞雌激素效应的增强密切相关,随着进一步研究,另有学者提出,上皮-间质相互作用在激素应答中起着重要的作用[25],如增生的前列腺上皮细胞能够通过分泌前列腺素E2(PGE2)促进间质细胞中Ar的表达进而促进睾酮向雌二醇(estradiol, E2)的转化,并且雌激素还可以通过调节上皮细胞系的旁分泌作用进而促进间质细胞增殖、分化及细胞外基质合成的细胞活动[24]。
白志明等[27]为了了解前列腺间质细胞对性激素的反应性,用体外细胞培养技术分离培养人增生性前列腺间质细胞,观察了细胞纯度和由性激素诱导的细胞增殖反应。研究发现离体条件下,细胞对雌激素诱导的 DNA 合成作用不及雄激素,同时随细胞传代数增加,平滑肌成分会逐渐转变为更原始的间质细胞而失去对雌激素的敏感性。然而,有学者报道[28]雌激素对平滑肌细胞的激活作用是显著的。田坚等[29]采用睾丸切除术建立雄性SD 大鼠去势模型,用RT-PCR方法观察血红素氧化酶1(HO-1)和 HO-2 的转录水平,应用免疫组织化学结合图像分析技术,观察去势,以及外源性雄激素和雌激素对前列腺腹侧叶中HO-1和HO-2蛋白水平的影响。结果显示,性激素对HO-1有诱导作用,但对HO-2无明显的影响,因此,他们认为一氧化碳-血红素氧化酶(CO-HO)系统可能参与了性激素引起前列腺异常增殖的病理过程,并且H O-1来源的 CO 对前列腺平滑肌活动的调节可能起重要的作用。另有报道,雌激素还能通过诱导转化生长因子(TGFβ2)的表达及影响SMC表型转化来促使 BPH的发生[20,30]。
雌激素通过ER介导参与了老年男性良性前列腺增生的发生、发展全过程已为学者们所共识[31],如蔡文清等[32]提出BPH主要发生在移行区,可能与ER在移行区表达较高有关。但是关于雌激素通过何种受体发挥作用,则有不同的报道。国外一些学者[33]认为,ERβ在前列腺中的上皮细胞和间质(基质)细胞中均有表达,ERβ可能参与了雌激素诱导的前列腺细胞的过度增殖;然而,吕强等[34]发现正常前列腺组和BPH组 ERβ表达无差异,并且BPH前列腺上皮细胞中ERβ阳性率比正常要低。为此,有学者进行深入研究,在对ERα基因敲除(KO)后发现前列腺增生不明显,而在对ERβ基因敲除后前列腺上皮增生增加,因此,他们推测ERα可能有促前列腺细胞增殖的作用,ERβ可能具有抑制前列腺细胞异常增殖和潜在的抗肿瘤作用[35]。为此,邵瑞等进一步研究发现,ERα对BPH组织中部分基底细胞去分化为干性细胞在促前列腺细胞增殖中起了很大的作用,并且去分化为干性细胞的基底细胞是雌激素的靶细胞[36]。ERα 和ERβ出现上述不同生物学效应,可能与ERα和ERβ的配体结合结构域及AF-1上的差异有关。由于多数学者认为ERα可能与 BPH 的发生密切相关,因此,在BPH研究中,关于ERα研究较深入,陈金海等[23]研究发现,ERα在正常前列腺组织间质中呈散在分布,在腺泡周围一些间质细胞中也有分布,但是在BPH组织间质中其分布密集, 而在腺泡周围的很多间质细胞中呈阴性。因此,目前大部分学者认为,雌/雄激素比例升高可能主要通过上调ERα的表达达到促增殖效应的[37]。
ERR 是雌激素受体相关受体,在结构上与雌激素受体有很强的同源性, ERRα是其中一个亚型。苗琳等[38]研究发现,上皮细胞分泌的 PGE2 可上调间质细胞中ERRα的表达,ERRα可能进一步增强了间质细胞的雌激素效应,从而对 BPH 的发展产生了影响。Yang等认为[39],ERRα也可以通过结合在Ar启动子上,调节Ar的表达,该限速酶可催化睾酮向E2的转化,而目前众多报道表明,E2是影响前列腺疾病的关键因素[40],见图1。
四、雌激素受体调节剂与BPH治疗
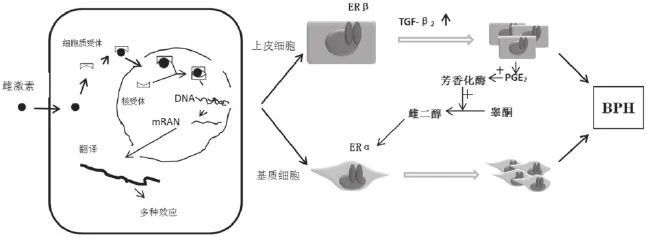
图1 雌激素及雌 激素受体与良性前列腺增生症关系
大量研究发现,植物雌激素对雌激素相关疾病有广泛的预防作用[41]。植物雌激素为杂环多酚类化合物,主要存在于植物及其种子里[42]。大豆苷元、葛根素属于植物雌激素,其结构与E2相似。植物雌激素可以与ER结合,当体内雌激素水平较高时发挥抗雌激素活性。曾靖等[43]把大豆苷元进行结构修饰和改性,新合成了强水溶性物质新化合物3'-大豆苷元磺酸钠,发现其对丙酸睾丸素所致小鼠前列腺增生具有显著的拮抗作用,其作用机制可能一定程度上与抑制ERα的表达有关。陈江林等[44]发现,葛根素同样具有抑制前列腺增生的作用,并具有上述作用机制。另外,国内有学者通过中药调控ER的表达来治疗前列腺增生,如蔡文清等[45]研究发现,自制中药方剂Ⅰ号对实验性小鼠尿生殖窦植入造成的前列腺增生具有明显的治疗作用,其治疗前列腺增生的机制与其抑制前列腺细胞 ER的表达从而抑制前列腺细胞的增殖有关。
BPH发病率占老年男性疾病首位。尽管BPH病因尚未完全明了,但是雌激素及其受体在BPH发生、发展中所起的作用已经被医学界所共识。然而目前临床上BPH药物治疗仍有不满意之处,相信随着 BPH病因学研究和认识的不断深入,BPH的药物治疗必定会有更好的前景。
致谢:本课题由吉林省教育厅课题[吉教科合字(2012)第495号]、 吉林省社科联资助课题(1123-2)、吉林医药学院教育教学专项研究立项课题(ZX2015-YB014)资金项目资助
雌激素类; 受体, 雌激素; 前列腺增生
1 崔光华, 钟秀宏, 尤淑霞. 中国男科学杂志 2014; 28(2): 60-61
2 崔光华, 钟秀宏, 谷玲卫, 等. 黑龙江医学 2014; 38(1): 79-80
3 Jensen EV. Recent Prog Homone Res 1962; 18: 387
4 Kushner PJ, Agard DA,Green GL, et al. J Steroid Biochem Mol Biol 2000; 74(5): 311-317
5 Green S, Walter P, Kumar V, et al. Nature 1986; 320: 134-139
6 Giguere V, Yang N, Segui P, et al. Nature 1988; 331(6151): 91-94
7 Kuiper G G J M, Enmark E, Pelto-Huikko M, et al. Proc Nall Acad Sci USA 1996; 93: 5925-5930
8 Ogawa S, Inoue S, Watanabe T, et al. Biochem Btophy Res Commu 1998; 243: 122-126
9 马然, 卢剑, 马潞林. 临床泌尿外科杂志 2011; 26(7): 550-555
10 张涛, 崔彦. 中国实验诊断学 2011; 15(2): 374-377
11 Prins GS, Korach KS. Steroids 2008; 73(3): 233-244
12 黄卉, 许增禄, 黄秉仁. 医学研究杂志 2013; 42(3): 182-185
13 Tsurusaki T, Aoki D, Kanetake H, et al. J Clin Endocrinol Metab 2003; 88(3): 1333-1340
14 Marika JL,Kimmo JS,Teuvo LJ, et al. The Prostate 2003;55(3):180-186
15 Nomura H, Kawashima H, Masaki S, et al. Prostate Cancer Prostatic Dis 2009; 12(4): 375-381
16 Taylor AH, Al-Azzawi F. J Mol Endocrinol 2000; 24(1): 145-155
17 张智松, 刘杰, 杜小玲, 等. 中国生物化学与分子生物学报2008; 24(2): 153-159
18 朱刚, 王建业, 刘俊达, 等. 中华泌尿外科杂志 2000;21(6): 361-363
19 Peng CC, Liu JH, Chang CH, et al. Evid Based Complement Alternat Med 2013; 2013: 408734
20 Izumi K, Mizokami A, Lin WJ, et al. Am J Pathol 2013; 182 (6):1942-1949
21 宁召臣, 石建党, 周颖, 等. 中国生物化学与分子生物学报2013; 29(8): 751 -758
22 Krieg M, Nass R,Tunn S. J Clin Endocrinal Metab 1993;77(2): 375-381
23 陈金海, 胡万里, 程蓓. 武汉大学学报•医学版 2012;33(5): 623-626
24 Prezioso D, Denis L J, Klocker H, et al. Int J Urol 2007;14(1): 1-16
25 Said MM, Hassan NS, Schlicht MJ, et al. J Toxicol Environ Health A 2015; 78(7): 453-465
26 Miao L, Shi J, Wang CY, et al. Mol Endocrinol 2010;24(6): 1175-1186
27 白志明, Collins AT , Neal DE. 中华泌尿外科杂志 1998;19(10): 616-618
28 程俊, 杨艳, 曾晓荣, 等. 黑龙江医学成然 2006; 30(12): 884-886
29 田坚, 郑煜, 杨春. 生理学报 2004; 56(1): 54-59
30 吴荃, 张智松, 周颖, 等. 南开大学学报•自然科学版2007; 40(2): 57-61
31 Ho CK, Habib FK. Nat Rev Urol 2011; 8(1): 29-41
32 蔡文清, 凌亦凌, 张勇, 等. 中华物理医学与康复杂志2000; 22(2): 103-105
33 Shughrue PJ, Lane MV, Scrimo PJ, et al. Steroids 1998; 63(10): 498-504
34 吕强, 华立新, 钱立新, 等. 南京医科大学学报•自然科学版 2005; 25(2): 105-108
35 Agras K, Willingham E, Shiroyanagi Y, et al. J Urol 2007; 177(6): 2386-2392
36 邵瑞, 周颖, 刘文华, 等. 南开大学学报•自然科学版2013; 46(1): 34-37
37 Nicholson TM, Sehgal PD, Drew SA, et al. Differentiation 2013; 85(4-5):140-149
38 苗琳, 石建党, 周颖, 等. 中国生物化学与分子生物学报2008; 24(8): 712-718
39 Yang C, Chen S. Cancer Res 1999; 59(18): 4519-4524
40 封玉宏, 刘龙, 曹志强, 等. 临床医学工程 2013; 20(1): 21-22
41 Wang C, Du X, Yang R. J Steroid Biochem Mol Biol 2015; 145: 28-37
42 贺红莉, 金焕, 王继峰, 等. 中国中药杂志 2002; 27(11): 805-807
43 曾靖, 胡蓉, 江丽霞, 等. 中国实验方剂学杂志 2013;19(10): 170-173
44 陈江林, 熊丽娇, 江丽霞, 等. 时珍国医国药 2014; 25(8): 1820-1822
45 蔡文清, 黎玮, 张勇. 中华物理医学与康复杂志 2001;23(6): 362-364
(2015-05-15收稿)
10.3969/j.issn.1008-0848.2015.08.016
R 697.32
