木瓜蛋白酶提取蛇皮胶原蛋白的工艺研究
2015-07-28吴玉琼骆红霞胡永乐温爱国武夷学院茶与食品学院福建武夷山354300武夷山蛇类研究所福建武夷山354300
吴玉琼,骆红霞,胡永乐,张 静,温爱国(.武夷学院 茶与食品学院,福建 武夷山 354300;.武夷山蛇类研究所,福建 武夷山 354300)
木瓜蛋白酶提取蛇皮胶原蛋白的工艺研究
吴玉琼1,骆红霞1,胡永乐1,张静1,温爱国2
(1.武夷学院 茶与食品学院,福建 武夷山 354300;2.武夷山蛇类研究所,福建 武夷山 354300)
摘要:采用木瓜蛋白酶从人工养殖的蛇皮中提取胶原蛋白,研究了提取液的pH值、酶浓度、温度、固液比和提取时间对胶原蛋白提取率的影响。结果表明,木瓜蛋白酶提取蛇皮中胶原蛋白的最佳工艺为:提取温度30℃,提取剂柠檬酸,木瓜蛋白酶浓度3.00%、固液比1:10、pH值6、提取时间24 h,在此条件下胶原蛋白提取率为89.30%。
关键词:蛇皮;胶原蛋白;木瓜蛋白酶;最佳参数
胶原蛋白是一种白色、不透明、无支链的纤维蛋白质,是由动物细胞合成的一种生物性高分子,广泛存在于动物的骨、腱、肌鞘、韧带、肌膜、软骨和皮肤中,是结缔组织中极其重要的一种蛋白质,具有重要的生物学性质和较好的力学性能,具有良好的生物相容性和可生物降解性,还具有促进细胞生长的特性[1-3]。
研究表明胶原蛋白的应用极为广泛,主要有临床医学有促进细胞的损伤修复和细胞生长[4-9],生物发酵中作为一种新型的生物发酵培养基[10],在食品中的应用于功能性食品、肉制品改良剂、食品包装材料等[11-13]。
胶原蛋白的提取一般集中于胶原蛋白较为丰富的组织,例如皮肤和肌腱。胶原的提取除了传统的来源一一一牛、猪、羊,还拓展到许多其他的资源,例如人的胎盘[14]、海洋生物[15],甚至是利用基因生物技术从转基因动物获取重组人胶原蛋白[16-17]。
我国蛇资源丰富,由于蛇皮外观的花纹清晰艳丽,图案独特,经制革工艺处理后,用来制作各种精美别致的工艺品,或可用来制作乐器的琴膜和鼓皮。但由于蛇皮工艺技术的落后,在加工过程中,产生了大量下脚料,约占完整蛇皮的20%~30%,如果不进行有效处理,不仅污染环境,还浪费大量的原料。蛇皮中含有大量的胶原蛋白,当前,以鱼鳞、各类动物皮制备的一系列胶原产品已具有广阔的应用领域,横跨化工业、食品行业、化妆品业、医药业,可见以蛇皮制备胶原的系列产品的开发也有着美好的前景。
武夷山素有“蛇的王国”之美誉,不仅因为其具有多种多样的生态环境,为蛇的栖息、繁衍提供了适宜的条件,还因武夷山蛇类养殖产业发展广泛,仅市区周边的蛇类养殖户就有数十家,养殖基地面积达300 m2。据调查,本地每年产蛇量可达100 t,其中10%为蛇皮,用于工艺品加工后被废弃的副产物达3%,可见综合开发利用武夷山菜蛇资源是促进蛇类养殖业长足发展的趋势。
本文采用木瓜蛋白酶,以武夷山人工养殖的王锦蛇(Elaphe carinata)、赤链蛇(Dinodon rufozonatum)等蛇皮为原料,探讨了蛇皮中胶原蛋白的提取工艺,确定了酶法从蛇皮工艺下脚料中提取胶原蛋白的最佳工艺条件,以制备高附加值、市场前景广阔的胶原蛋白,从而变废为宝,实现废物利用。
1 材料与方法
1.1材料与试剂
1.1.1主要材料
蛇皮:由武夷山蛇博园提供。
1.1.2主要试剂
木瓜蛋白酶(上海沃凯药业有限公司)
L-羟脯氨酸(上海沃凯药业有限公司)
对二甲氨基苯甲醛(Sigma公司)
氯胺T(国药集团化学试剂有限公司)
1.1.3主要仪器
UV-1800型紫外可见分光光度计(上海美谱达仪器有限公司)
FW100高速万能粉碎机(天津市泰斯特仪器有限公司)
TG16K-Ⅱ高速离心机 (长沙东旺实验仪器有限公司)
1.2试验方法
1.2.1蛇皮预处理
蛇皮分离→色素等可溶性杂质的去除→烘干→破碎→脂肪去除→杂蛋白去除→烘干
1.2.2操作要点
(1)分离
对蛇皮的处理需将蛇肉与蛇皮彻底分开,避免蛇肉蛋白影响结果。
(2)色素等可溶性杂质的去除
使用质量分数为10%的Na2CO3溶液清洗蛇皮,去除色素等可溶性杂质,再以清水洗涤至pH为中性[18]。
(3)破碎
剪切成约0.5cm×0.5 cm的碎片,30℃烘干,用高速组织捣碎机捣碎。
(4)脂肪的去除
取上述处理过的碎蛇皮,按1∶20(体积质量比)用1:1无水乙醚+石油醚浸泡0.5 h,振荡处理2 h[19]。6 000 r/min离心15 min,去上清液,得沉淀,置于通风处让无水乙醚和石油醚挥发,晾干,待用。
(5)杂蛋白的去除
取上述处理过的蛇皮,按1∶16(体积质量比)加入4%NaCl溶液,振荡处理2 h,再浸提6 h[19,20]。6 000 r/min离心15 min,去上清液,得沉淀,用清水清洗,30℃烘干至恒量,备用。
1.2.3蛇皮胶原蛋白酶法提取
称取适量经预处理的蛇皮,在最适pH值条件下加入适量体积的柠檬酸(0.1 mol/L)提取液[19],加入适量木瓜蛋白酶,振荡,一定温度下,酶解一定时间。提取结束后,95℃灭酶10 min[21],6000 r/min离心15 min,收集上清液,即可得到粗提胶原蛋白溶液,于-18℃冰箱保存备用[19,20]。
1.2.4胶原蛋白提取率测定
按GB/T 96925.23-2008《肉与肉制品羟脯氨酸含量测定》测定羟脯氨酸含量,乘以相应系数而得胶原蛋白的含量[22]。采用水生动物系数11.1换算[23]。
1.2.5试验方案
(1)单因素实验
试验以胶原蛋白的提取率为目标参数,分别研究温度、pH、固液比、酶浓度、提取时间5个单因素对提取率的影响。
(2)正交实验
经单因素试验设计柠檬酸为提取溶剂,选取酶解时溶液pH值(A)、固液比(B)、酶浓度(C)、提取时间(D)作为主要参考因素,以干燥后得率为考查指标,采用正交表L9(34)进行4因素、3水平正交试验,试验因素水平见表1。

表1 正交试验设计表
2 结果与讨论
2.1单因素试验
2.1.1提取温度对蛇皮胶原蛋白提取率的影响
由图1可知,当酶浓度、提取时间、pH和料液比一定时,随着温度的升高,胶原蛋白的得率逐渐增加。在30℃时,达到最高值,得率为87.44%。随着温度的继续升高,得率开始呈现下降趋势。40℃时,胶原蛋白的得率降为77.31%,下降幅度较大。可见,当其他因素一定时,提取温度对胶原蛋白提取率的影响较大,蛇皮中胶原蛋白的最佳提取温度在30℃左右。温度太低,木瓜蛋白酶无法发挥最佳作用,胶原蛋白酶解不完全。温度太高,胶原蛋白易变性分解。
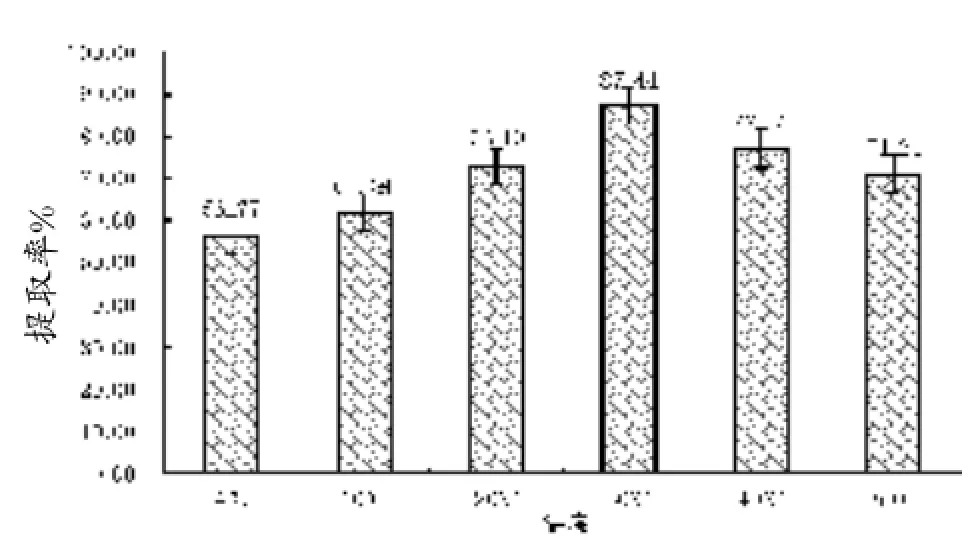
图1 提取温度对蛇皮胶原蛋白提取率的影响
2.1.2不同pH值对蛇皮胶原蛋白提取率的影响
由图2可知,当料液比、提取时间、温度、酶浓度一定时,随着pH的增加,得率呈先增加后减少趋势。在pH 6.0~7.0,得率较高,是由于在此pH范围内分子内电荷达到了平衡状态,提高了胶原蛋白的溶解速度。可见当其他因素一定仅分析pH对胶原蛋白提取率的影响,可知酶解溶液pH为6时效果最佳。由此也可知pH对酶水解活力的影响较大,但在胶原蛋白提取实际应用中还受其他因素的影响。
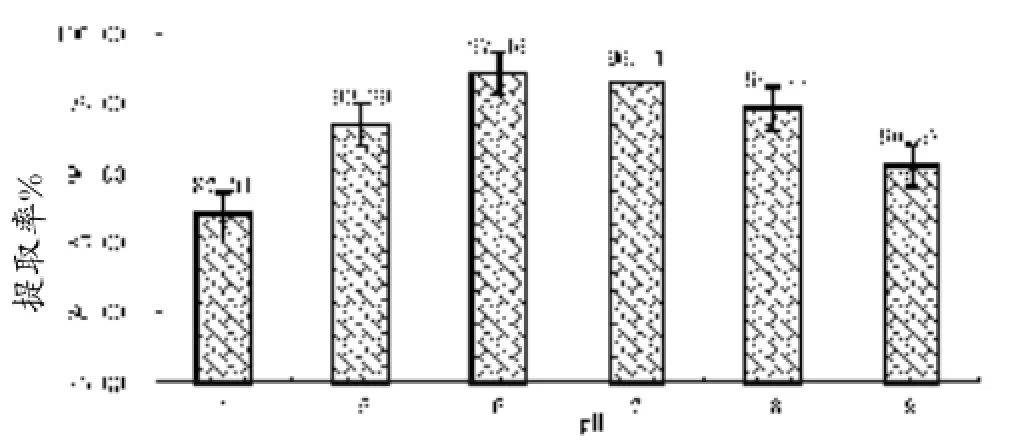
图2 不同pH值对蛇皮胶原蛋白提取率的影响
2.1.3不同固液比对蛇皮胶原蛋白提取率的影响
由图3可知,当提取温度、酶浓度、提取时间及pH一定时,随着固液比的逐渐增大,胶原蛋白的得率变化忽高忽低,但总体而言差异不明显,均为70%左右。可见,固液比对蛇皮中胶原蛋白提取率影响较小,可能是因为提取溶剂的体积对酶活力的影响较小。再者考虑到成本和提取后废液处理等因素,最后确定只需将蛇皮完全浸没,固液比以1∶10即可。
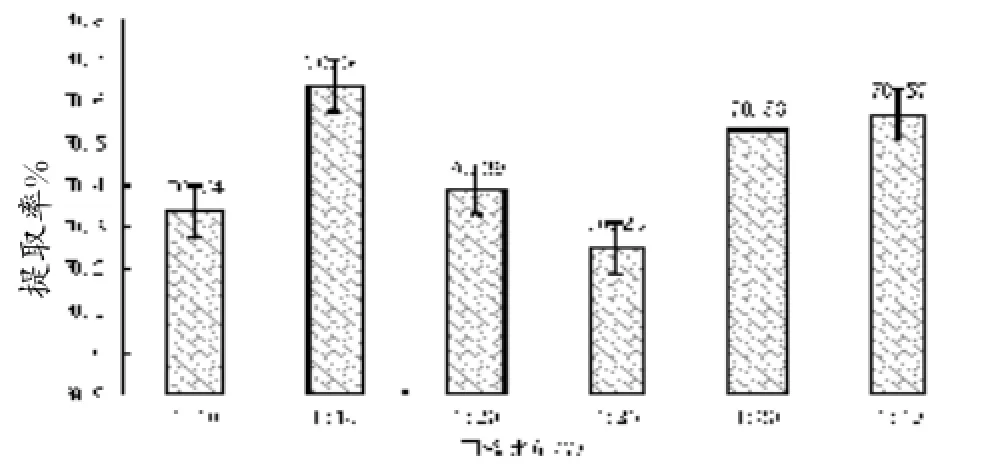
图3 不同固液比对蛇皮胶原蛋白提取率的影响
2.1.4不同酶浓度对蛇皮胶原蛋白提取率的影响
在最适温度下,相同固液比、提取时间、pH值条件下,不同酶浓度所测得的胶原蛋白提取率如图4所示。随着酶浓度的不断上升,提取率越来越高,当酶浓度增加至3.0%时提取率上升至最高,但升高趋势较平缓。

图4 不同酶浓度对蛇皮胶原蛋白提取率的影响
2.1.5不同提取时间对蛇皮胶原蛋白提取率的影响
由图5可知,当固液比、提取温度、pH和酶浓度一定时,得率在提取时间为24 h时达到最高点,为98.76%。32 h时得率为96.55%,呈现下降的趋势。可见,提取时间过短,胶原蛋白酶解不彻底,产物少;时间过长,胶原蛋白部分发生水解,影响提取得率。
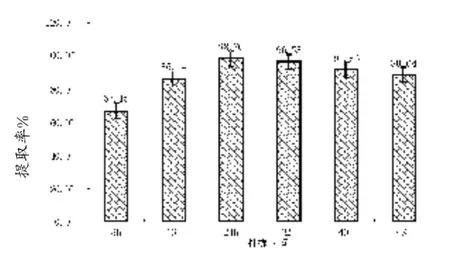
图5 不同提取时间对蛇皮胶原蛋白提取率的影响
2.2正交实验
由极差分析结果可知,各因素对胶原蛋白提取率影响程度依次为:pH值>酶浓度>固液比≈提取时间。木瓜蛋白酶提取蛇皮中胶原蛋白最佳因素水平组合为A1C3B2D2,即pH值6,酶浓度3.00%,提取时间为24h,固液比为1∶10。在此条件下得胶原蛋白的提取率为89.30%(见表2)。经重复验证,该方案可行。
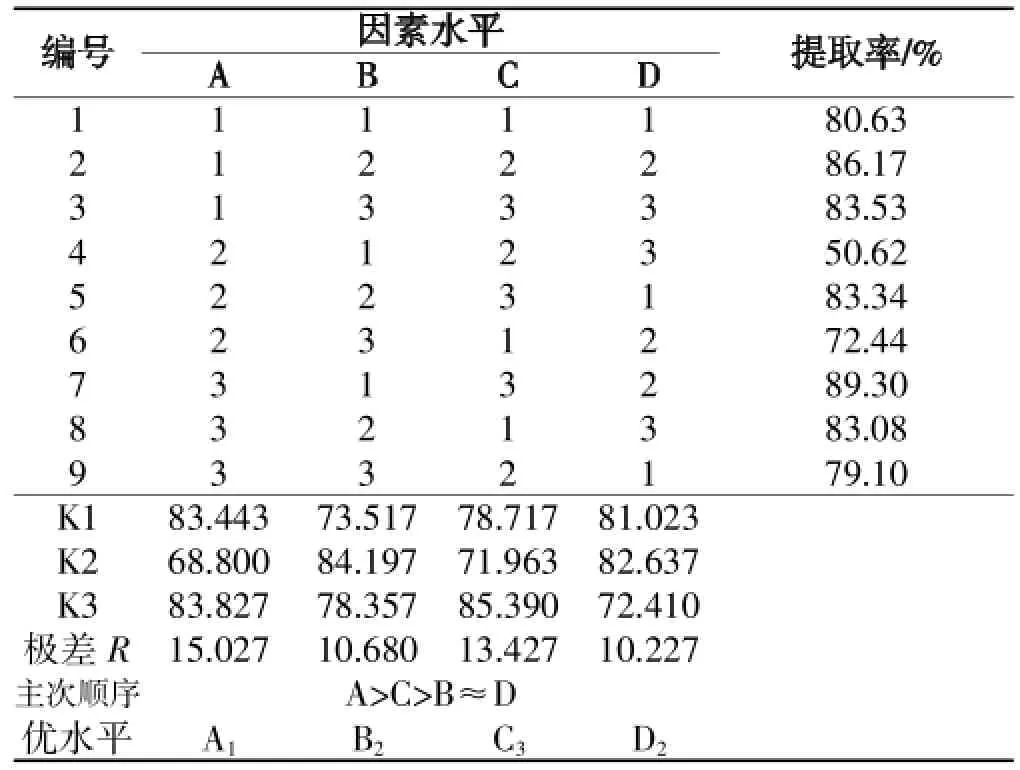
表2 正交试验结果分析
3 结论
本试验重点研究了木瓜蛋白酶提取蛇皮胶原蛋白的影响因素,对最佳工艺条件进行了分析,结果表明:木瓜蛋白酶提取蛇皮胶原蛋白的适宜工艺条件为提取温度30℃、pH值6、酶浓度3.0%、固液比1∶10、提取时间24 h。
参考文献:
[1]刘学旭,王坤余,丁运萍,等.胶原-葡甘聚糖-硫酸软骨素复合膜对全层皮肤损伤修复的实验研究[J].生物医学工程学杂志,2005(5):1004-1010.
[2]唐传核,彭志英.胶原的开发及利用[J].肉类研究,2000(3): 41-43.
[3]王学川,任龙芳,强涛涛,等.胶原蛋白的研究进展及其在化妆品中的应用[J].日用化学工业,2005(6):388-391.
[4]Kremer M,Lang E,Berger A.Organotypical engineering of differentiatedcomposite-skinequivalentsofhuman keratinocytes in a collagen-GAG matrix(intergra artificialskin)in aperfu-sion culture system[J].Langenbec-ks Arch Surg, 2001,386(5):357-363.
[5]Maruyara S,Nonaka I,Tannka H.Inhibitory effects of enzymatic hydrolysates of collagen and collagen-related synthetic petides on fibrinogen/thrombinclotting[J].Biochim biophys Acta,1993,1164(2):215-223.
[6]赵利,苏伟,胡火根,等.胶原蛋白生物活性肽的研究进展[J].食品科学,2005(9):578-582.
[7]周立珍,陈玲,李琳,等.胶原蛋白的制备及用作生物医用材料的研究进展[J].中国医药工业杂志,2004(12):761-763.
[8]Friess W.Collagen-biomaterial for drug delivery[J].Eur J Pharm Biopharm,1998(2):113-136.
[9]Willoughby CE,Batterbury M,Kaye SB.Collagen corneal shields[J].Surv Opthalmol,2002(2):174-182.
[10]肖玉良,郑连英,韩俊芬,等.胶原蛋白研究进展[J].泰山医学院学报,2005(5):493-496.
[11]张心如.胶原蛋白食品倍受青睐[J].中国保健营养,2003(7):32.
[12]Gaston Torrescano,Armida Sanchez-Escalante.Shear values ofrawsamplesof14bovinemusclesandtheirrelationtomuscle collagencharacterist ics[J].MeatScience,2003(1):85-91.
[13]Schilling M W,Mink L E,Gochenour P S,et al.Utilization of pork collagen for functionality improvement of boneless cured ham manufactured from pale,soft,and exudative pork [J].Meat Science,2003(1):547-553.
[14]Spira M,Liu B,Xu Z,et al.Human amnion collagen for soft tissueaugmentation-biochemicalcharacterizationand animal observations.[J]Biomed.Mater.Res.1994(28):91-96.
[15]PiezKA.Molecularandaggregatestructuresofthe collagens,in:K.A.Piez,A.H.Reddi(Eds.),Extracellular Matrix Biochemistry,Elserier,New York,1984:1-40.
[16]米钰,代菊红,范代娣,等.重组类人胶原蛋白I的层析分离[J].西北大学学报:自然科学版,2005(6):737-740.
[17]Berg R A.Human collagen or procollagen production from milk produced by non-human mammal transformed with appropriateexpressionsystemprovideshomogeneous produce for therapautic use.PCT WO,1994(94):16570.
[18]付强,李国英,许燕,等.天然胶原高提取率的皮预处理方法的研究[J].中国皮革,2006(1):28-35.
[19] 刁雪洋.猪皮胶原蛋白的提取及理化特性研究[D].重庆:西南大学,2010.
[20]李小勇.猪肺中胶原蛋白的提取及理化特性研究[D].重庆:西南大学,2007.
[21] 李红方,王飞飞,李作卫,等.白鲢鱼鳞胶原蛋白提取工艺条件优化研究[J].中国酿造,2012(8):58-60.
[22]Nagai T,Araki Y,Suzuki N.Collagen of the skin of ocellate pufferfish(Takifugu rubripes)[J].Food Chemistry,2002(78): 173-177.
[23]Sitthipong NaIinanon,Soottawat Benjakul,Wonnop Visessanguan,et al.Use of pepsin for collagen extraction from the skin of bigeye snapper(priacanthus tayenus)[J].Food Chemistry,2007(04):593-601.
中图分类号:TS255.36
文献标识码:A
文章编号:1674-2109(2015)06-0026-05
收稿日期:2015-03-15
基金项目:福建省科技厅重点项目(2012Y0063)。
作者简介:吴玉琼(1973-),女,汉族,副教授,主要研究方向:食品营养、食品工艺。
Research Process on the Extraction of Collagen with Papain from the Skin of Snake
WU Yuqiong1,LUO Hongxia1,HU Yongle1,ZHANG Jing1,WEN Aiguo2
(1.School of Tea and Food Science,Wuyi University,Wuyishan Fujian 354300; 2.Wuyishan Snakes Research Institute,Wuyishan,Fujian 354300)
Abstract:Collagen of extraction was studied from the farmed snake skin.The extraction technology including pH,papain concentration, immersion temperature,solid-liquid,immersion time was discussed.The results indicated that the optimum extracted conditions are as follows:at 30℃,in 0.1 mol/L citric acid buffer solution,the added enzyme dosage is 3.00%and the weight ratio of skin to solvent is 1 to 10,immersion time is 24 h.the recovery of the collagens was 89.30%.
Key words:snake skin;collagen;papain;optimal parameters
